Das Prostatakarzinom (PCa) ist in Deutschland mit etwa 64.000 Neuerkrankungen im Jahr die häufigste Krebserkrankung des Mannes. Die Bestimmung des prostataspezifischen Antigens (PSA), der transrektale Ultraschall (TRUS) und die digitale rektale Untersuchung sind nach wie vor die diagnostischen Standardverfahren zum Ausschluss eines PCa. Sollte einer der Parameter auffällig sein, ist bislang die randomisierte, systematische Biopsie (SB) der Prostata leitliniengerechter Standard zur histologischen Sicherung des Verdachts auf Vorliegen eines PCa [1, 2]. Üblicherweise wird in Deutschland die transrektale ultraschallgesteuerte Biopsie in Lokalanästhesie bevorzugt, da diese im ambulanten Rahmen und ohne Vollnarkose stattfinden kann. Nachteile dieses Verfahrens sind die niedrige Sensitivität von 47% und die mäßige Spezifität von 54%. In der Literatur werden PCa-Detektionsraten der systematischen Biopsie von etwa 20–30% in der Erstbiopsie, von 10–20% in der Zweit- und nur noch 5–9% in der Drittbiopsie beschrieben [3, 4, 5], bei gleichzeitiger Zunahme Biopsie-assoziierter Morbidität [4]. Ein weiteres Problem stellt die hohe Anzahl falsch-negativer Befunde (bis zu 34%) sowie die Unterschätzung der Tumoraggressivität in ca. einem Drittel der Fälle (zu niedriger Gleason-Score) dar. Somit zeigt sich, dass mit der herkömmlichen TRUS-gestützten Biopsie verdächtige Läsionen der Prostata weder sicher identifiziert noch lokalisiert werden können und damit eine zielgenaue Biopsie kaum möglich ist.
Aus diesem Grunde wurden neue Verfahren zur verbesserten Bildgebung und präziseren Biopsie-Durchführung entwickelt: die Elastografie, der kontrastverstärkende Ultraschall (CEUS), die computergestützte Analyse von Ultraschallbildern der Prostata (ANNAcTRUS) und die MRT-gestützte Biopsie. Insbesondere bei Patienten mit negativer Erst- oder Zweitbiopsie zeigen sich Vorteile durch die Nutzung solcher Verfahren. Für einige dieser Verfahren konnte in Studien bereits eine Erhöhung der Detektionsraten nachgewiesen werden. Beispielsweise konnte für das ANNAcTRUS-Verfahren eine Erhöhung der Treffsicherheit auf ca. 40–45% im Rahmen der ultraschallgestützten Biopsie gezeigt werden [5].
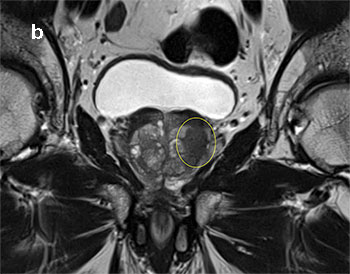
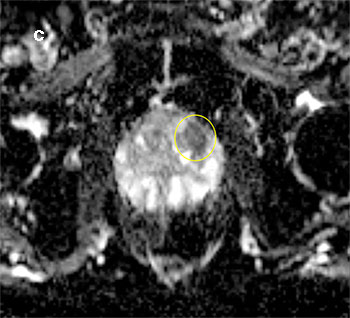
Die multiparametrische Magnetresonanztomografie (mpMRT) kombiniert morphologische Bilder der T2-gewichteten Sequenzen mit verschiedenen funktionellen Sequenzen – diffusionsgewichtet (DWI) und dynamisch-kontrastmittelverstärkt (DCE) – und lässt somit neben der anatomischen auch die Beurteilung des biologischen Zellverhaltens der Prostata zu. Die Befunde werden in einem standardisierten Befundungsschema nach PI-RADS, Version 2 (Prostate Imaging – Reporting and Data System) beurteilt [6]. Bei sehr auffälligen Befunden (PI-RADS-Score 4 und 5) sollte dem Patienten eine gezielte Prostata-Stanzbiopsie unbedingt empfohlen werden. Es existieren aktuell mehrere Möglichkeiten zur Durchführung einer solchen MRT-gestützten Biopsie: die In-bore-Biopsie (MRT-IBB), die MRT/Ultraschall-softwarebasierte Fusionsbiopsie (MRT-FB) und die Biopsie nach „kognitivem Mapping“ (KOG-B).
In dem folgenden Artikel werden die einzelnen MRT-gestützten Biopsieverfahren vorgestellt und die Ergebnisse aktueller Studien zur Nutzbarkeit und diagnostischen Genauigkeit der Verfahren dargelegt und zusammengefasst. Hierzu erfolgte eine systematische Literaturrecherche in Pubmed zu den Stichwörtern: fusion guided prostate biopsy, in-bore prostate biopsy, prostate cancer, image-guided prostate biopsy.