Hirntumoren: Personalisierung der Behandlung und Immuntherapien
Klinische und molekulare Risikoabschätzung greifen ineinander
Dass die klinische Risikoabschätzung, die sich vor allem auf das Alter des Patienten und das Ausmaß der chirurgischen Resektion des Tumors stützt, auch im Zeitalter der molekularen Diagnostik noch Bedeutung hat, zeigte Enrico Franceschi, Bologna, in einer retrospektiven Analyse von 198 konsekutiven Patienten, die im Rahmen der italienischen Neuroonkologie-Studiengruppe behandelt worden waren [1]: Ihr medianes Alter lag bei 38 Jahren, gut ein Viertel der Tumoren war komplett, etwa 60% waren partiell reseziert worden. Bei 80% hatte sich eine Mutation im Gen für die Isocitrat-Dehydrogenase (IDH) 1 oder 2 gefunden, bei 41% eine 1p/19q-Kodeletion und bei 57% eine Methylierung des MGMT-Promotors. Patienten mit geringem klinischem Risiko nach den Kriterien der Radiation Therapy Oncology Group (RTOG) überlebten median 211 Monate, solche mit hohem Risiko nur 145 Monate (p = 0,02). Mutation von IDH1 oder 2 spielten ebenfalls eine Rolle: Waren sie vorhanden, lag das mediane Überleben bei 186 Monaten mit bzw. bei 146 Monaten ohne 1p/19q-Kodeletion; waren aber IDH1 und 2 beide nicht mutiert, so schafften es die Patienten nur auf median 33 Monate (p < 0,001).
In der multivariaten Analyse blieben sowohl klinisches Risiko (HR 0,112; p = 0,032) als auch IDH-Mutationen (HR 0,064; p < 0,001) als signifikante Determinanten des Überlebens bestehen. Obwohl die Prognose von Patienten mit Low-grade-Gliomen durch molekulare Charakteristika definiert wird, verbleibt also auch für die klinische Risikoabschätzung weiterhin eine Rolle, die in künftigen klinischen Studien nicht vergessen werden sollte.
Gliome mit BRAF-Mutation: BRAF-Inhibitor wirksam
Ein Beispiel dafür, wie konkret die Personalisierung der Therapie anhand von molekularen Markern künftig in der Neuroonkologie aussehen könnte, präsentierte Mark Kieran, Boston, [2] – man muss dafür nur dem Beispiel der Dermatoonkologen folgen: Kinder mit niedrig-malignen Gliomen sind häufig heilbar, aber um den Preis von Langzeitfolgen durch die kranielle Radiotherapie. Da ungefähr jeder zehnte dieser Tumoren eine Punktmutation des V600-Kodons im Gen für die BRAF-Kinase trägt, machte man sich in einer internationalen Phase-I/II-Studie die Erkenntnisse aus der klinischen Melanom-Forschung zunutze, wo etwa die Hälfte der Tumoren eine solche Mutation aufweist. Der BRAF-Inhibitor Dabrafenib, der dort seit Jahren zugelassen ist, wurde in der Phase I der Studie bei 15 pädiatrischen Patienten mit BRAF-mutiertem Gliom vorsichtig aufdosiert bis zu einer Tagesdosis von 4,5 mg/kg bei über bzw. 5,25 mg/kg bei unter 12-jährigen Patienten. Diese Dosierungen erhielten anschließend in der Phase II 17 weitere Patienten.
Insgesamt 13 der 32 Patienten sprachen auf die Behandlung an (41%), davon einer mit einer kompletten Remission; acht dieser Patienten sind nach wie vor in Remission. Weitere 13 Kinder erreichten eine Krankheitsstabilisierung für mindestens sechs Monate, die bei elf von ihnen anhält (Abb. 1).
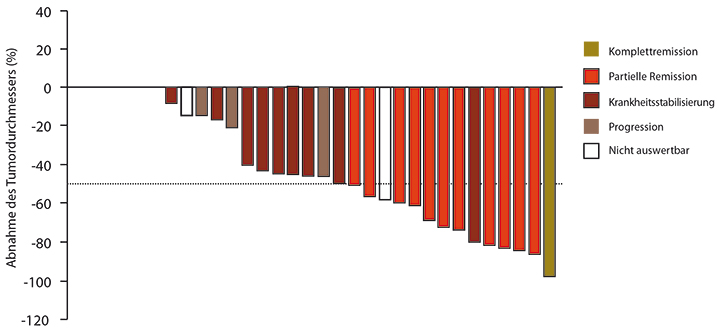
Die Verträglichkeit von Dabrafenib war sehr gut: In einem Fall gab es eine allergische Reaktion, die ein Absetzen erforderte, ansonsten lediglich vorübergehendes Fieber, Magenbeschwerden, Fatigue und Hautausschläge von geringen Schweregraden. Es wurden keine Plattenepithelkarzinome beobachtet, wie sie bei Melanom-Patienten unter der alleinigen Therapie mit BRAF-Inhibitoren auftreten können. Trotzdem sind Studien geplant, in denen auch bei pädiatrischen Gliom-Patienten BRAF- und MEK-Inhibitoren kombiniert werden sollen, weil man dadurch nicht nur die Nebenwirkungen zu vermindern, sondern auch die Wirksamkeit noch zu steigern hofft, so Kieran.
Immuntoxin bei EGFR-Amplifikation vielversprechend
Bei fast der Hälfte aller Glioblastome ist das Gen für den Rezeptor des epidermalen Wachstumsfaktors (EGFR) amplifiziert. Die Behandlung mit verfügbaren EGFR-Inhibitoren (Antikörper bzw. Tyrosinkinaseinhibitoren) hat bisher keinen Nutzen in dieser Situation gezeigt. In dem neuen Immuntoxin ABT-414 ist ein monoklonaler Anti-EGFR-Antikörper mit einem Spindelgift (Monomethyl-Auristatin F) gekoppelt. Der Antikörper bindet an ein extrazelluläres Epitop des Rezeptors, das ausschließlich in dessen aktiver Konformation „sichtbar“ ist. Das Immuntoxin wird nur in Zellen eingeschleust, in denen der EGFR wegen der Amplifizierung des Gens überexprimiert wird bzw. eine 267 Aminosäuren lange Deletion aufweist (EGFRvIII).
ABT-414 hat in präklinischen Studien gute Wirksamkeit beim rezidivierten Glioblastom mit EGFR-Amplifikation gezeigt und wurde in einer Phase-Ib-Studie getestet, die Andrew Lassman, New York, in Kopenhagen vorstellte [3]. Die Patienten hatten nach Radiotherapie und Temozolomid ein Rezidiv erlitten und erhielten ABT-414 in Kombination mit einer Re-Exposition gegenüber Radiotherapie und Temozolomid.
Von 51 bisher behandelten Patienten zeigten sechs eine partielle Remission, 23 eine Krankheitsstabilisierung und die übrigen 21 eine Progression der Erkrankung. Nach sechs Monaten lagen die progressionsfreie Überlebensrate bei 23,5% und die Gesamtüberlebensrate bei 69,7%, so Lassman. Drei der Patienten mit Remission und vier von denen mit einer Stabilisierung befinden sich noch in Behandlung.
Die häufigsten Nebenwirkungen waren Sehstörungen (53%) und Photophobie (34%). Ansonsten traten häufig neurologische Symptome auf, die eher als tumorbedingt denn als Folge der Medikation angesehen wurden. Derzeit läuft eine internationale, randomisierte Phase-II-Studie, an der auch deutsche Zentren beteiligt sind und in der ABT-414 alleine oder in Kombination mit Temozolomid verglichen wird, mit einer Re-Exposition gegenüber Temozolomid oder (bei Temozolomid-refraktären Patienten) einer Lomustin-Monotherapie.
Immun-Checkpoint-Blockade: Vorsicht bei Bildgebung
Immuntherapien werden auch bei Hirntumoren getestet: Vielversprechend, so Franceschi, sind die Ergebnisse der CheckMate-143-Studie, in der Patienten mit Glioblastom und einem Rezidiv nach Radiotherapie/Temozolomid den PD-1-
Antikörper Nivolumab alleine oder in Kombination mit dem CTLA-4-Antikörper Ipilimumab erhalten hatten – mit Überlebensraten nach sechs Monaten von 70–80% und nach zwölf Monaten zwischen 30% und 40%. Derzeit läuft die randomisierte Phase-II-Studie CheckMate-548, die Michael Weller, Zürich, vorstellte [4]: Darin erhalten Patienten mit neu diagnostiziertem Glioblastom die Standardtherapie aus Bestrahlung und Temozolomid und dazu randomisiert und einfach verblindet entweder Nivolumab oder Placebo.
Ein Problem bei der Interpretation der Ergebnisse von Immuntherapien ist das Auftreten einer Pseudoprogression: Dazu hat die RANO-Arbeitsgruppe (Response Assessment in Neuro-Oncology) kürzlich ergänzende Kriterien für immuntherapeutische Studien (iRANO) publiziert [5]. Darin wird insbesondere empfohlen, dass eine innerhalb von sechs Monaten nach Beginn der Immuntherapie auftretende radiologische Progression (einschließlich das Auftreten neuer Läsionen) durch erneute Bildgebung bestätigt werden sollte.
Josef Gulden
Literatur
1. Franceschi E et al. ESMO 2016, Abstract #323O.
2. Kieran M et al. ESMO 2016, Abstract #LBA19_PR.
3. Lassman A et al. ESMO 2016, Abstract #326PD.
4. Weller M et al. ESMO 2016, Abstract #356TIP.
5. Okada H et al. Lancet Oncol 2015; 16: e534-42.

