Einleitung
Das Multiple Myelom (MM) ist eine maligne lymphoproliferative Erkrankung terminal differenzierter B-Zellen (Plasmazellen), die primär im Knochenmark lokalisiert ist [1]. Nach heutigem Kenntnisstand durchlaufen alle Patienten mit Multiplem Myelom zunächst asymptomatische Phasen, in denen ohne klinische Symptome bereits monoklonale Plasmazellen im Knochenmark nachweisbar sind (Monoklonale Gammopathie unbestimmter Signifikanz [MGUS], Smoldering Multiple Myeloma [SMM]; [2, 3]). Die wichtigsten Ziele der Diagnostik beim Multiplen Myelom sind die Diagnosesicherung, die Stellung der Therapieindikation sowie die Prognoseabschätzung. In diesem Artikel werden Empfehlungen zu Labor- und Knochenmark-Diagnostik (Zusammenfassung siehe Tab. 1) sowie Diagnose- und Therapieindikationsstellung beschrieben. Die bildgebenden Untersuchungen werden in einem weiteren Kapitel dieser Ausgabe separat diskutiert.

Labordiagnostik
Serumprotein-Elektrophorese (SPE) und Immunfixations-Elektrophorese (IFE)
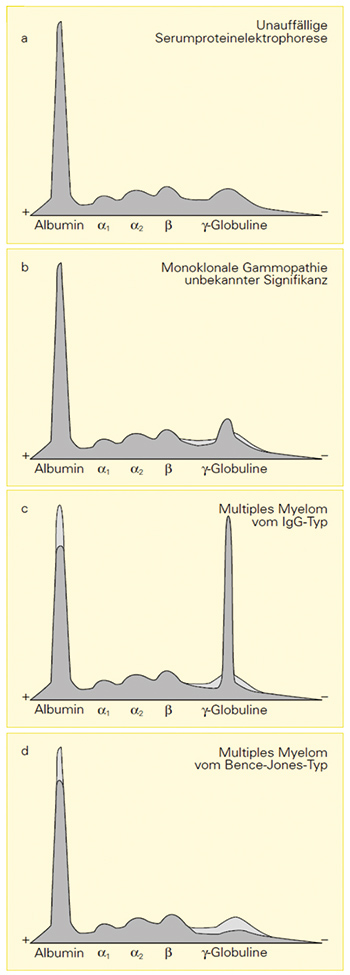
Die SPE hat einen zentralen Stellenwert als Screening- und Verlaufsuntersuchung bei monoklonalen Gammopathien. Höhere Konzentrationen monoklonaler Proteine bedingen einen schmal-basigen M-Gradienten (Abb. 1) und gehen wiederholt auch mit einer Hypoalbuminämie einher. Das „M” leitet sich ab von der Monoklonalität des Immunglobulins, welche durch die IFE festgestellt wird. Bei klinischem Verdacht auf eine monoklonale Gammopathie sollte eine IFE auch dann veranlasst werden, wenn in der SPE kein M-Gradient abgegrenzt werden kann, da bei monoklonalen Gammopathien vom Leichtketten-/Bence Jones-, IgD- oder IgE-Typ in der Regel kein M-Gradient in der SPE abgrenzbar ist. In diesen Fällen findet sich in der SPE häufig eine Hypogammaglobulinämie als Ausdruck eines sekundären Antikörpermangels. In den seltenen Fällen eines asekretorischen MM bleibt auch die IFE unauffällig und die Erkrankung kann nur über die Knochenmarkdiagnostik bzw. gezielte Biopsie einer Läsion zuverlässig diagnostiziert werden.
Freie Leichtketten (FLC) im Serum und FLC-Ratio
Freie Leichtketten werden im Rahmen der Immunglobulin-Produktion im Überschuss synthetisiert und sezerniert. Die Bestimmung der FLC im Serum mittels Freelite®-Test [4] sollte initial aufgrund der Relevanz für die Therapieindikationsstellung (s. u.) bei allen Patienten mit monoklonaler Gammopathie erfolgen. Bei Patienten, bei denen die FLC im Serum den einzigen Verlaufsparameter darstellen und bei allen Patienten mit SMM (zur Erkennung des Eintretens einer Therapieindikation im Verlauf, s. u.) sollte der Freelite®-Test im Verlauf kontrolliert werden. Während erhöhte Serumkonzentrationen auch bei polyklonalen Hypergammaglobulinämien oder Niereninsuffizienz vorkommen, gilt eine Erhöhung des FLC-Quotienten (kappa/lambda) als Hinweis auf monoklonale plasmazellproliferative Erkrankungen.
Hämatologische Parameter
Ein Teil der Patienten mit MM weist bei Diagnosestellung eine normozytäre, normochrome Anämie auf; differenzialdiagnostisch müssen hier andere Anämie-Ursachen ausgeschlossen werden. Wichtigste Ursache für die MM bedingte Anämie ist die Verdrängung der normalen Hämatopoese durch maligne Plasmazellen im Knochenmark; darüber hinaus können weitere Faktoren wie Zytokin-Veränderungen und Niereninsuffizienz ursächlich sein.
Im Differenzialblutbild sind bei Erstdiagnose selten Plasmazellen nachweisbar. Beträgt der Anteil an Plasmazellen im peripheren Blut mehr als 20% oder mehr als 2,0/nl, liegt eine Plasmazell-Leukämie vor; dies wird vor allem bei Patienten mit stark vortherapiertem, refraktärem MM (sog. sekundäre Plasmazell-Leukämie) beobachtet.
Biochemische Parameter
Die Untersuchung der Nierenfunktion durch Bestimmung der glomerulären Filtrationsrate (GFR) und des Serum-Kreatinins sind von großer therapeutischer und prognostischer Bedeutung. Eine Hyperkalzämie durch Freisetzung von Kalzium aus dem plasmazellulär infiltrierten Knochen ist ebenfalls für die Therapieindikationsstellung relevant. Eine Hyperkalzämie muss aufgrund des Risikos für eine Nierenschädigung und eine hyperkalzämische Krise sofort behandelt werden. Die Laktatdehydrogenase im Serum kann, bedingt durch eine verstärkte Proliferation der malignen Plasmazellen, erhöht sein, was prognostisch ungünstig ist; andere Zustände mit einem vermehrten Zelluntergang wie z. B. eine hämolytische Anämie sind auszuschließen. Eine Erniedrigung des Serum-Albumins tritt im Rahmen des MM Zytokin-vermittelt auf und geht, wie auch die Erhöhung des β2-Mikroglobulin-Spiegels im Serum, als Prognosefaktor in die R-ISS Klassifikation ein. Ein hoher β2-Mikroglobulin-Spiegel ist Ausdruck einer hohen Tumormasse; eine eingeschränkte Nierenfunktion erhöht die β2-Mikroglobulin-Konzentration aufgrund verminderter glomerulärer Filtration zusätzlich und ist ebenfalls prognostisch ungünstig. Erhöhungen des C-reaktiven Proteins (CRP) können durch das MM bedingt sein (stimuliert über vermehrte Produktion von Interleukin 6); differenzialdiagnostisch sollten sie aber in jedem Fall eine sorgfältige Infekt-Diagnostik nach sich ziehen.
Proteinanalyse im Urin
Eine Leichtketten-Ausscheidung im Urin (Bence-Jones-Proteinurie) lässt sich bei Patienten mit Leichtketten-Myelom und bei etwa der Hälfte der MM-Patienten mit vollständigem monoklonalem Immunglobulin im Serum nachweisen. Das Erkennen einer Bence-Jones-Proteinurie ist relevant, da von ihr die Gefahr der Nierenschädigung ausgeht. Die Urinprotein-Elektrophorese und die Immunfixation zum quantitativen bzw. qualitativen Nachweis einer Bence-Jones-Proteinurie gelten nach wie vor als methodischer Standard. In der Primärdiagnostik ist eine Differenzierung zwischen Leichtketten und Albumin im Urin unerlässlich. Während die Leichtketten-Ausscheidung eine direkte Folge der vermehrten Leichtketten-Produktion durch die malignen Plasmazellen ist, spiegelt die Albuminurie den renalen Glomerulus-Schaden wider und kann ein abklärungsbedürftiger Hinweis auf das Vorliegen einer Amyloidose sein. Eine Quantifizierung der freien Leichtketten im Urin mittels Freelite®-Test ist aufgrund der Schwankungsbreite der Ergebnisse trotz bestehender Zulassung nicht zu empfehlen.
Knochenmark-Diagnostik
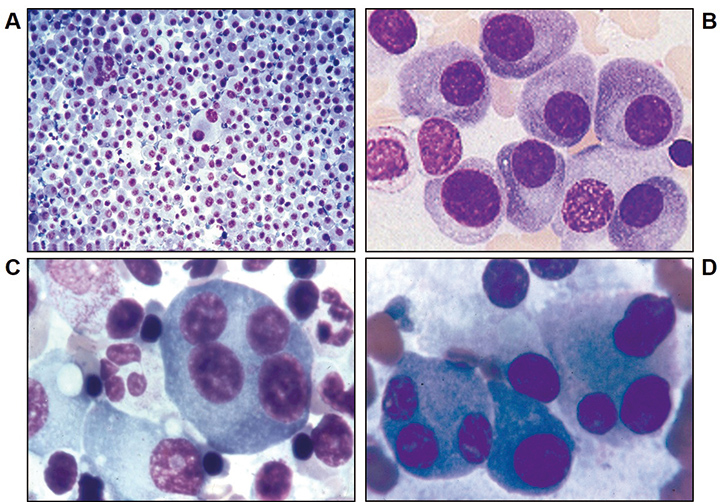
Durch Beckenkamm-Punktion ist Knochenmark für die zytologische (Knochenmark-Aspiration, Abb. 2), histologische (Knochenmark-Stanze nach Jamshidi) und ggf. zytogenetische sowie durchflusszytometrische Diagnostik zu gewinnen. In der Knochenmark-Diagnostik können folgende Eigenschaften beurteilt werden:
• Quantitative Bestimmung der Plasmazellen im Verhältnis zur übrigen Hämatopoese,
• Immunhistologie, Durchflusszytometrie (Monoklonalität anhand Leichtketten-Restriktion, Immunphänotyp der Plasmazellen, gewebsbasierte Biomarker),
• Morphologie der Plasmazellen (z. B. reife oder unreife Plasmazellen),
• Plasmazell-Proliferation (Plasmazell-Labeling-Index oder Ki-67-Färbung),
• Amyloid-Nachweis,
• Beurteilung der physiologischen Hämatopoese.
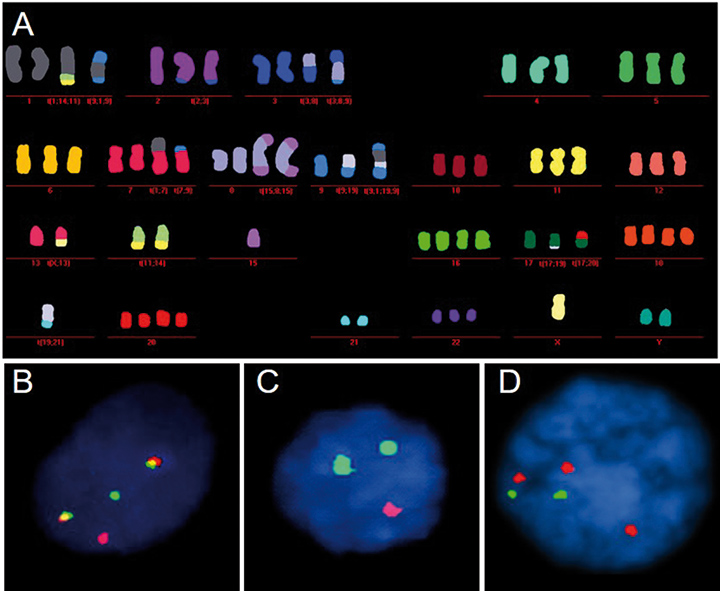
Im Rahmen der Knochenmark-Aspiration sollte zum Diagnosezeitpunkt und vor Therapiebeginn zudem Material für eine zytogenetische Charakterisierung des Myelomzell-Klons mittels Fluoreszenz-in-situ-Hybridisierung (FISH; Abb. 3) entnommen werden. Dieses Knochenmark-Punktat ist an spezialisierte Laboratorien zu senden.
Diagnosestellung und Therapieindikation
Die Diagnosesicherung erfolgt nach den 2014 aktualisierten Diagnosekriterien der International Myeloma Working Group [5]. Voraussetzung für die Diagnose des Multiplen Myeloms und damit der systemischen Therapiepflichtigkeit sind eine klonale Plasmazell-Infiltration von mindestens 10% in der Knochenmark-Zytologie/-Histologie oder ein bioptisch gesicherter Plasmazell-Tumor. Weiterhin muss mindestens ein klassisches CRAB-Kriterium (Hyperkalzämie, Anämie, Nierenfunktionseinschränkung oder Knochenläsion) oder ein Biomarker vorliegen (Tab. 2).

Während erfüllte CRAB-Kriterien bereits eine Myelom-bedingte Organschädigung anzeigen, wurden die Biomarker im Rahmen der Aktualisierung der Diagnosekriterien eingeführt, um solche klinisch manifestierten Schäden durch frühzeitige Therapie zu vermeiden. Zentrales Kriterium bei der Auswahl der im Folgenden aufgeführten Biomarker war deren Assoziation mit einem Risiko von mindestens 80% für das Eintreten klassischer CRAB-Kriterien innerhalb der nächsten zwei Jahre.
Eine klonale Plasmazell-Infiltration von mindestens 60% [6, 7], mindestens zwei fokale ossäre Läsionen im MRT [8, 9] bzw. eine FLC-Ratio im Serum > 100 [7, 10] liegen bei 2–8%, 14–15% bzw. 7–15% der bisher als SMM geführten Patienten vor und gehen mit einer medianen Zeit bis zum Eintreten klassischer CRAB-Kriterien von 7–15, 13–15 bzw. 13–15 Monaten einher. Insbesondere bei Vorliegen fokaler Läsionen im MRT müssen andere Differenzialdiagnosen ausgeschlossen werden; im Zweifelsfall sollte vor Therapieeinleitung eine bildgebende Kontrolle nach drei bis sechs Monaten zur Beurteilung der Progression der Läsionen [11] oder eine gezielte Biopsie einer Läsion erfolgen. Eine FLC-Ratio im Serum > 100 sollte vor Therapieeinleitung immer durch wiederholte Bestimmung zu einem weiteren Zeitpunkt bestätigt werden. Generell sind bei Therapieindikationsstellung einzig aufgrund eines Biomarkers die Gesamtsituation des Patienten und ggf. der bisherige Verlauf in die Entscheidung miteinzubeziehen.
Sind bei Vorliegen einer monoklonalen Gammopathie die genannten Kriterien für ein therapiepflichtiges Multiples Myelom nicht erfüllt, so ist zu unterscheiden zwischen den beiden asymptomatischen und nicht therapiebedürftigen Vorstufen MGUS und SMM. Die Unterscheidung erfolgt hier anhand der plasmazellulären Infiltration (Cut-off-Wert 10%), der Konzentration von M-Protein (IgG oder IgA; Cut-off-Wert 30 g/l) oder der Leichtketten-Ausscheidung im Urin (Cut-off-Wert 500 mg pro Tag). Verlaufskontrollen sollten bei Patienten mit MGUS bzw. SMM in jährlichen bzw. vierteljährlichen Abständen stattfinden.
Als Sonderfall zu betrachten ist das solitäre Plasmozytom, welches lokal, in der Regel mittels Radiotherapie, behandelt wird.
Prognose
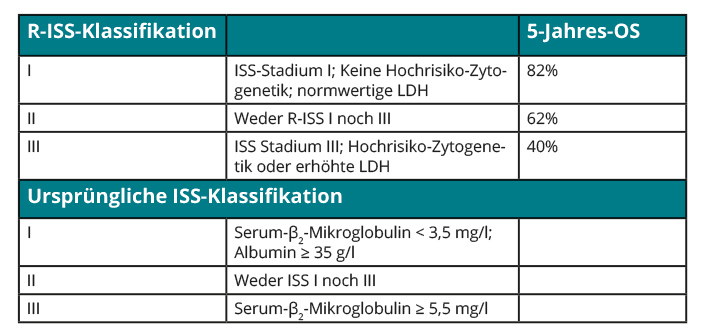
Eine Heilung des Multiplen Myeloms ist trotz deutlicher Prognoseverbesserung durch die Einführung neuer Therapeutika (medianes Gesamtüberleben ca. sechs Jahre [12]) bei den meisten Patienten nicht möglich. Zahlreiche klinische (Allgemeinzustand) und Laborparameter (Beta-2-Mikroglobulin, Albumin, LDH), sowie molekularbiologische Charakteristika (chromosomale Aberrationen, Genexpressionsprofile) sind mit dem progressionsfreien und/oder dem Gesamtüberleben (PFS bzw. OS) beim Multiplen Myelom assoziiert [13]. Mittels zytogenetischer Untersuchungen (FISH) können folgende prognostisch ungünstige chromosomale Aberrationen in den angegebenen Häufigkeiten detektiert werden: Translokation (4;14) (15%), Translokation (14;16) (4%), Deletion 17p13 (7%) und Zugewinn +1q21 > 3 Kopien (5%; [14, 15]). Das Überleben von Patienten mit prognostisch ungünstigen chromosomalen Aberrationen lässt sich z. B. durch eine langfristige Bortezomib-haltige Therapie verbessern [15]. Die Stadieneinteilung gemäß Revised International Staging System (R-ISS [16]) vereinigt Laborparameter und Zytogenetik in einem gemeinsamen prognostischen Modell (Tab. 3) und sollte bei Diagnose bzw. vor Therapiebeginn aufgrund der großen Unterschiede im Überleben von Patienten mit MM (wenige Monaten bis über zehn Jahre) erhoben werden.
Hinsichtlich der Prognoseabschätzung und längerfristig möglicherweise auch der Therapiesteuerung wird zukünftig die Minimal Residual Disease (MRD)-Diagnostik an Bedeutung gewinnen. Diese sehr sensitive Untersuchung zur Detektion geringster Mengen nach Therapie weiterhin vorhandener maligner Plasmazellen erfolgt derzeit noch im Rahmen von Studien und wird in einem anderen Beitrag in dieser Ausgabe diskutiert.
Das Überleben von Patienten mit Hochrisiko-SMM konnte durch eine frühzeitige Therapie mit neuen Therapeutika vor dem Eintreten klassischer CRAB-Kriterien verlängert werden [17]. Unter anderem führte dies 2014 zur Aufnahme der oben genannten Biomarker in die Diagnosekriterien des therapiepflichtigen Multiplen Myeloms.
Für Personen mit MGUS besteht ein Risiko von ca. 1% pro Jahr, ein MM oder eine verwandte Erkrankung zu entwickeln; abhängig von verschiedenen prognostischen Faktoren können Subgruppen mit niedrigerem oder höherem Risiko unterschieden werden [18]. Für Patienten mit SMM beträgt das Risiko, CRAB-Kriterien zu entwickeln, je nach Anzahl vorliegender Risikofaktoren
25–75% innerhalb von fünf Jahren [19].
Literatur
1. Röllig C et al. Multiple myeloma. Lancet 2015; 385: 2197–208.
2. Landgren O et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: A prospective study. Blood 2009; 113: 5412–7.
3. Weiss BM et al. A monoclonal gammopathy precedes multiple myeloma in most patients. Blood 2009; 113: 5418–22.
4. Bradwell AR et al. Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clin Chem 2001; 47: 673–80.
5. Rajkumar SV et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538–e548.
6. Rajkumar SV et al. Diagnosis of smoldering multiple myeloma. N Engl J Med 2011; 365: 474–5.
7. Kastritis E et al. Extensive bone marrow infiltration and abnormal free light chain ratio identifies patients with asymptomatic myeloma at high risk for progression to symptomatic disease. Leukemia 2013; 27: 947–53.
8. Hillengass J et al. Prognostic significance of focal lesions in whole-body magnetic resonance imaging in patients with asymptomatic multiple myeloma. J Clin Oncol 2010; 28: 1606–10.
9. Kastritis E et al. The prognostic importance of the presence of more than one focal lesion in spine MRI of patients with asymptomatic (smoldering) multiple myeloma. Leukemia 2014; 28: 2402–3.
10. Larsen JT et al. Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma. Leukemia 2013; 27: 941–6.
11. Merz M et al. Predictive value of longitudinal whole-body magnetic resonance imaging in patients with smoldering multiple myeloma. Leukemia 2014; 28: 1902–8.
12. Kumar SK et al. Continued improvement in survival in multiple myeloma: Changes in early mortality and outcomes in older patients. Leukemia 2014; 28: 1122–8.
13. Chng WJ et al. IMWG consensus on risk stratification in multiple myeloma. Leukemia 2014; 28: 269–77.
14. Sonneveld P et al. Treatment of multiple myeloma with high-risk cytogenetics: A consensus of the International Myeloma Working Group. Blood 2016; 127: 2955–62.
15. Neben K et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. Blood 2012; 119: 940–8.
16. Palumbo A et al. Revised International Staging System for multiple myeloma: A report from International Myeloma Working Group. J Clin Oncol 2015; 33: 2863–9.
17. Mateos M-V et al. Lenalidomide plus dexamethasone versus observation in patients with high-risk smouldering multiple myeloma (QuiRedex): Long-term follow-up a randomised, controlled, phase 3 trial. Lancet Oncol 2016; 17: 1127-36.
18. Rajkumar SV et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106: 812–7.
19. Dispenzieri A et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering (asymptomatic) multiple myeloma. Blood 2008; 111: 785–9.

Dr. med. Marc-Andrea Bärtsch
(korrespondierender Autor)
Universitätsklinikum Heidelberg
Im Neuenheimer Feld 410, 69120 Heidelberg
+49 6221/56 8030
E-Mail schreiben
Prof. Dr. Kai Neben
Klinikum Mittelbaden
Balger Str. 50, 76532 Baden-Baden
Prof. Dr. Mindaugas Andrulis
Universitätsklinikum Ulm
Albert-Einstein-Allee 23, 89070 Ulm