Neues zu Lungentumoren
ASCO 2016
Lungentumoren zählen schon aufgrund ihrer Häufigkeit immer zu den besonderen Schwerpunkten allgemeiner onkologischer Kongresse – so auch wieder bei der diesjährigen Jahrestagung der American Society of Clinical Oncology (ASCO). Die Immuncheckpoint-Inhibitoren werden derzeit auf allen Teilgebieten der Thorax-Onkologie – auch bei kleinzelligem Lungenkarzinom und Mesotheliom – untersucht. Beim nicht-kleinzelligen Lungenkarzinom steht aber auch eine Vielzahl neuer niedermolekularer Kinaseinhibitoren auf dem Prüfstand.
Nicht-kleinzelliges Lungenkarzinom
Immuntherapien
Update zu Nivolumab-Zulassungsstudien
Der Anti-PD-1-Antikörper Nivolumab ist zugelassen zur Therapie des vorbehandelten lokal fortgeschrittenen oder metastasierten nicht-kleinzelligen Lungenkarzinoms (NSCLC), unabhängig von der Histologie – basierend auf den beiden Phase-III-Studie CheckMate-017 und CheckMate-057, in denen der Antikörper bei Plattenepithel- bzw. bei Nicht-Plattenepithelkarzinomen das Gesamtüberleben gegenüber einer Docetaxel-Monotherapie signifikant verlängern konnte [1, 2]. Ein Update der Ergebnisse beider Studien, das Hossein Borghaei, Philadelphia, in Chicago präsentierte, zeigt, dass der Vorteil der Immuntherapie auch nach zwei Jahren erhalten bleibt [3]: Bei den Plattenepithelkarzinomen (CheckMate-017) mit Überlebensraten von 23% vs. 8% (Hazard Ratio 0,62) und progressionsfreien Überlebensraten von 18% vs. „nicht bestimmbar“ (HR 0,63); bei den Nicht-Plattenepithelkarzinomen (CheckMate-057) lagen die entsprechenden Werte bei 28% versus 13% (HR 0,75) bzw. 12% versus 1% (HR 0,80). Je höher die Expression des PD-1-Liganden PD-L1 im Tumor, desto größer war der Unterschied im Gesamtüberleben (Abb. 1), bei Plattenepithelkarzinomen war die PD-L1-Expression weder prognostisch noch prädiktiv. CytoScores, die aus den Serumkonzentrationen verschiedener Zytokine vor Beginn der Behandlung errechnet wurden, waren in beiden Kollektiven stark mit dem Gesamtüberleben assoziiert – ein Zusammenhang, der nun in prospektiven Studien weiter erhärtet werden muss, aber keine prädiktive Bedeutung hatte.
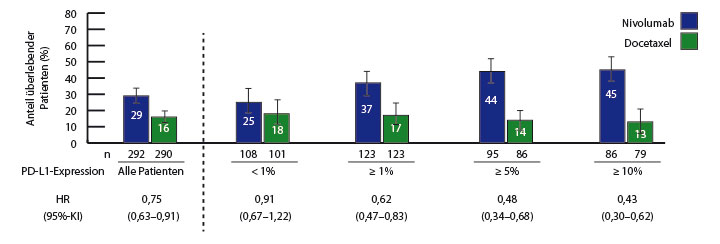
Wirksamkeit steigt mit PD-L1-Expression v. a. in Erstlinie
Die Bedeutung der PD-L1-Expression wurde auch für die Phase-I-Studie CheckMate-012 ausgewertet, in der 77 Patienten mit fortgeschrittenem, nicht vorbehandeltem NSCLC jeder Histologie mit verschieden dosierten Kombinationen aus Nivolumab und dem Anti-CTLA-4-Antikörper Ipilimumab behandelt worden waren, so Matthew Hellmann, New York [4]. Die Kombination ist mittlerweile beim malignen Melanom zugelassen; in der Situation beim NSCLC zeigte sich, dass ihre Wirksamkeit und in geringerem Maß auch die einer Nivolumab-Monotherapie mit steigender PD-L1-Expression zunahm (Abb. 2); von den 13 Patienten mit einer PD-L1-Expression auf mindestens 50% der Zellen sprachen zwölf (92%) auf die Kombinationstherapie an. Derzeit wird die Kombination aus Nivolumab und Ipilimumab in der Erstlinientherapie des NSCLC in der Phase-III-Studie CheckMate-227 untersucht [5]: Fast 2.000 Patienten mit einem NSCLC im Stadium IV oder mit Rezidiv werden hier zwischen Nivolumab-Monotherapie, Nivolumab-Ipilimumab-Kombination und einer Platin-haltigen Zweier-Chemotherapie mit oder ohne Nivolumab randomisiert. Unter den 262 Zentren weltweit nehmen auch 15 in Deutschland an dieser Studie teil.
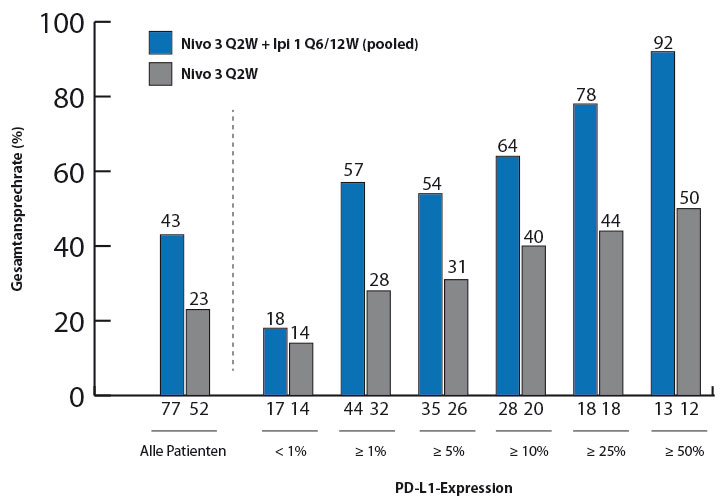
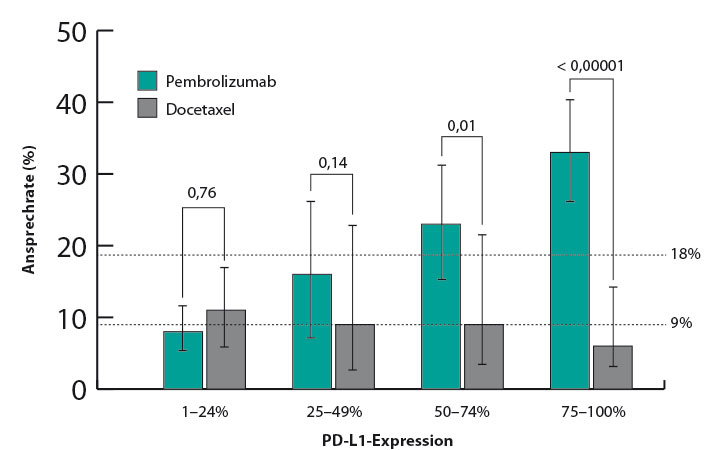
Auch der bisher noch nicht zur Behandlung von Lungentumoren zugelassene zweite PD-1-Antikörper Pembrolizumab verlängerte in der Phase-II/III-Studie KEYNOTE-010 bei vorbehandelten Patienten mit NSCLC das Überleben gegenüber Docetaxel signifikant [6]. Eingeschlossen waren nur Patienten mit messbarer PD-L1-Expression (Tumor-Proportion-Score ≥ 1%), und in einer Folgeauswertung wurde nun eine Stratifizierung nach dieser Expression vorgenommen, so Paul Baas, Amsterdam [7]. Wie Abb. 3 zeigt, nimmt die Ansprechrate mit steigender PD-L1-Expression kontinuierlich zu – aber nur unter Pembrolizumab. Auch in der niedrigsten Kategorie (1–24% Expression) ist aber ein Überlebensvorteil durch Pembrolizumab zu finden.
EGFR-Inhibitoren
Auch im Gehirn wirksam
Patienten mit leptomeningealem Befall eines NSCLC haben eine extrem schlechte Prognose. In die Phase-I-Studie BLOOM wurden solche Patienten eingeschlossen, die nach einer vorangegangenen Behandlung mit EGFR-Inhibitoren progredient gewesen waren und deren Tumor eine T790M-Mutation im Gen für den Rezeptor des epidermalen Wachstumsfaktors
(EGFR) aufwies. Sie erhielten den EGFR-Inhibitor Osimertinib, der gegen diese Mutation wirksam ist und in präklinischen Untersuchungen auch die Blut-Hirn-Schranke passieren konnte [8], in einer Dosierung von 160 mg/d, die damit doppelt so hoch ist wie die zugelassene Dosierung bei Erkrankungen ohne ZNS-Beteiligung. Das Ansprechen wurde mittels Liquor-Zytologie, intrakranieller Bildgebung und neurologischer Untersuchung überprüft.
21 Patienten, bei denen die extrakranielle Erkrankung stabil war, konnten bisher ausgewertet werden, so James Yang, Taipei; bei sieben von ihnen zeigte sich eine radiologische Besserung des intrakraniellen Geschehens, bei zweien waren in zwei aufeinander folgenden Untersuchungen keine Tumorzellen mehr im Liquor nachweisbar, und bei fünf Patienten hatte sich die neurologische Funktion gebessert. 15 der Patienten sind nach wie vor in Behandlung, sieben davon für mehr als neun Monate, was auf einen länger dauernden klinischen Nutzen hinweist.
Derzeit werden für eine zweite Kohorte Patienten rekrutiert, bei denen die extrakranielle Erkrankung nicht stabil sein muss. Die positiven vorläufigen Ergebnisse aus der ersten Kohorte rechtfertigen auf jeden Fall die weitere Erprobung des Inhibitors in dieser Indikation, so Yang. Diese Ergebnisse sind besonders relevant, da Patienten mit langfristigem Überleben bei Lungenkarzinom eine hohe Wahrscheinlichkeit für einen ZNS-Befall haben. Daher ist es bedeutsam, dass systemisch eingesetzte Medikamente eine hohe Wirksamkeit im ZNS haben können und damit eine ansonsten notwendige Ganzhirnbestrahlung auf einen späteren Zeitpunkt verschoben werden kann.
AZD3759 ist der erste EGFR-Inhibitor, der gezielt auf eine Passage der Blut-Hirn-Schranke hin entwickelt wurde, um speziell Patienten mit NSCLC und EGFR-Mutationen sowie Hirnmetastasen behandeln zu können. Auch hier wurden in einer Phase-I-Studie Patienten mit solchen Tumoren behandelt, die nach wenigstens einer EGFR-Inhibitor- und einer Chemotherapie progredient waren [9]: In einer Dosierung von mindestens 200 mg zweimal täglich wurde bei allen Patienten im Liquor eine Konzentration oberhalb der IC50 gemessen. Bei elf von 21 Patienten wurde ein Rückgang intrakranieller Läsionen unter der Behandlung registriert, mit drei bestätigten und drei unbestätigten partiellen Remissionen. Bei acht Patienten war auch ein Rückgang extrakranieller Läsionen zu verzeichnen. Hier gilt das gleiche wie für Osimertinib: Die Rekrutierung von Patienten mit Hirnmetastasen und leptomeningealer Aussaat wird weitergeführt, und mittlerweile haben auch Phase-II-Studien begonnen.
Inhibitoren von ALK und anderen onkogenen Kinase
Brigatinib
Patienten mit NSCLC und einem Rearrangement des Gens für die anaplastische Lymphom-Kinase (ALK) machen zwar nur einen kleinen Anteil aller Patienten mit NSCLC aus, aber sie profitieren besonders von spezifischen ALK-Inhibitoren. Der Tyrosinkinaseinhibitor Brigatinib zeigte in einer Phase-I/II-Studie bereits Aktivität gegen ALK-positive NSCLC, die gegen den Erstgenerations-ALK-Inhibitor Crizotinib resistent waren und wurde daher in einer Phase-II-Studie, die auf eine Zulassung abzielt, randomisiert in zwei Dosierungen untersucht [10]: 90 mg/d entweder durchgehend (Arm A) oder nur für sieben Tage und im Anschluss daran die doppelte Dosis (Arm B). Primärer Endpunkt war die Gesamtansprechrate, bei der Arm B mit 54% dem anderen Arm mit 45% überlegen erschien, so Dong-Wan Kim, Seoul; bei Patienten mit intrakraniellen Metastasen lag die Rate sogar bei 67%. Ebenso schien die höhere Dosis beim medianen progressionsfreien Überleben (12,9 vs. 9,2 Monate; Hazard Ratio 0,55) besser zu sein, und selbst beim Gesamtüberleben, wo die Medianwerte in beiden Gruppen noch nicht erreicht sind, überzeugte die 180 mg-Dosis mit einer 1-Jahres-Rate von 80% versus 71% (HR 0,55). Die höhere Dosierung war – wohl aufgrund der einschleichenden Dosierung mit 90 mg/d für die ersten sieben Tage – nicht mit häufigeren frühen pulmonalen Nebenwirkungen verbunden. Aufgrund dieser positiven Ergebnisse hat eine Phase-III-Studie namens ALTA-1L bereits begonnen, in der Brigatinib bei rund 270 Patienten in der Erstlinie randomisiert mit Crizotinib verglichen werden soll [11].
Alectinib
Solche Daten aus der Phase-III- Studie J-ALEX konnte Hiroshi Nokihara, Tokyo, in Chicago für den Zweitgenerations-ALK-Inhibitor Alectinib in Chicago bereits vorstellen [12]: Nach vielversprechenden Phase-I/II-Daten für Alectinib war diese Substanz hier in einer 1 : 1-Randomisierung bei jeweils hundert nicht vorbehandelten Patienten mit ALK-positivem NSCLC mit dem Erstgenerations-Inhibitor Crizotinib verglichen worden. Bei der Gesamtansprechrate war Alectinib in der zentralen Auswertung mit 91,6% versus 78,9% überlegen, und beim primären Endpunkt progressionsfreies Überleben war der Medianwert in der Alectinib-Gruppe noch nicht erreicht, während er im Crizotinib-Arm bei 10,2 Monaten lag (HR 0,34; p < 0,0001; Tab. 1). In der Subgruppe der Patienten mit Hirnmetastasen war das progressionsfreie Überleben durch Alectinib sogar mit einer HR von 0,08 verbessert. Diese Überlegenheit galt für alle untersuchten Subgruppen, und die Randomisierung wurde nach Bekanntwerden dieser Ergebnisse aufgehoben.
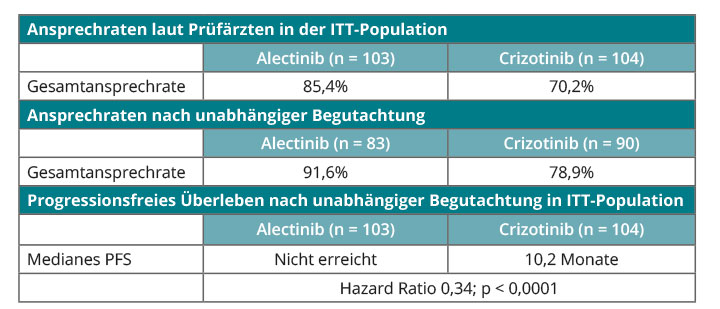
Obstipation war die einzige Nebenwirkung, die unter Alectinib bei mehr als 30% der Patienten gesehen wurde (36%), während dies im Crizotinib-Arm für Nausea (74%), Diarrhö (73%), Erbrechen (59%), Sehstörungen (55%), Dysgeusie (52%), Obstipation (46%) und Erhöhungen von ALT (32%) und AST (31%) zutraf. Auch Nebenwirkungen vom Grad 3 oder 4 traten unter Crizotinib häufiger auf (51% vs. 27%). Diese Wirksamkeit zusammen mit der guten Verträglichkeit dürfte Alectinib zu einem neuen Standard in der Erstlinientherapie ALK-positiver NSCLC-Erkrankungen machen, so Nokihara.
Lorlatinib
In einer Phase-I-Studie ohne Vergleichsarm wurde der Inhibitor Lorlatinib, der sowohl ALK als auch die ROS-Kinase inhibiert und gegen die meisten bekannten Resistenz-induzierenden Mutationen von ALK wirksam ist, getestet [13]. Von den 52 auswertbaren, teilweise stark vorbehandelten Patienten mit ALK- oder ROS-positiven NSCLC erzielte die Hälfte Remissionen, von denen sechs komplett waren, so Benjamin Solomon, Melbourne. Patienten, die vorher erst einen ALK-Inhibitor erhalten hatten, schnitten besser ab als die mit mehr vorangegangenen ALK-spezifischen Therapien (57% vs. 42%), ebenso beim progressionsfreien Überleben (median 13,5 vs. 9,2 Monate). Auch bei sechs der elf Patienten mit ROS-Translokationen wurde die Tumorlast um mehr als 30% (nach RECIST) reduziert.
Die Substanz passiert die Blut-Hirn-Schranke, was in intrakraniellen Remissionen bei zwölf von 20 Patienten mit Hirnmetastasen resultierte. Lorlatinib wird gut toleriert, die häufigste Toxizität ist eine Hypercholesterinämie, und der Phase-II-Anteil der Studie wird derzeit an 57 Zentren weltweit, darunter auch in drei deutsche Kliniken, fortgeführt und soll knapp 300 Patienten einschließen [14].
PROFILE 1007: Finale Überlebensdaten
Der erste ALK-Inhibitor Crizotinib verdankt seine Zulassung den Ergebnissen der Phase-III-Studie PROFILE 1007, in der er bei 347 Patienten mit ALK-positiven NSCLC und vorhergegangener Platin-basierter Chemotherapie das progressionsfreie Überleben gegenüber einer Standard-Zweitlinienchemotherapie mehr als verdoppelt hatte [15]. In Chicago konnte Alice Shaw, Boston, nun die finale Auswertung von Gesamtüberleben und Sicherheit nach mehr als vier Jahren Nachbeobachtung vorstellen [16]. Der Medianwert des Überlebens war in der primären Analyse nicht verlängert (21,7 vs. 21,9 Monate; HR 0,85; p = 0,11), aber das lag vor allem am Studiendesign, das ein Cross-over von der Chemotherapie zur Crizotinib-Therapie bei Progression gestattet hatte: Wenn man nur die Patienten ohne Cross-over betrachtete, so Shaw, war Crizotinib mit einer Hazard Ratio von 0,383 (95%-KI 0,283–0,518) deutlich überlegen.
Die häufigsten Nebenwirkungen waren unter dem ALK-Inhibitor Diarrhö und Sehstörungen (je 62%) sowie Übelkeit (60%), unter der Chemotherapie Übelkeit und Müdigkeit (je 36%) sowie verminderter Appetit (27%). Unter Crizotinib kam es zu drei therapiebedingten Todesfällen, unter der Chemotherapie zu einem, aber nebenwirkungsbedingte Therapieabbrüche waren unter dem ALK-Inhibitor mit 6% halb so häufig wie unter Chemotherapie (12%). Dazu passt, dass die mediane Behandlungsdauer im Crizotinib-Arm mit 48 Wochen mehr als dreimal so lang war wie im Kontrollarm (13 Wochen).
Vandetanib bei RET-positivem NSCLC
Translokationen unter Beteiligung des RET-Onkogens zählen zu den bisher identifizierten Treibermutationen beim NSCLC und treten bei 1–2% aller Patienten auf. Vandetanib ist ein Multikinase-Inhibitor, der auch gegen die RET-Kinase wirkt und deshalb in einer einarmigen japanischen Phase-II-Studie bei Patienten erprobt wurde, deren NSCLC-Tumoren ein RET-Rearrangement aufwiesen. Unter 1.536 Patienten mit fortgeschrittenem NSCLC ohne EGFR-Mutationen fanden sich in einem landesweiten Screeningprogramm 34 (2%) mit einem solchen Rearrangement im Tumorgewebe, so Takashi Seto, Fukuoka [17]. 19 in die Studie eingeschlossene Patienten erhielten 300 mg/d Vandetanib. Von 17 auswertbaren Patienten hatten fast zwei Drittel vorher mindestens zwei Chemotherapien bekommen. Neun Patienten mit partieller Remission bedeuten eine Ansprechrate von 53%, die Krankheitskontrollrate lag bei 88%, die mediane progressionsfreie Überlebenszeit bei 11,1 Monaten. Man muss sich jedoch offenbar den Fusionspartner des RET-Onkogens genauer ansehen: Patienten mit CCDC6-RET-Fusion hatten eine Ansprechrate von 83% und eine mediane progressionsfreie Überlebenszeit von 8,3 Monaten, während diese Werte bei Vorliegen einer KIF5B-RET-Fusion bei lediglich 20% und 2,9 Monaten lagen.
Daten aus den RET-Register
Bei sehr seltenen Erkrankungen, bei denen kaum jemals große randomisierte Studien möglich sein werden, ist es sinnvoll, Daten aus dem klinischen Alltag in Registern zu sammeln, um daraus zusätzliche Erkenntnisse zu ziehen. So sammelt ein globales Netzwerk von Thorax-Onkologen die Daten von Patienten mit einem NSCLC und RET-Rearrangements, die zum Teil off-label mit den verschiedensten, Erfolg versprechenden Kinaseinhibitoren behandelt werden. In eine Analyse des Registers, die Oliver Gautschi, Luzern, in Chicago vorstellte [18], gingen die Daten von 132 solchen Patienten aus Europa, den USA und Asien ein. 41 von ihnen (31%) hatten außerhalb von Studien nicht zugelassene Substanzen bekommen, darunter Cabozantinib (n = 14), Vandetanib (n = 11), Sunitinib (n = 10), Sorafenib (n = 2) und je einmal Alectinib, Lenvatinib, Nintedanib und Ponatinib. Die Gesamtansprechrate lag bei 23%, die Krankheitskontrollrate bei 57%, das progressionsfreie Überleben bei median 2,9 und das Gesamtüberleben bei median 6,8 Monaten. Von den beiden Substanzen mit den höchsten Patientenzahlen erreichten Cabozantinib und Vandetanib Ansprechraten von 62% bzw. 46%. Die Daten zu Cabozantinib sind damit besser als die aus einer laufenden Phase-II-Studie, wo die Substanz bei insgesamt 20 Patienten eine Rate an partiellen Remissionen von 28%, dafür allerdings Krankheitsstabilisierungen bei allen übrigen Patienten bewirkt hatte [19]. Bei solchen seltenen Varietäten, so Gautschi, kommt es entscheidend darauf an, künftig die Tumorbiologie noch besser zu verstehen und aus einem solchen Verständnis wirksamere Medikamente zur Behandlung zu finden.
Kleinzelliges Lungenkarzinom
In frühen Stadien Chirurgie vorteilhaft
Beim nodal negativen kleinzelligen Lungenkarzinom (SCLC) der Größe cT1–2 wird meistens eine Chemoradiotherapie gegeben und selten operiert. Wie häufig der Einsatz beider Primärtherapie-Verfahren tatsächlich und mit welcher davon die bessere Prognose assoziiert ist, wollten Chi-Fu Yang, Durham, und Kollegen wissen [20]. Sie benutzten dazu die National Cancer Data Base der USA und fanden darin 4.729 Patienten mit frühem SCLC, die zwischen 2003 und 2011 eine Primärbehandlung erhalten hatten. Lediglich etwa jeder siebte Patient (n = 681, 14,4%) war operiert und adjuvant mit Chemotherapie mit oder ohne Radiotherapie behandelt worden, während alle übrigen nur eine Chemoradiotherapie bekommen hatten. Auch nach statistischer Korrektur für zahlreiche prognostisch wichtige Variablen war das chirurgische Vorgehen mit einem signifikant höheren 5-Jahres-Überleben assoziiert (48,9% vs. 30,0%; p < 0,001). Das Ergebnis änderte sich nicht, wenn sich die Analyse auf Patienten ohne relevante Komorbiditäten beschränkte (48,8% vs. 30,4%; p < 0,01).
Die Daten dieser retrospektiven Analyse zeigen, dass in den USA Patienten mit nodal negativem, frühem SCLC selten operiert werden und dass das Outcome der operierten Patienten besser war als bei denen, die die Standard-Therapie erhielten. Das legt nahe, dass eine moderne prospektiv randomisierte Studie interessant wäre, um die Frage des Stellenwerts der Operation bei diesen Patienten zu prüfen.
Hyperfraktionierte Bestrahlung nicht besser
Die gleichzeitige Chemoradiotherapie mit 54 Gy mit einer Fraktion pro Tag ist der Standard bei Patienten mit „Limited-stage“-SCLC in gutem Allgemeinzustand. 1999 publizierten Turrisi et al. einen Vergleich zwischen einer einmal täglich fraktionierten Bestrahlung mit 45 Gy und einer hyperfraktionierten (2x/d) mit 45 Gy ab dem ersten Zyklus der Chemotherapie [21]. Das Konzept konnte sich weltweit und auch in den USA nicht durchsetzen, u. a. weil die biologische Dosis beider Protokolle nicht äquivalent ist. In einer europaweiten Phase-III-Studie wurden deshalb 547 Patienten randomisiert, zusätzlich zur Chemotherapie entweder 45 Gy in zwei täglichen Fraktionen über drei Wochen oder 66 Gy in 33 täglichen Fraktionen über sechseinhalb Wochen zu erhalten – mit modernen 3D-konformalen Verfahren oder Intensitäts-modulierter Radiotherapie [22].
Nach median 45 Monaten Follow-up, so Corinne Faivre-Finn, Manchester, gab es keine Unterschiede, die 2-Jahres-Überlebensraten (primärer Endpunkt) lagen nach hyperfraktionierter Bestrahlung bei 56%, nach konventioneller Radiotherapie bei 51%; die medianen Überlebenszeiten bei 30 vs. 25 Monaten (HR 1,17; p = 0,15). Abgesehen von Grad-3/4-Neutropenien (74% vs. 65%; p = 0,03) fand sich auch bei den Nebenwirkungen kein signifikanter Unterschied zwischen beiden Armen.
Für beide Bestrahlungsprotokolle waren die Überlebenszeiten länger und die Toxizitäten (wohl aufgrund der Anwendung moderner Bestrahlungstechniken) weniger häufig als ursprünglich angenommen. Allerdings konnte kein signifikanter Überlebensvorteil für die hyperfraktionierte Bestrahlung nachgewiesen werden, so Faivre-Finn, sodass man weiterhin beide Protokolle anwenden kann. Die mediane Strahlendosis im konventionellen Arm lag bei 54 Gy, die auch weiterhin als Standard bei konventioneller Bestrahlung akzeptiert bleiben.
Checkpoint-Inhibitoren kombiniert
Patienten mit fortgeschrittenem SCLC erhalten in der Erstlinie gewöhnlich eine Platin-basierte Chemotherapie. Sind sie danach wieder progredient, so sind die therapeutischen Optionen sehr begrenzt. Ob Immuncheckpoint-Inhibitoren sich auch für diese Indikation eignen, wurde in der internationalen Phase-I-Studie CheckMate-032 untersucht [21]. In drei Armen erhielten 213 Patienten mit nach einer Chemotherapie progredientem SCLC entweder alle 2 Wochen den PD-1-Inhibitor Nivolumab alleine (3 mg/kg Körpergewicht) oder in Kombination mit dem CTLA-4-Inhibitor Ipilimumab in verschiedenen Konzentrationen. In zwei Armen mit der Kombinationstherapie erfolgte eine Induktionsbehandlung für vier Dosen entweder mit Nivolumab 1 mg/kg plus Ipilimumab 3 mg/kg oder mit Nivolumab 3 mg/kg plus Ipilimumab 1 mg/kg. Nivolumab als Erhaltungstherapie wurde anschließend mit 3 mg/kg alle zwei Wochen bis zu Progression oder inakzeptabler Toxizität weitergegeben. Die Kombinations-Regimes waren der Nivolumab-Monotherapie in der Induktion bei Ansprechen und Überleben deutlich überlegen (Tab. 2), wobei sich besonders die Kombination aus 1 mg/kg Nivolumab und 3 mg/kg Ipilimumab hervorhob.
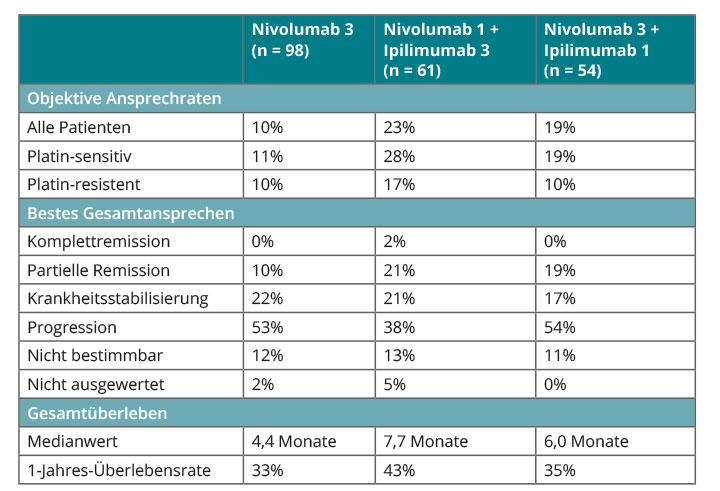
Die Sicherheitsdaten waren vergleichbar denen bei anderen Tumorentitäten; die Kombinations-Protokolle waren toxischer, sodass 7% bzw. 11% der Patienten die Behandlung wegen Nebenwirkungen abbrachen und drei behandlungsbedingte Todesfälle auftraten (wegen Myasthenia gravis, einer sich verschlechternden Niereninsuffizienz und einer Pneumonitis). Insgesamt aber waren die immunologisch bedingten Nebenwirkungen der Immuntherapien durch Anwendung der etablierten Leitlinien gut handhabbar.
Remissionen waren unabhängig von einer Platin-Sensitivität oder von der Expression des PD-1-Liganden PD-L1, und die Überlebensdaten sind ermutigend, sodass 1 mg/kg Nivolumab und 3 mg/kg Ipilimumab in der Induktion nun in der Phase-III-Studie CheckMate-451 weiter überprüft werden: Darin sollen in 165 Zentren (darunter acht in Deutschland) über 800 Patienten behandelt werden [24].
Immuntoxin in Monotherapie
Neuroendokrine Tumoren, darunter auch etwa 80% aller SCLC, exprimieren auf der Zelloberfläche das DLL3-Antigen. Dagegen richtet sich der Antikörper Rovalpituzumab, der in dem Immuntoxin Rovalpituzumab Tesirine (SC16LD6.5) an ein starkes Zelltoxin gekoppelt ist. In der ersten klinischen Studie mit diesem Präparat erhielten 74 Patienten mit SCLC, das nach wenigstens einer Chemotherapie progredient war, aufsteigende Dosierungen des Immuntoxins [25].
Bei handhabbarer Toxizität (Grad ≥ 3: seröse Ergüsse, Thrombozytopenien und Hautreaktionen), so Charles Rudin, New York, erzielten 55% der Patienten eine komplette Remission, die DCR (Disease Control Rate) lag bei 91%. Diese Daten bezogen sich auf Patienten, bei denen mindestens 50% der Tumorzellen DLL3 exprimierten (das ist als Companion Diagnostic vorgesehen). Die mediane Überlebenszeit lag bei acht, in einigen Fällen bei über 18 Monaten. Auch bei Patienten, die diese Therapie in der Drittlinie erhielten, wo es keinen etablierten Standard gibt, erwies sie sich mit einer Ansprechrate von 70% und einer Clinical Benefit-Rate von 90% als überraschend wirksam.
Diese Ergebnisse sind außerordentlich ermutigend, so Rudin, und rechtfertigen die weitere Entwicklung von Rovalpituzumab Tesirine für das DLL3-positive SCLC. Dies wäre die erste molekular stratifizierte Therapie beim SCLC.
Mesotheliom
PD-L1-Antikörper in der frühen Erprobung
Auch beim Mesotheliom – ein weiterer schwierig zu behandelnder Tumor, der trotz des in vielen Ländern gültigen Asbest-Verbots weltweit zunimmt – werden Hoffnungen in die neuen Immuntherapien gesetzt. Zwei in Chicago vorgestellte Studien seien hier kurz vorgestellt:
• In der Erstlinie wird das Mesotheliom mit Pemetrexed und einem Platinsalz behandelt. Weil es für Folgetherapien bisher keinen Standard gibt und der Anti-CTLA-4-Antikörper Tremelimumab in der Phase II eine vielversprechende Krankheitskontrolle gezeigt hatte, wurden in der Phase-III-Studie DETERMINE 571 Patienten im Verhältnis 2 : 1 randomisiert, doppelblind entweder Tremelimumab oder Placebo zu erhalten [26]. Leider zeigte sich beim primären Endpunkt Gesamtüberleben keinerlei Unterschied (median 7,7 vs. 7,3 Monate). Weil das Sicherheitsprofil des Antikörpers zufriedenstellend war, wird die Kombination aus Tremelimumab und dem Anti-PD-L1-Antikörper Durvalumab jetzt in der italienischen Phase-II-Studie NIBIT-MESO-1 in der Erst- und Zweitlinie untersucht [27].
• Avelumab (MSB0010718C) ist ein weiterer Anti-PD-L1-Antikörper, der in der Phase-Ib-Studie JAVELIN solid tumor bei einer Reihe von Tumorentitäten getestet wurde, darunter auch bei 53 Patienten mit Mesotheliom, das nach Chemotherapie progredient war. Unter der Behandlung mit Avelumab alle zwei Wochen zeigte sich bei fünf Patienten (9,4%) eine partielle Remission und bei 25 (47,2%) eine Krankheitsstabilisierung [28]. Die Remission war bei vier der fünf Patienten anhaltend, und zwar in einem Fall bereits für mehr als 42 Wochen.
Ob Checkpoint-Inhibitoren auch beim Mesotheliom künftig eine gewichtige Rolle spielen werden, muss man also abwarten – unwahrscheinlich ist es nicht.
Literatur
1. Brahmer J et al. N Engl J Med 2015; 373: 123-35.
2. Borghaei H et al. N Engl J Med 2015; 373: 1627-39.
3. Borghaei H et al. ASCO 2016, Abstract #9025.
4. Hellmann M et al. ASCO 2016, Abstract #3001.
5. ClincalTrials.gov NCT02477826.
6. Herbst RS et al. Lancet 2016; 387: 1540-50.
7. Baas P et al. ASCO 2016, Abstract #9015.
8. Yang JCH et al. ASCO 2016, Abstract #9002.
9. Ahn MJ et al. ASCO 2016, Abstract #9003.
10. Kim DW e tal. ASCO 2015, Abstract #9007.
11. ClincalTrials.gov NCT02737501.
12. Nokihara H et al. ASCO 2016, Abstract #9008.
13. Solomon BJ et al. ASCO 2016, Abstract #9009.
14. ClinicalTrials.gov NCT01970865.
15. Shaw AT et al. N Engl J Med 2013; 368: 2385-94.
16. Shaw AT et al. ASCO 2016, Abstract #9066.
17. Seto T et al. ASCO 2016, Abstract #9012.
18. Gautschi O et al. ASCO 2016, Abstract #9014.
19. Drilon A et al. ASCO 2015, Abstract #8007.
20. Yang CFJ et al. ASCO 2016, Abstract #8511.
21. Turrisi AT 3rd et al. N Engl J Med 1999; 340: 265-71.
22. Faivre-Finn C et al. ASCO 2016, Abstract #8504
23. Antonia SJ et al. ASCO 2016, Abstract #100.
24. ClincalTrials.gov NCT02538666.
25. Rudin CM et al. ASCO 2016, Abstract #LBA8505.
26. Kindler HL et al. ASCO 2016, Abstract #8502.
27. ClinicalTrials.gov NCT02588131.
28. Hassan R et al. ASCO 2016, Abstract #8503.

Prof. Dr. med. Frank Griesinger
Direktor der Klinik f. Hämatologie u. Onkologie
Universitätsklinik Innere Medizin
Onkologie-Koordinator Cancer Center
Oldenburg, Pius-Hospital
Georgstraße 12, 26121 Oldenburg
+49 441 229-1611
+49 441 229-1607
Frank.Griesinger[at]Pius-Hospital[dot]de

