Neues zu Leukämien
ASCO/EHA 2016
Bei den akuten Leukämien, deren Therapie vor allem bei Erwachsenen noch immer unbefriedigend ist, gibt es derzeit echte Fortschritte, von denen bei den Jahrestagungen der American Society of Clincal Oncology (ASCO) in Chicago und der European Hematology Association (EHA) in Kopenhagen berichtet wurde: Bei der akuten lymphatischen Leukämie (ALL) erzielen immuntherapeutische Ansätze – vorerst vor allem in weit fortgeschrittenen, bisher als „hoffnungslos“ betrachteten Fällen – zum Teil spektakuläre Erfolge, während bei der akuten myeloischen Leukämie (AML) die besonders schwierig zu behandelnden älteren Patienten von einer Reihe neuer Substanzen, aber teilweise auch von klassischen Zytostatika in neuer Verpackung zu profitieren scheinen. Bei der chronischen myeloischen Leukämie (CML) schließlich, wo die Lebenserwartung sich dank der Tyrosinkinaseinhibitoren schon weitgehend normalisiert hat, zeichnet sich ab, dass ein bestimmter Teil der Patienten in Zukunft auch ohne Therapie in einer guten Remission bleiben wird.
Akute lymphatische Leukämie
Bispezifische Antikörper
Blinatumomab ist ein bispezifisches T-Zell-Engager(BiTE)-Antikörperkonstrukt, das auf gentechnischem Weg so konstruiert wurde, dass es sowohl das CD19-Antigen auf B-Lymphozyten als auch das CD3-Antigen auf T-Lymphozyten bindet. Die B-Zellen (vor allem die malignen Zellen bei B-Zell-Leukämien und -Lymphomen) sollen dadurch in engen räumlichen Kontakt mit zytotoxischen T-Zellen gebracht werden, sodass sie von diesen lysiert werden können. Blinatumomab wurde als erster BiTE-Antikörper zur Therapie der rezidivierten oder refraktären Philadelphia-Chromosom-negativen akuten lymphatischen Leukämie (ALL) von B-Vorläuferzellen zugelassen, und zwar aufgrund der Ergebnisse einer einarmigen Phase-II-Studie. Mittlerweile liegen die Resultate der globalen Phase-III-Studie TOWER vor, in der 405 Patienten mit dieser Indikation im Verhältnis 2 : 1 entweder auf Blinatumomab oder auf eine Standardtherapie randomisiert worden waren [1]; diese Standardtherapie konnten die Prüfärzte aus vier vorgegebenen Protokollen auswählen (FLAG mit oder ohne Anthrazyklin, hochdosiertes Cytarabin, hochdosiertes Methotrexat, Clofarabin). Patienten, die nach zwei sechswöchigen Induktionszyklen mit Blinatumomab in einer Remission waren, konnten bis zum Eintreten eines Rezidivs weiterbehandelt werden.
Primärer Endpunkt war das Gesamtüberleben, so Max Topp, Würzburg, beim EHA-Kongress in Kopenhagen, und in einer vorab geplanten Intention-to-Treat-Interimsanalyse konnte Blinatumomab dieses von median 4,0 auf 7,8 Monate beinahe verdoppeln (Hazard Ratio 0,71; p = 0,012). Dieser Vorteil der BiTE-Therapie war unabhängig von Alter, vorangegangenen Salvagetherapien oder auch einer allogenen Stammzelltransplantation. Auch die Ansprechraten als sekundärer Endpunkt waren unter Blinatumomab länger mit einer Verdoppelung der Komplettremissionen von 19% auf 39% (p < 0,001); die Rate an Komplettremissionen mit partieller oder unvollständiger hämatologischer Erholung war von 28% auf 46% erhöht (p = 0,001). Von den Patienten in Komplettremission hatten im Blinatumomab-Arm 77% auch keine minimale Resterkrankung (MRD) mehr (< 10-4 Blasten), im Kontrollarm waren es nur 52%.
Bei Nebenwirkungen vom Grad 3 oder höher gab es insgesamt keine Unterschiede zwischen beiden Armen, bei Neutropenien und Infektionen schnitt Blinatumomab besser ab, während beide Arme bei den neurologischen Ereignissen gleich gut abschnitten, so Topp.
Blinatumomab ist damit die erste Immuntherapie, für die sich in einer Phase-III-Studie bei Patienten mit rezidivierter/refraktärer ALL ein signifikanter Überlebensvorteil gegenüber einer Chemotherapie nachweisen lässt. Auf der Grundlage dieser Interimsanalyse empfahl das Data Monitoring Committee, die Studie noch vor der geplanten finalen Analyse zu beenden.
INO-VATE: Immunkonjugat bei rezidivierter/refraktärer ALL
Eine weitere vielversprechende, wenn auch noch nicht zugelassene Immuntherapie für die rezidivierte oder refraktäre ALL richtet sich gegen das CD22-Antigen, das auf der Oberfläche der Blasten von mehr als 90% dieser Patienten exprimiert wird. Im Immunkonjugat Inotuzumab Ozogamicin ist ein monoklonaler Anti-CD22-Antikörper an Calicheamicin, ein sehr potentes Zellgift, gekoppelt. Nach Bindung des Antikörpers an die Zelloberfläche wird das Konjugat von den leukämischen Zellen internalisiert, und erst im sauren Milieu von deren Lysosomen spaltet sich das Zytostatikum ab, das deshalb seine Wirkung fast ausschließlich in den malignen Zielzellen entfaltet.
In der Phase-III-Studie INO-VATE wurden 326 Patienten mit rezidivierter oder refraktärer ALL randomisiert, entweder Inotuzumab Ozogamicin oder eine intensive Standard-Chemotherapie zu erhalten (FLAG, Cytarabin/Mitoxantron oder hochdosiertes Cytarabin). Inotuzumab Ozogamicin wurde für bis zu sechs Zyklen gegeben, wobei eine Dosis von 1,8 mg/m2 je Zyklus aufgeteilt und an den Tagen 1, 8 und 15 infundiert wurde. Primäre Endpunkte waren Komplettremissionsrate und Gesamtüberleben: Bei diesen mittlerweile publizierten Ergebnissen [2] war das Immunkonjugat mit 80,7% versus 29,4% kompletten Remissionen (davon 78,4% vs. 28,1% MRD-negativ) deutlich überlegen; auch bei der Gesamtüberlebenszeit war der Unterschied von median 7,7 versus 6,79 Monaten signifikant (HR 0,77; p = 0,04).
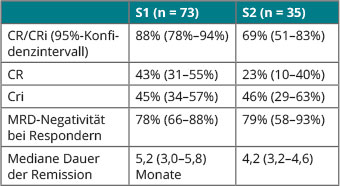
In Kopenhagen stellte Daniel DeAngelo, Boston, Subgruppenanalysen vor, die zeigten, dass Patienten, die Inotuzumab Ozogamicin als erste Salvagetherapie (S1) erhalten hatte, besser darauf ansprachen (Tabelle 1) und eine länger andauernde Remission erzielten als diejenigen, bei denen es schon die zweite Salvagetherapie (S2) gewesen war [3]. Auch als zweite Salvagetherapie war das Immunkonjugat aber deutlich wirksamer als die Chemotherapie (mediane Dauer der Remission 4,4 vs. 2,9 Monate; HR 0,32; p = 0,0019). Patienten, die vorher bereits eine allogene Stammzelltransplantation erhalten hatten, blieben numerisch länger in Remission als diejenigen ohne Transplantation; für letztere war die Verlängerung der Remissionsdauer durch Inotuzumab Ozogamicin signifikant (median 5,2 vs. 3,2 Monate; HR 0,52; p = 0,0058). Dass das Immunkonjugat eine Rolle in einer Bridging-Strategie spielen könnte, zeigt sich daran, dass sich hier viermal mehr Patienten hinterher einer allogenen Transplantation unterziehen konnten als im Kontrollarm (41 vs. zehn Patienten).
Lebertoxizitäten waren häufiger, wenn Inotuzumab Ozogamicin als zweite Salvagetherapie bzw. nach Stammzelltransplantation gegeben wurde; das betraf auch eine hepatische Venenverschlusserkrankung einschließlich der Fälle, die nach allogener Transplantation auftraten. Das Immunkonjugat, so DeAngelo, könnte damit eine bedeutende neue Behandlungsoption für Patienten mit rezidivierter oder refraktärer ALL darstellen, die umso wirksamer zu sein scheint, je früher im Verlauf sie eingesetzt wird.
Pädiatrische Protokolle bei Erwachsenen?
Auch mit konventionellen, Chemotherapie-basierten Protokollen sind noch Verbesserungen möglich: Eine Studiengruppe aus Skandinavien und den baltischen Ländern ging dem Verdacht nach, dass junge Erwachsene davon profitieren könnten, wenn sie mit einem der deutlich erfolgreicheren pädiatrischen ALL-Protokolle behandelt werden. In einer Registerstudie wurden retrospektiv die Daten von 1.509 Patienten analysiert, die zwischen 2008 und 2014 mit dem NOPHO ALL2008-Protokoll behandelt worden waren, in dem vor allem die Dosierungen von 6-Mercaptopurin und von PEG-Asparaginase erhöht wurden. 1.288 der Patienten waren bis zu 17 Jahre und 221 zwischen 18 und 45 Jahre alt. Die Patienten wurden anhand von Immunphänotyp, Leukozytenzahlen bei Diagnose, MRD-Titer an den Tagen 29 und 79 nach Beginn der Therapie und zytogenetischem Risiko in vier Risikokategorien aufgeteilt, so Nina Toft, Herlev, Dänemark [4].
Nach median vierjährigem Follow-up schnitten die 18–45-jährigen Patienten zwar bezüglich der ereignisfreien Überlebensrate mit 73% etwas schlechter ab als die Kinder und Jugendlichen (zwischen 79% und 88%) – das scheint aber dadurch erklärbar, dass sie im Mittel bereits bei Diagnose ein höheres Risiko aufgewiesen hatten. Insgesamt war dieses Ergebnis immer noch erheblich besser als historische Daten aus Dänemark, denen zufolge die 18–45-Jährigen unter konventionellen Erwachsenen-Protokollen nach vier Jahren lediglich zu 42% ereignisfrei gewesen waren. Wenn sie nach den Risikogruppen stratifiziert wurden, war das ereignisfreie Überleben bei den jungen Erwachsenen nur in dem Stratum mit intermediärem Risiko signifikant schlechter als bei den Kindern und Jugendlichen.
CAR-T-Zellen: tiefe Remissionen
Einer der spektakulärsten neuen onkologischen Therapieansätze der letzten Jahre sind CAR-T-Zellen: Hier werden patienteneigene T-Lymphozyten gentechnisch mit einem chimären Antigen-Rezeptor (CAR) ausgestattet, der ein möglichst tumorspezifisches Antigen erkennt. Die modifizierten T-Zellen werden zunächst ex vivo expandiert und dann dem Patienten reinfundiert. Sie vermehren sich im Körper und bekämpfen sehr effizient die Tumorzellen, die das betreffende Antigen tragen. Solche Ansätze werden bereits für viele, bisher vorwiegend hämatologische Tumoren entwickelt, aber die umfangreichsten Erfahrungen gibt es derzeit bei der ALL, bei der ähnlich wie mit Blinatumomab das CD19-Antigen als Zielmolekül dient. Bei Kindern und jungen Erwachsenen mit „austherapierter“ ALL wurde bereits über hohe Raten an Komplettremissionen berichtet; in Kopenhagen stellte Shannon Maude, Philadelphia, nun die Daten von 60 Patienten im Alter zwischen 20 Monaten und 24 Jahren vor, die mit dem in Philadelphia entwickelten Konstrukt der CTL019-Zellen behandelt worden waren [5].
Vor der Behandlung mit den CAR-T-Zellen hatten die Patienten eine zytoreduktive Chemotherapie erhalten, nach der 15 von ihnen bereits MRD-negativ waren. 39 hatten ihr Rezidiv nach einer allogenen Stammzelltransplantation erlitten, und 15 hatten innerhalb des vorangegangenen Jahres eine ZNS-Manifestation ihrer Leukämie gezeigt. Bereits einen Monat nach Infusion der CAR-T-Zellen waren 56 Patienten (93%) in kompletter Remission, 52 MRD-negativ (< 10-4 Zellen in der Durchflusszytometrie). Die CTL019-Zellen konnten im Liquor detektiert werden, und alle 15 Patienten mit vorhergegangenem ZNS-Befall erzielten dort eine komplette Remission – einschließlich der vier, die noch am Tag vor der Infusion der Zellen Blasten im Liquor aufgewiesen hatten. Es wurde bisher kein Rezidiv im ZNS gesehen, so Frau Maude.
Nach median 12-monatiger Nachbeobachtung sind 34 der 59 Patienten weiterhin in kompletter Remission, obwohl nur sechs von ihnen eine Folgetherapie erhalten haben (fünfmal eine allogene Stammzelltransplantation, einmal eine Infusion von Donor-Lymphozyten). Die rezidivfreie Überlebensrate lag nach sechs Monaten bei 76%, nach zwölf Monaten bei 55%, die Gesamtüberlebensrate nach zwölf Monaten liegt bei 79%. Von den 20 Rezidiven, die mittlerweile beobachtet wurden, waren 13 CD19-negativ.
Die Persistenz der CTL019-Zellen geht regelmäßig mit einer persistierenden B-Zell-Aplasie einher, weil auch normale B-Lymphozyten das CD19-Antigen tragen. Die Patienten müssen deshalb mit intravenösen Immunglobulinen substituiert werden. Eine weitere häufige Nebenwirkung, so Frau Maude, ist ein Zytokin-release-Syndrom, das bei 88% der Patienten gesehen wurde und etwa bei einem Viertel der Patienten so schwer war, dass hämodynamische oder respiratorische Supportivmaßnahmen notwendig waren. Diese schweren Verläufe korrelierten mit einer hohen Krankheitslast zu Beginn der Therapie und waren unter Tocilizumab, einem Antikörper gegen den Interleukin-6-Rezeptor, reversibel.
Beim ASCO-Kongress in Chicago präsentierte die Arbeitsgruppe aus Philadelphia vorläufige Daten von 27 erwachsenen ALL-Patienten, wonach die Infusion höherer Dosen an CTL019-Zellen das Ansprechen stark verbessert [6]. Allerdings muss die Applikation fraktioniert erfolgen, weil sonst die Mortalität (aufgrund von Zytokin-release-Syndromen, die refraktär gegenüber Tocilizumab sind) stark ansteigt (Tab. 2).
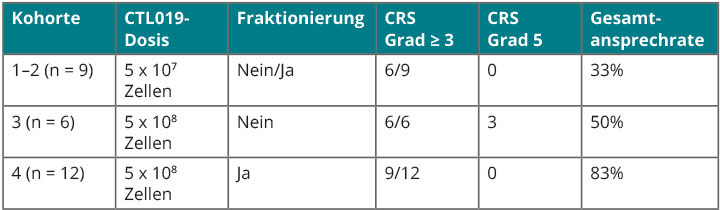
Die Wirksamkeit dieser Zellen, so Frau Maude, bei einem so stark vorbehandelten Patientenkollektiv ist spektakulär. Ein Nachteil ist freilich, dass die Herstellung individualspezifisch erfolgt und deshalb extrem aufwendig ist. Derzeit laufen multizentrische Phase-II-Studien zur ALL, die auf globaler Basis auf eine Zulassung abzielen.
Eine andere Variante von gegen CD19 gerichteten CAR-T-Zellen, die am Memorial Sloan Kettering Cancer Center entwickelt wurde (JCAR015), hat ebenfalls bereits mit hohen Ansprechraten bei Erwachsenen mit rezidivierter ALL von sich reden gemacht. Aktualisierte Auswertungen wurden in Chicago ebenso wie in Kopenhagen von Jae Park, New York vorgestellt [7, 8]: Von den 51 behandelten Patienten hatten 31 vor der Infusion der Zellen Blasten in Blut oder Knochenmark und die übrigen 20 eine detektierbare minimale Resterkrankung aufgewiesen. Von ersteren erreichten nach der Infusion der CAR-T-Zellen 77% eine komplette Remission und davon 90% einen MRD-negativen Status; in der Gruppe mit lediglich minimaler Resterkrankung zu Beginn waren 90% hinterher in Komplettremission, davon 78% MRD-negativ.
16 von 41 Patienten mit kompletter Remission erhielten anschließend eine allogene Stammzelltransplantation. Von 33 Patienten mit MRD-Negativität erlitten 15 (45%) ein Rezidiv; von diesen Rezidiven waren vier CD19-negativ. Neun von diesen 33 Patienten sind mittlerweile für mehr als ein Jahr krankheitsfrei.
Auch hier traten Zytokin-release-Syndrome sowie neurologische Toxizitäten auf, die allerdings bei den Patienten erheblich leichter ausfielen, die zum Zeitpunkt der CAR-T-Zell-Infusion lediglich eine minimale Resterkrankung aufgewiesen hatten. Derzeit läuft hier eine multizentrische Phase-II-Studie (ROCKET; [9]). Ob die Anwendung solcher Zellen wegen der besseren Wirksamkeit und geringeren Toxizität bei Patienten mit geringerer Krankheitslast in frühere Therapielinien, womöglich gar, so Park, in die Erstlinie verlegt werden sollte, bleibt angesichts des Aufwands, der mit der Behandlung verbunden ist, abzuwarten. Interessant ist, dass ein Teil der Rezidive CD19-negativ ist, was einen Antigen-Escape-Mechanismus nahelegt.
Akute myeloische Leukämie
CD33-Immuntoxin mit hohen Ansprechraten
Was CD19 oder CD20 auf malignen B-Zellen, ist CD33 auf Blasten bei der akuten myeloischen Leukämie (AML) – ein Antigen, das vorzugsweise auf diesen malignen Zellen exprimiert wird und sich deshalb als Zielstruktur für therapeutische monoklonale Antikörper eignet. Im Fall von Vadastuximab Talirin (auch SGN-CD33A) ist ein solcher Antikörper mit einem Pyrrolobenzodiazepin-Dimer gekoppelt, einem Zytostatikum, das – wenn es in der Zelle vom Antikörper abgespalten ist – mit hoher Affinität an die DNA bindet und irreparable Schäden verursacht, die zur Apoptose führen. Solche vergleichsweise gut verträglichen Therapien könnten vor allem für ältere Patienten mit AML interessant sein, die nach wie vor eine schlechte Prognose haben und für keine intensive Chemotherapie mehr infrage kommen. Diese Patienten werden mittlerweile häufig mit hypomethylierenden Agenzien (HMA: Azacitidin oder Decitabine) behandelt. In präklinischen Untersuchungen hat sich bei Zugabe von SGN-CD33A zu diesen Substanzen eine erhöhte Zytotoxizität gezeigt: Offenbar verursachen die hypomethylierenden Medikamente eine Hochregulierung von CD33 auf den AML-Blasten, worauf diese mehr von dem Zytostatikum inkorporieren können.
In einer Phase-I-Studie, deren erste Ergebnisse Amir Fathi, Boston, in Kopenhagen vorstellte, wurden 53 Patienten (median 75 Jahre alt) mit einer solchen Kombination behandelt, wobei SGN-CD33A alle vier Wochen jeweils am letzten Tag der fünftägigen HMA-Gabe intravenös und ambulant gegeben wurde [10]. 48 der Patienten waren therapienaiv, die übrigen hatten wegen eines myelodysplastischen Syndroms bereits eine wenig intensive Therapie erhalten. Nebenwirkungen vom Grad 3 oder höher waren vor allem hämatologischer Natur (Zytopenien, bei 47% der Patienten eine febrile Neutropenie). Von 49 auswertbaren Patienten erzielten 36 (71%) nach median zwei Zyklen eine Komplettremission (n = 17), zum Teil mit unvollständiger hämatologischer Erholung (n = 19). Die mediane Dauer der kompletten Remissionen liegt derzeit bei 6,9 Monaten. Auch drei Viertel der Patienten mit ungünstiger Zytogenetik kamen unter der Behandlung in eine Remission. Die beiden angewendeten HMA (Azacitidin bzw. Decitabine) unterschieden sich nicht hinsichtlich der Remissionsraten. Von 33 Patienten in Remission wurden 14 (42%) sogar MRD-negativ. Die mediane rezidivfreie Überlebenszeit lag bei 7,7 Monaten, die Gesamtüberlebenszeit bei 11,6 Monaten; über 75-jährige Patienten schienen sich hinsichtlich der Überlebenschancen nicht von den jüngeren zu unterscheiden.
Das ist nur eine Phase-I-Studie, aber die gute Verträglichkeit und die beeindruckenden Ansprechraten, die die von einer alleinigen HMA-Therapie bekannten übertreffen, sowie die niedrige Frühmortalität rechtfertigen die Durchführung einer Phase-III-Studie (CASCADE), so Fathi. Diese ist im Mai 2016 in den USA angelaufen, soll insgesamt 500 Patienten rekrutieren und setzt auf den primären Endpunkt Gesamtüberleben [11].
Polokinase-Hemmer: Cave Dosisintensität!
Die Phase-III-Daten zu einer weiteren neuen Substanz, die zunächst vor allem älteren AML-Patienten zugutekommen sollte, zeigen, dass positive Ergebnisse in frühen Studien mit Vorsicht zu betrachten sind [12]. Hartmut Döhner, Ulm, berichtete in Kopenhagen die Daten zu Volasertib, einem selektiven Inhibitor der Polo-like Kinase 1, der die Zellteilung unterbricht und dadurch eine Apoptose bewirkt. Volasertib hatte in einer randomisierten Phase-II-Studie in Kombination mit niedrigdosiertem Cytarabin bei älteren Patienten, die nicht für eine intensive Chemotherapie geeignet waren, Ansprechen, ereignisfreies und Gesamtüberleben im Vergleich zu der alleinigen Chemotherapie deutlich verbessert. In der Phase-III-Studie POLO-AML-2 waren daraufhin 666 Patienten im Verhältnis 2 : 1 doppelblind auf diese beiden Therapien randomisiert worden: Volasertib wurde alle zwei Wochen in einer Dosis von 350 mg als einstündige Infusion gegeben, im Kontrollarm erhielten die Patienten stattdessen Placebo.
Beim primären Endpunkt der Ansprechrate (CR und Cri) war der Volasertib-Arm in der primären Analyse mit 25,2% versus 16,8% bei zentraler Begutachtung nicht signifikant überlegen (Odds Ratio 1,659; p = 0,071); bei Beurteilung durch die einzelnen Prüfärzte war der Unterschied mit 29,7% gegenüber 19,2% allerdings signifikant (OR 1,757; p = 0,034). Beim sekundären Endpunkt allerdings schnitt Volasertib sogar – wenngleich auch nicht signifikant – schlechter ab: Die mediane Überlebenszeit betrug hier 4,8 Monate, in der Kontrollgruppe 6,5 Monate (HR 1,26; p = 0,1129). Die Analyse der Nebenwirkungen zeigte den wahrscheinlichen Grund dafür: Unter Volasertib kam es mehr als dreimal häufiger zu letalen Infektionen (16,6% vs. 5,1%). Aufgrund dieser primären Ergebnisse wurde die Studie entblindet, und die noch in der Studie befindlichen Patienten konnten nach individueller Abwägung von Nutzen und Risiko weiterbehandelt werden.
Exploratorische Analysen nahmen unter anderem die tatsächlich verabreichte Dosisdichte von Volasertib unter die Lupe, die aufgrund von Verschiebungen einzelner Zyklen oder der Auslassung von Dosen stark variierte. Es zeigte sich, dass die mediane Dosisdichte in der Phase-III-Studie höher war als in der erfolgreichen Phase-II-Studie (20,8 vs. 17,6 mg/d). Wenn in der Phase-III-Studie die Patienten des Verum-Arms in zwei Strata unterteilt wurden (< bzw. ≥ 25 mg/d Volasertib), zeigte sich unter der niedrigeren Dosis eine Verdreifachung des Gesamtüberlebens, so Döhner (median 15,2 vs. 5,1 Monate). Weitere Auswertungen lassen vermuten, dass eine Verbesserung der Verträglichkeit von Volasertib (durch Anpassung der Dosierung) das Nutzen-Risiko-Verhältnis zugunsten der Kombination verändern würde. Ein Hinweis darauf ist auch das Ergebnis einer weiteren Analyse des Überlebens, die etwa ein Jahr nach der Primäranalyse und nach der Entblindung der Studie erfolgte: Hier schrumpfte der numerische Vorteil des Placeboarms auf median 6,5 versus 5,6 Monate (HR 1,06; p = 0,5521). Die Studie wird weitergeführt, so Döhner, und es ist geplant, Volasertib bei AML und MDS weiter zu untersuchen – mit alternativen Dosierungs-Schemata.
Konventionelle Zytostatika neu verpackt
Konventionelle Zytostatika in liposomaler Verpackung haben schon in einigen Fällen Einzug in die onkologische Therapie gehalten. Ein neues Präparat ist etwa CPX-351, bei dem 100 nm große Liposomen die klassischen Komponenten einer intensiven Induktions-Chemotherapie bei der AML, Cytarabin und Daunorubicin, in einem molaren Verhältnis von 5 : 1 enthalten. Die Aufnahme der beiden Substanzen in Blasten von AML-Patienten und ihre Toxizität gegenüber diesen Zellen sind höher als bei den freien Zytostatika; die Blasten nehmen auch deutlich mehr von dem Präparat auf als hämatopoetische Vorläuferzellen aus dem Knochenmark. Auch hier wurde nach vielversprechenden Phase-II-Daten eine Phase-III-Studie gestartet, in der 309 Patienten im Alter zwischen 60 und 75 Jahren mit zuvor unbehandelter AML randomisiert wurden, entweder ein bis zwei Zyklen einer konventionellen 7 + 3-Induktionstherapie oder von CPX-351 zu erhalten; die Dosierung bestand aus 100 U/m2 an den Tagen 1, 3 und 5 eines Zyklus, wobei eine Einheit 1,0 mg Cytarabin und 0,44 mg Daunorubicin entspricht. Patienten, die darunter eine Komplettremission (mit oder ohne hämatologische Erholung) erreichten, konnten anschließend ein bis zwei Zyklen einer Konsolidierungstherapie erhalten.
Die liposomal verpackten Zytostatika waren beim Ansprechen wie beim Gesamt- und ereignisfreien Überleben der 7 + 3-Therapie überlegen (Tab. 3). Wie Bruno Medeiros, Stanford, in Kopenhagen berichtete, konnte bei rund 90% der Patienten der Mutationsstatus von Flt3, NPM1 und CEBPα bestimmt werden [13]. Abgesehen von CEBPα waren alle Mutationen (bei Flt3 ITD- und TKD-Mutation) mit einem noch besseren Ansprechen assoziiert als im Gesamtkollektiv (Tab. 3).
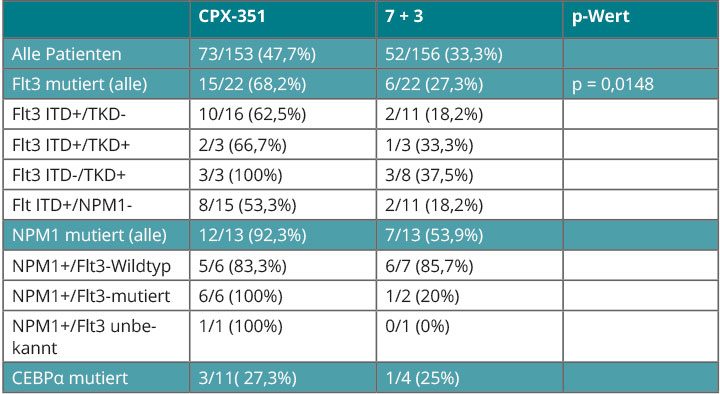
Das übersetzte sich auch in ein längeres Überleben unter CPX-351, auch wenn das wegen der kleinen Patientenzahlen in den einzelnen Subgruppen meist nicht signifikant ausfiel. Signifikant waren sie nur im Stratum mit CEBPα-Mutation, wo beim Ansprechen kein Nutzen zu erkennen gewesen war.
Offenbar, so Medeiros, sind AML-Zellen mit spezifischen genetischen Anomalien (die teilweise sogar, wie Flt3-ITD-Mutationen, mit einer schlechten Prognose einhergehen) besonders empfindlich gegenüber der Wirkung der liposomal verpackten Zytostatika. Das bestätigt auch präklinische Ergebnisse, wonach primäre AML-Blasten mit Flt3-ITD eine höhere Sensitivität gegen das Präparat aufweisen als solche mit dem Wildtyp. Die Hypothese, die es nun zu überprüfen gilt, ist, dass CPX-351 seinen größten Nutzen bei solchen Patienten entfalten könnte.
Chronische myeloische Leukämie
Das Konzept der therapiefreien Remission (TFR) bei der chronischen myeloischen Leukämie (CML) konkretisiert sich immer mehr: In Chicago bzw. Kopenhagen wurden die Ergebnisse mehrerer sogenannter „Absetz“-Studien vorgestellt, in denen Patienten, die nach längerer Einnahme von Tyrosinkinaseinhibitoren (TKI) eine tiefe molekulare Remission erreicht hatten, die Medikation abgesetzt hatten.
ENESTfreedom: mehr als die Hälfte der Patienten therapiefrei in Remission
In der Phase-II-Studie ENESTfreedom wurden 215 Patienten, die nach mindestens zweijähriger Therapie mit dem TKI Nilotinib eine tiefe molekulare Remission (MR4,5, d. h. BCR-ABL ≤ 0,0032%) erreicht hatten, zunächst ein weiteres Jahr mit Nilotinib behandelt, wie Andreas Hochhaus, Jena, in Chicago bzw. Guiseppe Saglio, Turin, in Kopenhagen berichteten [14, 15]. 190 Patienten, die auch nach dieser Frist die MR4,5 gehalten hatten, setzten dann die Therapie ab. Nach 48 Wochen war mehr als die Hälfte von ihnen (51,6%) noch in einer TFR, d. h. sie hatten mindestens noch ein gutes molekulares Ansprechen (MMR, d. h. BCR-ABL ≤ 0,1%), 47,4% waren sogar weiterhin in einer MR4,5. Die mediane Therapiedauer vor dem Absetzen hatte lediglich 43 Monate betragen. 86 Patienten hatten nach dem Absetzen der Therapie einen Verlust der MMR und wurden deshalb wieder mit Nilotinib behandelt; von ihnen erreichten 85 (98,8%) damit nach median 7,9 Wochen zumindest eine MMR, 76 (88,4%) sogar wieder eine MR4,5; ein Patient entschied sich für eine Beendigung der Studienteilnahme, ohne wieder eine MMR erreicht zu haben.
Für die relativ kurze Behandlungsdauer von gut dreieinhalb Jahren ist ein Anteil von über 50% therapiefreien Remissionen nach beinahe einem Jahr ohne Therapie bemerkenswert, so Hochhaus.EURO-SKI: Absetzen auch in dezentralem Setting
Das Absetzen einer TKI-Behandlung wird derzeit noch nur in kontrollierten Studien empfohlen. Die genauen Bedingungen dafür sind noch nicht klar definiert. In der EURO-SKI-Studie (European Stop TKI study) waren sie nicht so stringent wie in manchen anderen Studien: Hier wurden CML-Patienten eingeschlossen, die mindestens drei Jahre lang mit TKI behandelt worden waren und sich mindestens ein Jahr lang wenigstens in einer MR4 (d. h. BCR-ABL-Titer ≤ 0,01%) befunden hatten; diese tiefe Remission musste im Jahr vor dem Studieneinschluss durch drei konsekutive Messungen bestätigt werden, so Johan Richter, Lund, der die Ergebnisse in der „Best Abstracts“-Sitzung des EHA-Kongresses vorstellte [16]. Solche Patienten konnten die TKI-Behandlung absetzen, wurden aber engmaschig mittels BCR-ABL-Bestimmung kontrolliert (im ersten Jahr alle vier bzw. sechs Wochen, in den beiden folgenden Jahren alle drei Monate). Bei Verlust einer guten molekularen Remission (MMR), d. h. sobald die BCR-ABL-Konzentration auf über 0,1% angestiegen war, wurde die Behandlung mit dem TKI wiederaufgenommen.
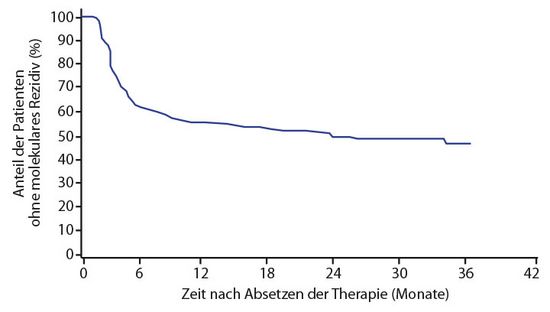
Von insgesamt 750 auswertbaren Patienten, so Richter, waren nach sechs Monaten noch 62% ohne ein solches molekulares Rezidiv, nach zwölf Monaten waren es 56%, nach zwei Jahren 52% und nach drei Jahren 49% (Abb. 1). Für die 348 Patienten, die ein molekulares Rezidiv erlitten und die Behandlung wiederaufnahmen, betrug die mediane Zeit bis dahin 4,1 Monate, die überwiegende Mehrzahl der Rezidive ereignete sich in den ersten sechs bis zwölf Monaten. Mehr als 80% dieser Patienten haben nach Wiederaufnahme der TKI-Behandlung wieder eine MR4 erreicht; die Analysen dazu laufen noch.
Die univariate Analyse einer Subgruppe von 448 Patienten, die mit Imatinib behandelt worden waren, zeigte keine Korrelation zwischen dem Risiko für ein molekulares Rezidiv einerseits und Alter, Geschlecht, Tiefe der molekularen Remission (MR4 oder MR4,5) bzw. irgendwelchen Risikoscores (Sokal, EUTOS, EURO oder ELTS) andererseits. Die Dauer der TKI-Therapie sowie die Dauer der tiefen molekularen Remission (≤ MR4) waren hingegen hochsignifikant mit der molekularen Rezidivfreiheit nach sechs Monaten korreliert (p < 0,001): Mit jedem zusätzlichen Jahr einer MR4 unter Therapie stieg die Chance auf molekulare Rezidivfreiheit sechs Monate nach Absetzen der Behandlung um 16%. Patienten, die länger als 5,8 Jahre Imatinib erhalten hatten, waren nach sechs Monaten zu fast zwei Dritteln rezidivfrei (65,5%), Patienten mit kürzerer Behandlungsdauer hingegen nur zu 42,6%.
Bei einem knappen Drittel der Patienten zeigte sich nach dem Absetzen ein sogenanntes „TKI-Entzugssyndrom“, bei dem Schmerzen oder unangenehme Empfindungen bezüglich des Muskel-Skelett-Systems auftraten; das wurde auch in anderen Absetzstudien beschrieben, ist aber in den meisten Fällen selbstlimitierend.
Das wesentliche Verdienst der EURO-SKI-Studie besteht darin, so Richter, gezeigt zu haben, dass sich auch mit weniger strikten Kriterien für das Absetzen und die Wiederaufnahme der Behandlung und in einem dezentralen Setting, in dem allerdings engmaschig und mit einem standardisierten Verfahren die BCR-ABL-Konzentrationen kontrolliert werden müssen, das Absetzen der TKI-Therapie sicher und erfolgreich durchführen lässt.
Literatur
1. Topp M et al. EHA 2016, Abstract #S149.
2. Kantarjian HM et al. Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med 2016, June 12 [DOI 10.1056/NEJMoa1509277].
3. DeAngelo DJ et al. EHA 2016, Abstract #S499.
4. Toft N et al. EHA 2016, Abstract #LB173.
5. Maude S et al. EHA 2016, Abstract #S497.
6. Frey NV et al. ASCO 2016, Abstract #7002.
7. Park JH et al. ASCO 2016, Abstract #7003.
8. Park JH et al. EHA 2016, Abstract #S498.
9. ClincalTrials.gov NCT02535364.
10. Fathi A et al. EHA 2016, Abstract #S503.
11. ClinicalTrials.gov NCT02785900.
12. Döhner H et al. Abstract #S501.
13. Lancet J et al., EHA 2016, Abstract #S502.
14. Hochhaus A et al. ASCO 2016, Abstract #7001.
15. Saglio G et al. EHA 2016, Abstract #LB618.
16. Richter J et al. EHA 2016, Abstract #S145.

Prof. Dr. med. Karl-Anton Kreuzer
Klinik I für Innere Medizin
Universitätsklinikum Köln
Kerpener Straße 62, 50937 Köln
+49 221 478-97626
+49 221 478-97627
karl-anton.kreuzer[at]uni-koeln[dot]de

