Neues aus der Uro-Onkologie
ASCO 2016
Die Jahrestagung der American Society of Clinical Oncology (ASCO) ist für internistische ebenso wie für viele „Organ“-Onkologen – darunter auch die Uroonkologen – einer der wichtigsten Kongresse weltweit im Jahresablauf. Ganz große Highlights auf urologischem Gebiet suchte man dieses Jahr vielleicht vergebens, aber bei den drei großen Tumorentitäten unseres Fachs, dem Prostata-, Blasen- und Nierenzellkarzinom, wurden eine Reihe von wichtigen Ergebnissen präsentiert, die Bekanntes bestätigten und ein besseres „Feintuning“ unserer Therapien gestatten.
Prostatakarzinom
Keine adjuvante Chemotherapie beim High-risk-Karzinom
Dass die Zugabe einer Chemotherapie mit Docetaxel zur Hormontherapie das Überleben beim fortgeschrittenen kastrationsresistenten Prostatakarzinom verlängert, wurde in der CHAARTED-Studie nachgewiesen [1]. Die skandinavische Prostatakarzinom-Studiengruppe wollte deshalb wissen, ob die alleinige adjuvante Gabe von sechs Zyklen Docetaxel
(75 mg/m2) nach kurativ intendierter radikaler Prostatektomie beim frühen Prostatakarzinom einen Nutzen für die Patienten bringt. Insgesamt 459 Patienten, die sich einer Prostatektomie unterzogen und ein hohes Rezidivrisiko hatten, wurden in der multinationalen Phase-III-Studie randomisiert, so Goran Ahlgren, Malmö [2]. Hohes Risiko war hier definiert als ein Stadium pT2 mit positivem Resektionsrand, wenn das Resektionspräparat einen Gleason-Score von 4 + 3 oder höher aufwies, ein Stadium pT3b mit einem Gleason-Score von 3 + 4 oder höher oder als positiver Nodalstatus. Im Kontrollarm wurden die Patienten nur aktiv überwacht. Primärer Endpunkt war das Auftreten eines biochemischen Rezidivs, d. h. ein Anstieg des Prostata-spezifischen Antigens (PSA) auf über 0,5 ng/ml.
Nach median knapp fünfjährigem Follow-up fand sich kein signifikanter Unterschied beim biochemisch rezidivfreien Überleben zwischen den beiden Armen; tendenziell war die bloße Beobachtung überlegen (p = 0,078), bei der Subgruppe von Patienten mit einem Gleason-Score von ≤ 7 schien dieser Vorteil für das konservative Vorgehen mit einer Hazard Ratio von 1,61 sogar signifikant zu sein (Abb. 1).
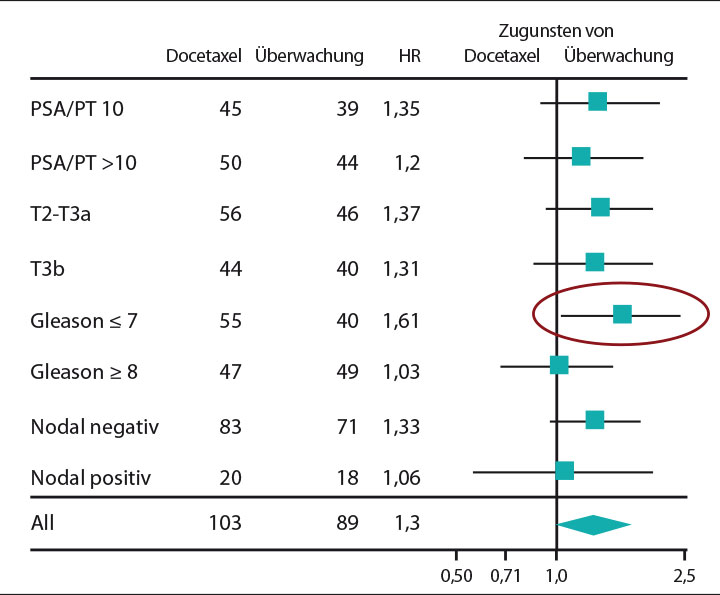
Diese wichtige Studie zeigt, dass eine adjuvante Chemotherapie ohne Hormontherapie das Risiko für ein biochemisches Rezidiv nach radikaler Prostatektomie nicht reduziert und es in einer Subgruppe von Patienten mit niedrigem Gleason-Score womöglich sogar erhöht. Das passt zu der retrospektiven Analyse der US-amerikanischen TX3503-Studie, die beim vorjährigen ASCO-Kongress gezeigt hatte, dass bei einem biochemischen Rezidiv die Zugabe von Docetaxel zu einer Hormontherapie allenfalls einen marginalen Vorteil bringt [3]. Die Therapie der Wahl für Patienten nach Prostatektomie bleibt daher weiterhin eine alleinige Hormontherapie (z. B. für nodal positive Patienten) bzw. eine adjuvante oder additive Bestrahlung für Patienten, bei denen keine R0-Resektion gelungen ist.
CHAARTED: Lebensqualität unter Docetaxel besser
Da Docetaxel zahlreiche unerwünschte Nebenwirkungen aufweist, fokussierte eine retrospektive Analyse der CHAARTED-Daten speziell auf die Lebensqualität der Patienten in dieser Studie [4]. Mit einer Reihe von Instrumenten vor allem aus dem FACT-Repertoire (Functional Assessment of Cancer Therapy) wurden verschiedene Kategorien der Lebensqualität zu Beginn und in 3-Monats-Abständen bis zu ein Jahr danach bestimmt, so Linda Patrick-Miller, Chicago. Bei einer Dauer der Docetaxel-Behandlung von rund vier Monaten zeigte sich erwartungsgemäß nach drei Monaten ein Abfall in einer Reihe von Parametern unter der zusätzlichen Chemotherapie. Danach war aber eine Trendumkehr erkennbar, sodass sich nach einem Jahr trotz statistischer Korrektur für tumorbedingte Symptome bei den meisten Parametern, insbesondere aber bei der Gesamt-Lebensqualität im FACT-Prostate-Score, ein signifikanter Vorteil für die Chemotherapie ergab (p < 0,01).
Erstlinien-Chemotherapie: Welches Taxan?
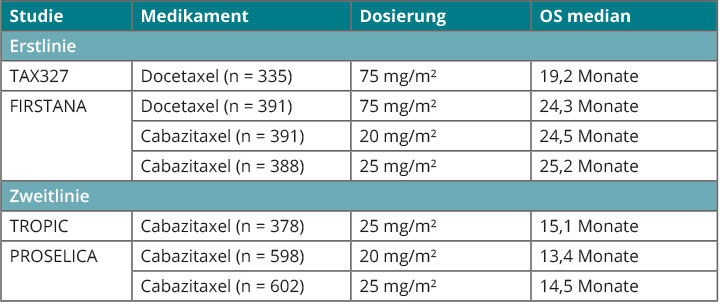
Nach einem Docetaxel-Versagen steht als Zweitlinien-Chemotherapie Cabazitaxel zur Verfügung, das sich in dieser Indikation in der TROPIC-Studie dem Mitoxantron überlegen gezeigt hatte [5]. Die Phase-III-Studie FIRSTANA unternahm es, die naheliegende Frage zu klären, ob Cabazitaxel in der chemotherapeutischen Erstlinie womöglich dem älteren Taxan überlegen sein könnte. Weil es Hinweise gab, dass die Standarddosis von 25 mg/m2 Cabazitaxel (C25) auch durch eine etwas reduzierte und besser verträgliche Dosis von 20 mg/m2 (C20) ersetzt werden könnte, wurden diese beiden Dosierungen mit 75 mg/m2 Docetaxel (D75) verglichen – in allen Fällen in Kombination mit Prednison, so Oliver Sartor, New Orleans [6]. Randomisiert wurden insgesamt 1.168 Patienten mit einem kastrationsresistenten Prostatakarzinom, die in allen drei Armen im Median neun Zyklen der jeweiligen Therapie erhielten.
Primärer Endpunkt war das Gesamtüberleben, und dieses fiel mit 24,5 Monaten für C20, 25,2 Monaten für C25 und 24,3 Monaten für D75 praktisch identisch für alle drei Arme aus. Bezüglich der sekundären Endpunkte war lediglich bei der Gesamtansprechrate C25 mit 41,6% dem Docetaxel mit 30,9% signifikant überlegen (p = 0,037). Grad-3/4-Nebenwirkungen waren im C25-Arm am häufigsten, allerdings war die Rate an dadurch bedingten Therapieabbrüchen zwischen C25 und D75 vergleichbar, während sie unter C20 etwas niedriger ausfiel.
Cabazitaxel: niedrigere Dosis gleich wirksam
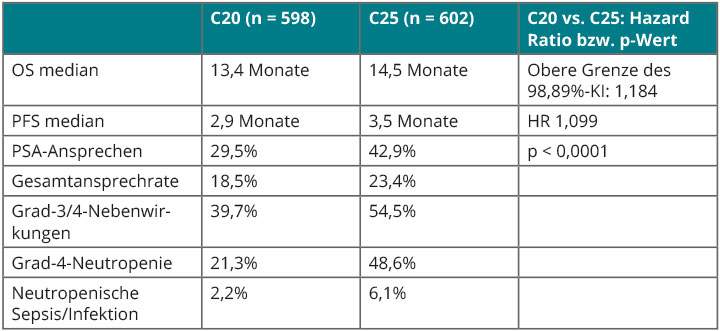
Ob diese besser verträgliche niedrigere Dosierung von Cabazitaxel in der üblichen Indikation, nämlich nach Versagen einer Docetaxel-Therapie, der Standarddosis von 25 mg/m2 hinsichtlich der Wirksamkeit vergleichbar ist, wurde an 1.200 solchen Patienten in der Phase-III-Nicht-Unterlegenheitsstudie PROSELICA untersucht, die Johann de Bono, London, in Chicago vorstellte [7]. Primärer Endpunkt war das Gesamtüberleben, und hier sollte nach dem statistischen Plan der obere Grenzwert des 98,89%-Konfidenzintervalls der Hazard Ratio einen Wert von 1,214 nicht überschreiten, um die Nicht-Unterlegenheit einer der beiden Dosierungen zu bestätigen.
Dieses Ziel erreichte C20, so de Bono (Tab. 1), ebenso beim sekundären Endpunkt progressionsfreies Überleben, obwohl im C20-Arm median nur sechs, im C25-Arm hingegen sieben Zyklen gegeben worden waren. Lediglich beim PSA-Ansprechen war C20 unterlegen (Tab. 1), dafür waren höhergradige Nebenwirkungen hier beträchtlich seltener (siehe Tab. 1). Die 20 mg/m2-Dosis von Cabazitaxel stellt also eine durchaus vertretbare, vergleichbar wirksame, aber besser verträgliche Alternative zur bisherigen Standarddosierung dar.
Die Situation bei der Taxan-basierten Chemotherapie des metastasierten kastrationsresistenten Prostatakarzinoms stellt sich also Mitte 2016 so dar wie in Tab. 2 gezeigt.
Urothelkarzinom
Immuncheckpoint-Inhibitor mit hohen Ansprechraten
Das Urothelkarzinom ist der maligne urologische Tumor mit der nach wie vor schlechtesten Prognose. In fortgeschrittenen Stadien liegen die medianen Überlebenszeiten auch mit Cisplatin-haltigen Regimes nicht wesentlich über einem Jahr; Carboplatin ist deutlich weniger wirksam, sodass die Aussichten für Patienten mit eingeschränkter Nierenfunktion noch schlechter sind. Für die Zweitlinie gab es bisher neben dem zugelassenen Standard Vinflunin kaum Optionen, sodass die Entwicklungen der neuen Immuntherapien, die sich in den letzten Jahren gezeigt haben, hochwillkommen sind. Obwohl noch kein Präparat aus der vielversprechenden Klasse der Immuncheckpoint-Inhibitoren für diese Indikation zugelassen ist, kann man jetzt schon sagen, dass dieser Ansatz die Behandlung des Urothelkarzinoms auf eine ganz neue Basis stellen wird. Interessant waren in Chicago vor allem zwei Auswertungen der Phase-II-Studie IMvigor210: Hier wurde der das Immuncheckpoint-Molekül PD-L1 inhibierende Antikörper Atezolizumab bei über 400 Patienten mit lokal fortgeschrittenem oder metastasiertem urothelialem Blasenkarzinom in einer Dosierung von 1.200 mg i. v. alle drei Wochen getestet.
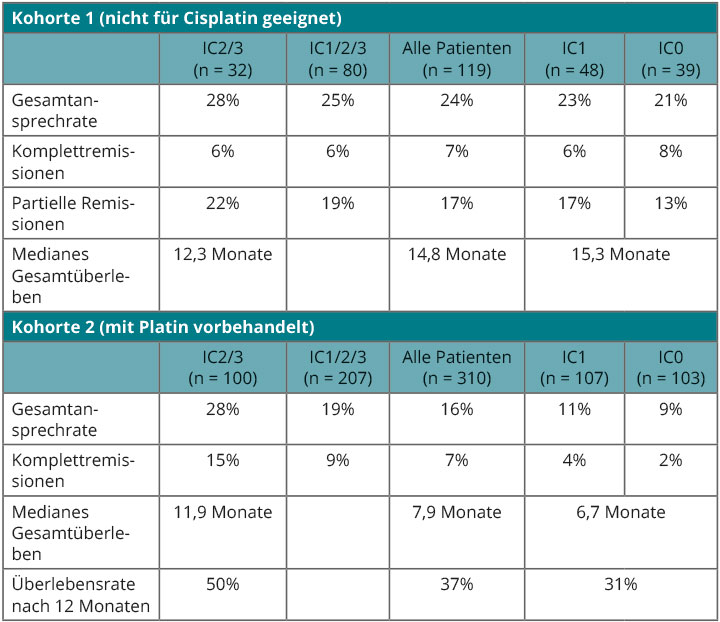
Kohorte 1 dieser Studienpopulation umfasst 119 Patienten, die nicht für eine Cisplatin-Therapie geeignet waren und Atezolizumab deshalb als Erstlinientherapie erhielten, so Arjun Balar, New York [8]. 18% der Patienten hatten allerdings bereits eine Systemtherapie erhalten, z. B. in einem neoadjuvanten Setting, 10% hatten eine Radiotherapie bekommen, und 66% wiesen viszerale Metastasen auf. Primärer Endpunkt war die Gesamtansprechrate, die sich ungefähr vergleichbar mit den Ergebnissen der Phase-I-Studie zeigte, wo sie bei über 25% gelegen hatte (Tab. 3 oben). Zu erkennen ist, dass das Ansprechen in dieser Kohorte weitgehend unabhängig von der immunhistochemisch bestimmten Expression des PD-L1-Antigens war.
Auch in Kohorte 2 mit 310 Patienten mit Cisplatin vorbehandelten Patienten waren die Ansprechraten vergleichbar, solange die Tumoren eine hohe Expression von PD-L1 zeigten, so Robert Dreicer, Charlottesville (Tab. 3 unten; [9]). Bei geringerer Expression gingen Ansprechen und auch Überlebenschancen zurück, aber auch in diesen Strata gibt es Patienten, bei denen der Antikörper zu wirken scheint, sodass die PD-L1-Expression sich beim Urothelkarzinom wohl nicht als Biomarker für den Einsatz von Atezolizumab verwenden lassen wird. Alles in allem sind diese Ergebnisse sehr vielversprechend, und die anhaltende Wirksamkeit und die gute Verträglichkeit lassen erwarten, dass sich hier ein neuer Therapiestandard für diese schwer zu behandelnden Tumoren entwickelt, so Dreicer.
Erweiterte Lymphadenektomie empfehlenswert
In frühen Stadien eines Blasenkarzinoms ist eine radikale Zystektomie potenziell kurativ, aber wie radikal die Operation sein sollte, ist nicht ganz klar: Es gibt aus retrospektiven Beobachtungen Daten, die nahelegen, dass bei aggressiveren Tumoren eine ausgedehntere Lymphadenektomie die Prognose verbessern könnte. Die Arbeitsgemeinschaft Urologische Onkologie (AUO) der Deutschen Krebsgesellschaft hat sich dieser Frage angenommen und die erste prospektive Studie dazu durchgeführt (LEA AUO AB 25/02), deren Ergebnisse wir in Chicago vorstellen konnten: In insgesamt 16 Zentren wurden 400 Patienten mit aggressiven T1-T4a-Tumoren randomisiert, im Rahmen der radikalen Zystektomie entweder eine eher begrenzte oder eine ausgedehnte Lymphknotendissektion zu erhalten [10]. Bei 183 Patienten in der zweiten Gruppe wurden insgesamt 190 positive Lymphknoten entdeckt, von denen ein gutes Drittel (38,9%) in der erweiterten Zone (lateral von der Blase und oberhalb bis zur Arteria mesenterica inferior) lag. Die 190 positiven Lymphknoten wurden bei 37 der 183 Patienten gefunden, und von diesen 37 Patienten waren sie bei lediglich 17 ausschließlich in den Feldern lokalisiert, die bei begrenzter Ausräumung berücksichtigt worden wären; bei den übrigen 20 Patienten waren gleichzeitig (n = 16) oder ausschließlich (n = 4) Lymphknoten in den erweiterten Feldern betroffen.
Beim primären Endpunkt rezidivfreies Überleben war die ausgedehnte Lymphadenektomie numerisch überlegen mit einer 5-Jahres-Rate von 67,0% gegenüber 61,5% bei begrenzter Ausräumung; dieser Unterschied fiel allerdings nicht signifikant aus (HR 0,83; p = 0,34; Tab. 4). Beim krebsspezifischen Überleben galt ähnliches mit 77,6% vs. 66,2% (HR 0,70; p = 0,12), ebenso beim Gesamtüberleben (61,4% vs. 51,6%; median 70,6 vs. 62,7 Monate; HR 0,77; p = 0,12). Ein signifikanter Vorteil des radikaleren Vorgehens zeigte sich in einer Post-hoc-Subgruppenanalyse für die 160 Patienten mit pT2-Tumoren mit einem rezidivfreien 5-Jahres-Überleben von 85,0% versus 62,5% (HR 0,39; p = 0,01) und einem Gesamtüberleben von 79,8% vs. 59,1% (HR 0,52; p = 0,04; Tab. 4 unten).
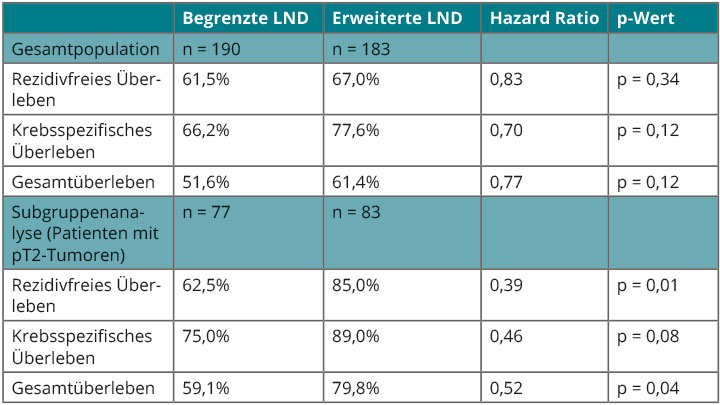
Dass im Gesamtkollektiv kein signifikanter Vorteil der ausgedehnteren Operation erzielt wurde, kann unter anderem am Einschluss von Patienten mit T1-Stadium liegen, die kaum positive Lymphknoten aufweisen und damit das Ergebnis verwässert haben könnten. Zusätzlich war die mediane Anzahl von entnommenen Lymphknoten im begrenzten Feld mit 19 bereits sehr hoch. Ein (wenngleich hier nicht signifikanter) Gewinn von absolut fast 10% beim Gesamtüberleben nach fünf Jahren zeigt, dass das radikalere chirurgische Vorgehen sehr wahrscheinlich einen klinischen Nutzen hat – und das ohne wesentliche zusätzliche Morbidität. Die alte Vorstellung, dass die pelvine Lymphadenektomie einen rein diagnostischen Zweck hat, sollte man auf jeden Fall aufgeben – sie kann, wie sich in der pT2-Subgruppe zeigt, durchaus therapeutischen Wert haben und sollte in künftigen Studien ebenso wie eine neoadjuvante Therapie berücksichtigt werden.
Nierenzellkarzinom
Neuer Therapiestandard in der Zweitlinie
Die Therapie des fortgeschrittenen oder metastasierten Nierenzellkarzinoms hat in den letzten zehn Jahren große Fortschritte gemacht. Da die Tumoren aber regelmäßig resistent gegen die verfügbaren Medikamente werden, besteht immer Bedarf an neuen, wirksamen Therapieoptionen. Zumindest die Erstlinientherapie wird derzeit durch die VEGFR-Inhibitoren Sunitinib und Pazopanib beherrscht. In der Zweitlinie kann dieses Therapieprinzip mit Axitinib oder Sorafenib noch einmal zum Einsatz kommen, oder man kann neben dem mTOR-Inhibitor Everolimus den kürzlich zugelassenen PD-1-Checkpoint-Inhibitor Nivolumab wählen, der zu einem signifikant verbesserten Gesamtüberleben gegenüber Everolimus führt.
In der Phase-III-Studie METEOR wurde der Multikinase-Inhibitor Cabozantinib bei Patienten, die zuvor mindestens einen VEGFR-Inhibitor erhalten hatten, ebenfalls gegen Everolimus verglichen. Cabozantinib hemmt neben VEGFR auch die Tyrosinkinasen von MET und AXL, die bei klarzelligen Nierenzellkarzinomen hochreguliert und an der Tumorprogression beteiligt sowie mit einer schlechten Prognose assoziiert sind. Die Ergebnisse, die Toni Choueiri, Boston, beim ASCO-Kongress vorstellte [11], sind mittlerweile auch voll publiziert [12]:
In der METEOR-Studie wurden 658 vorbehandelte Patienten randomisiert, entweder Everolimus in der Standarddosierung von 10 mg/d oder Cabozantinib mit 60 mg/d zu erhalten. Der primäre Endpunkt der progressionsfreien Überlebenszeit war in der ersten Interimsanalyse unter Cabozantinib bereits doppelt so lange gewesen wie unter Everolimus, in der nun gezeigten zweiten – ungeplanten – Interimsanalyse nach median eineinhalb Jahren Nachbeobachtungszeit war Cabozantinib hier mit einer Hazard Ratio von 0,51 (p < 0,0001) unverändert im Vorteil; darüber hinaus zeigte sich auch bei der Gesamtansprechrate mit 17% vs. 3% (p < 0,0001) und vor allem beim Gesamtüberleben mit median 21,4 versus 16,5 Monaten ein deutlicher und statistisch signifikanter Vorteil (HR 0,66; p = 0,00026; Abb. 2).
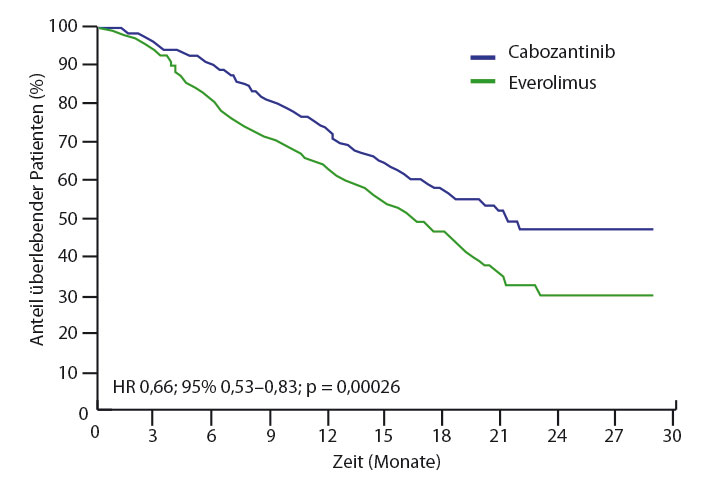
Die häufigsten Grad-3/4-Nebenwirkungen waren ein Hypertonus (15% unter Cabozantinib vs. 4% unter Everolimus), Diarrhö (13% vs. 2%), Fatigue (11% vs. 7%), ein Hand-Fuß-Syndrom (8% vs. 1%), Anämie (6% vs. 17%), Hyperglykämie (1% vs. 5%) und Hypomagnesiämie (5% vs. 0%). Schwere unerwünschte Wirkungen vom Grad 3/4 waren mit 68% insgesamt sehr häufig.
Die klinische Aktivität von Cabozantinib war für alle untersuchten Subgruppen (unabhängig von MSKCC-Risikokategorie und Anzahl der Vortherapien) zu erkennen. Offenbar kann damit zum Teil eine Resistenz gegenüber VEGFR-Inhibitoren überwunden werden. Von allen bisher beim Nierenzellkarzinom zugelassenen Substanzen konnten nur Cabozantinib und Nivolumab eine signifikante Überlebensverlängerung (gegenüber Everolimus) bewirken. Cabozantinib, so Choueiri, qualifiziert sich mit diesen Ergebnissen eindeutig als ein weiterer neuer Therapiestandard für Patienten mit vorbehandeltem, fortgeschrittenem Nierenzellkarzinom. Allerdings sollten die Patienten sorgfältig überwacht werden, um auf schwere Nebenwirkungen gegebenenfalls mit Dosismodifikationen reagieren zu können.
Langzeitansprechen unter Checkpoint-Inhibition
In der Zweit- oder in weiteren Linien der Therapie des Nierenzellkarzinoms kann seit Kurzem der Checkpoint-Inhibitor Nivolumab eingesetzt werden, der in der Phase-III-Studie CheckMate-025 eine signifikante Verlängerung des Überlebens gegenüber Everolimus bewirkt hatte (von median 19,6 auf 25,0 Monate; p = 0,002; [13]). Die bisher längsten Nachbeobachtungszeiten unter einer solchen Medikation stellte nun in Chicago David McDermott, Boston, in einer gepoolten Analyse einer Phase-I- (mit 34 Patienten) und einer Phase-II-Studie (mit 167 Patienten) vor [14]. Nach fünf Jahren waren in der Phase-I-Studie noch 34% der Patienten am Leben, nach vier Jahren in der Phase-II-Studie 29%.
In der Phase-II-Studie lassen sich aufgrund der relativ hohen Patientenzahlen potenzielle Prädiktoren für ein langfristiges Überleben identifizieren, so McDermott: Darunter sind der MSKCC-Risikoscore (medianes Überleben bei MSKCC 0 35,5 Monate, bei MSKCC 1 22,1 und bei MSKCC 2–3 12,5 Monate) sowie die Tiefe des Ansprechens: So ist bei Patienten, die unter Nivolumab eine komplette oder eine partielle Remission erzielten, die mediane Überlebenszeit noch nicht erreicht, bei lediglich einer Krankheitsstabilisierung betrug sie 22,9 und bei primärer Progression immerhin noch 9,0 Monate. Auch bei den Patienten in den schlechteren Risikogruppen gab es einen Anteil von 10–20%, die langfristig (bis zu mindestens vier Jahre lang) überlebten. Insgesamt betrug die Ansprechrate 21,6%, ein Ansprechen wurde nach median 2,8 Monaten erreicht und dauerte median immerhin 23,0 Monate an; eine Krankheitsstabilisierung stellte sich bei 41,3% der Patienten ein, sodass der klinische Nutzen (Clinical Benefit Rate) insgesamt bei 62,9% lag.
Kombination in der Zweitlinie?
Der Multikinase-Inhibitor Lenvatinib hemmt ebenso wie Cabozantinib neben VEGF-Rezeptoren noch eine Reihe anderer Tyrosinkinasen. In einer randomisierten dreiarmigen Phase-II-Studie, in die 153 Patienten mit fortgeschrittenem Nierenzellkarzinom nach Versagen einer gegen VEGFR gerichteten Therapie eingeschlossen wurden, konnte Lenvatinib alleine und in Kombination mit Everolimus das progressionsfreie Überleben gegenüber einer alleinigen Everolimus-Therapie signifikant verlängern [15]. In einer Subgruppenanalyse, die Thomas Hutson, Tampa, beim ASCO-Kongress vorstellte, konnte zum einen erstmals auch ein Vorteil der Kombination beim Gesamtüberleben wahrscheinlich gemacht werden (median 25,5 Monate gegenüber 15,4 Monate unter Everolimus alleine), der wohl nur wegen der geringen Patientenzahlen nicht ganz signifikant ausfiel (HR 0,59; p = 0,065; [16]). Zum anderen zeigte sich der Vorteil der Kombination in allen untersuchten Subgruppen, wenngleich er in den prognostisch ungünstigeren Strata (bezüglich MSKCC-Risikoscore, Tumorgröße, Lokalisation der Metastasen) weniger stark ausfiel.
Erstlinientherapien auch im „Real Life“ gleichwertig
Die VEGFR-Tyrosinkinaseinhibitoren Sunitinib und Pazopanib haben in Phase-III-Studien in der Erstlinientherapie des metastasierten Nierenzellkarzinoms gleiche Wirksamkeit gezeigt (z. B. [17, 18]), während in der PISCES-Studie [19] die Patienten signifikant häufiger Pazopanib präferierten. Wie beide Substanzen sich im „wirklichen Leben“ bewähren, wurde anhand der Daten von über 7.400 Patienten aus einer großen Datenbank, des International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) untersucht [20]. Wie Jose Morales, Calgary, beim ASCO-Kongress berichtete, fand sich kein signifikanter Unterschied bei Gesamtüberleben (median 22,3 vs. 22,6 Monate), progressionsfreiem Überleben (median 8,4 vs. 8,3 Monate), Ansprechrate (30% vs. 28%) oder bei den Überlebenszeiten unter den nachfolgenden Zweitlinientherapien. Die Therapieentscheidung in der Erstlinie wird also weiterhin individuell anhand von Vorerkrankungen und zu erwartenden Nebenwirkungen zu treffen sein.
Literatur
1. Sweeney CJ et al. N Engl J Med 2015; 373: 737-46.
2. Ahlgren G et al. ASCO 2016, Abstract #5001.
3. Morris MJ et al. ASCO 2015, Abstract #5011.
4. Patrick-Miller LJ et al. ASCO 2016, Abstract #5004.
5. de Bono JS et al. Lancet 2010; 376: 1147-54.
6. Sartor AO et al. ASCO 2016, Abstract #5006.
7. de Bono JS et al. ASCO 2016, Abstract #5008.
8. Balar AV et al. ASCO 2016, Abstract #LBA4500.
9. Dreicer R et al. ASCO 2016, Abstract #4515.
10. Gschwend JE et al. ASCO 2016, Abstract #4503.
11. Choueiri TK et al. ASCO 2016, Abstract #4506.
12. Choueiri TK et al. Lancet Oncol 2016; 17: 917-27.
13. Motzer RJ et al. N Engl J Med 2015; 373: 1803-13.
14. McDermott DF et al. ASCO 2016, Abstract #4507.
15. Motzer RJ et al. Lancet Oncol 2015; 16: 1473-82.
16. Hutson TE et al. ASCO 2016, Abstract #4553.
17. Sternberg CN et al. J Clin Oncol 2010; 28: 1061-8.
18. Motzer RJ et al. N Engl J Med 2013; 369: 722-31.
19. Escudier B et al. J Clin Oncol 2014; 32: 1412-8.
20. Morales JM et al. ASCO 2016, Abstract #4510.

Univ.-Prof. Dr. Jürgen E. Gschwend
Direktor der Klinik und Poliklinik für Urologie
Klinikum rechts der Isar der
Technischen Universität München
Ismaninger Straße 22, 81675 München
+49 89 4140-2521 oder -2522
+49 89 4140-4843
juergen.gschwend[at]tum[dot]de

