Neues aus der Dermato-Onkologie
ASCO 2016
Die Dermato-Onkologie kann für sich in Anspruch nehmen, eine Art Inkubationskammer zu sein, in der die modernen immunonkologischen Therapien mit Immuncheckpoint-Inhibitoren sich beim malignen Melanom erstmals in der Klinik bewähren konnten. Auch beim diesjährigen ASCO-Kongress gab es wieder eine Fülle von neuen Ergebnissen dazu sowie zu anderen Therapieansätzen und Tumorentitäten, von denen hier nur eine kleine Auswahl referiert werden kann.
Melanom
Immuntherapien
Der zweite bislang zur Therapie des metastasierten Melanoms zugelassene Checkpoint-Inhibitor, Pembrolizumab, hat sich in der KEYNOTE-002-Studie bei Ipilimumab-refraktärem Melanom einer Chemotherapie [1] und in KEYNOTE-006 dem CTLA4-Antikörper Ipilimumab überlegen gezeigt [2]. Die mit drei Jahren bisher längsten Nachbeobachtungszeiten zur Pembrolizumab-Therapie gibt es aus der Phase-Ib-Studie KEYNOTE-001, so Caroline Robert, Villejuif [3]. Tab. 1 zeigt, dass die Überlebensdaten für das, was wir bis vor Kurzem vom metastasierten Melanom gewohnt waren, ausgezeichnet sind: Raten von rund 40% nach drei Jahren lassen hoffen, dass das Langzeitüberleben auch unter diesem PD-1-Antikörper noch besser ausfällt als das, was wir vor einigen Jahren für Ipilimumab gesehen haben [4]. Tendenziell scheinen Ipilimumab-naive und vor allem vollständig therapienaive Patienten zunächst besonders gut anzusprechen, aber nach drei Jahren hat sich dieser Vorteil beinahe wieder nivelliert. Auf jeden Fall legen diese Daten nahe, dass Pembrolizumab beim metastasierten Melanom unabhängig von der Vorbehandlung langfristige Wirksamkeit zeigt und sein Einsatz daher bei allen Patienten empfohlen werden kann.
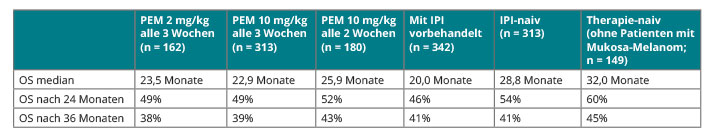
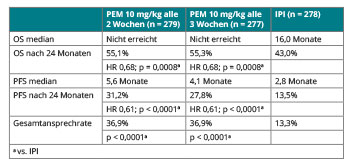
Auch aus der zulassungsrelevanten KEYNOTE-006-Studie wurden in Chicago von Jacob Schachter, Tel Aviv, die finalen Überlebensdaten vorgestellt [5]. Hier war Pembrolizumab bei Patienten mit maximal einer Vortherapie in zwei verschiedenen Dosierungsintervallen
(10 mg/kg alle zwei oder drei Wochen für zwei Jahre) randomisiert gegen Ipilimumab getestet worden und hatte schon in der primären Analyse zu einem besseren progressionsfreien und Gesamtüberleben geführt – bei geringeren Raten an Nebenwirkungen vom Grad 3–5 [2]. Auch nach weiteren neun Monaten Follow-up, d. h. nach mindestens 21 Monaten, so Schachter, sind für die beiden Pembrolizumab-Arme die Medianwerte des Gesamtüberlebens noch nicht erreicht (Tab. 2). Das mediane progressionsfreie Überleben ist unter der zweiwöchentlichen Gabe doppelt so lange wie unter Ipilimumab, und die Ansprechraten waren unter dem PD-1- gegenüber dem CTLA-4-Antikörper beinahe verdreifacht. Zusammen mit einer geringeren Toxizität bestätigen diese Ergebnisse, dass die PD-1-Antikörper der derzeitige Therapiestandard bei Patienten mit metastasiertem Melanom sind.
Es gibt von verschiedenen Tumorentitäten Hinweise darauf, dass die Wirksamkeit von PD-1-Antikörpern von der Expression des PD-1-Liganden PD-L1 im Tumor und seiner Umgebung abhängt. Adil Daud, San Francisco, untersuchte das bei den Teilnehmern der KEYNOTE-006-Studie und fand tatsächlich, dass Ansprechen, progressionsfreies und Gesamtüberleben bei den Patienten ohne PD-L1-Expression unter Pembrolizumab erkennbar geringer waren als bei denen mit positiver Expression (Tab. 3; [6]). Allerdings ist Pembrolizumab auch bei den Patienten mit PD-L1-negativen Tumoren dem Ipilimumab immer noch deutlich überlegen, sodass PD-L1 sich hier nicht als prädiktiver Marker für oder gegen den Einsatz des Antikörpers eignet.
PD-1- und CTLA-4-Antikörper in Kombination
Die Entwicklung der Melanom-Therapie ist aber mittlerweile schon ein Stück weiter: Statt PD-1- gegen CTLA-4-Antikörper zu testen, kombinieren wir die beiden Immuntherapie-Prinzipien miteinander. Die Kombination von Nivolumab und Ipilimumab ist bereits zur Behandlung des nicht resezierbaren oder metastasierten Melanoms zugelassen; diese Zulassung basiert auf der Studie CheckMate-067 [7], und zu dieser Studie präsentierte Jedd Wolchok, New York, beim ASCO-Kongress ein Update [8]: Beim progressionsfreien Überleben ist die Kombination mit median 11,5 Monaten nach wie vor den beiden Monotherapie-Armen (Nivolumab 6,9 Monate, Ipilimumab 2,9 Monate) überlegen, und das war auch hier unabhängig vom Ausmaß der PD-L1-Expression ebenso wie vom BRAF-Mutationsstatus, so Wolchok.
Die Kombination aus Nivolumab und Ipilimumab ist wirksamer als die Monotherapien, aber auch toxischer. Auch der zweite PD-1-Antikörper Pembrolizumab wurde – bislang nur in einer Phase-I-Studie (KEYNOTE-029) – mit Ipilimumab kombiniert, und zwar mit einer reduzierten Dosis des CTLA-4-Antikörpers. Georgina Long, Sydney, präsentierte in Chicago Daten einer größeren Expansionskohorte dieser Studie mit 153 Patienten [9]. Die Kombination zeigte bei akzeptablem Nebenwirkungsprofil (38% Grad-3/4-Nebenwirkungen) eine gute, robuste Wirkung, so Long – mit einer Ansprechrate von 51% in der zentralen Begutachtung (darunter 9% Komplettremissionen). Die große Frage nach dem Vergleich dieser Kombination mit der aus Nivolumab und Ipilimumab ist damit natürlich noch nicht beantwortet.
PD-1-Inhibitoren: Wie lange behandeln?
Ebenso unbeantwortet ist bislang die Frage nach der erforderlichen Dauer der Therapie: Ipilimumab wurde von Anfang an nur viermal gegeben, die PD-1-Antikörper aber können laut Zulassung bis zu einem Wirkverlust oder bis zum Auftreten nicht mehr akzeptabler Nebenwirkungen verabreicht werden. Ob das tatsächlich notwendig ist, ist unklar; eine vorläufige Antwort versuchte Stephen Hodi, Boston, anhand der Daten einer Subgruppe von Patienten der Phase-II-Studie CheckMate-069 zu geben, in der die Kombination aus Nivolumab und Ipilimumab bei therapienaiven Patienten mit BRAF-Wildtyp-Tumoren gegenüber einer Ipilimumab-Monotherapie Ansprechrate und progressionsfreies Überleben deutlich verbessert hatte [10]. Aufgrund von Toxizitäten war die Abbruchrate in dieser Studie relativ hoch gewesen, und deshalb konnte Hodi nun in Chicago die Patienten, die die Therapie beendet hatten, mit denen vergleichen, die sie wie geplant fortgeführt hatten [11]: Weder beim Ansprechen noch beim Gesamtüberleben zeigten sich Unterschiede zwischen den Patienten, die die Behandlung abgebrochen hatten und dem Gesamtkollektiv (Gesamtüberleben nach 18 Monaten 79,5% versus 73,2%). Es wäre daher durchaus sinnvoll, in kontrollierten Studien die maximal nötige Dauer einer Immuntherapie beim Melanom zu untersuchen.
PD-1- und CTLA-4-Inhibitor sequenziell
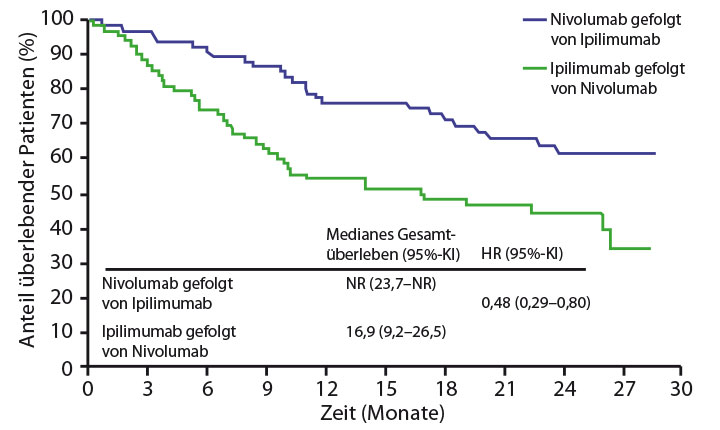
Eine Strategie, mit der sich möglicherweise Toxizitäten reduzieren lassen, ist die sequenzielle anstelle der gleichzeitigen Gabe von zwei Medikamenten. Für die Kombination aus Nivolumab und Ipilimumab wurde das bisher in der randomisierten Phase-II-Studie CheckMate-064 getestet, in der bei Patienten mit fortgeschrittenem Melanom die Gabe von Nivolumab, gefolgt von Ipilimumab, mit der umgekehrten Reihenfolge verglichen wurde. Die Auswertung, die Jeffrey Weber, New York, beim ASCO-Kongress präsentierte [12] und die mittlerweile auch publiziert ist [13], zeigte einen eindeutigen Vorteil für die Sequenz Nivolumab-Ipilimumab beim Ansprechen (54% vs. 31%, 11% vs. 6% Komplettremissionen), aber auch bereits beim Gesamtüberleben: Der Medianwert ist im Nivolumab-Ipilimumab-Arm noch nicht erreicht, im anderen Arm liegt er bei 16,9 Monaten; nach einem Jahr waren noch 76% versus 54% der Patienten am Leben (Hazard Ratio 0,48; p = 0,0041; Abb. 1). Die Toxizität lässt sich durch diese Sequenzierung allerdings nicht reduzieren: Im Gegensatz zur reversen Sequenz waren die Toxizitäten unter Nivolumab-Ipilimumab etwa von der gleichen Art und Häufigkeit wie bei gleichzeitiger Gabe beider Antikörper, so Weber.
Daten aus dem deutschen „Expanded Access Program“
In klinischen Studien erfolgt eine spezielle Selektion der Patienten, wie sie nach der Zulassung eines Medikaments im „richtigen Leben“ nicht möglich und auch nicht wünschenswert ist. Um Informationen zur Anwendung von Pembrolizumab im klinischen Alltag zu gewinnen, haben wir in Deutschland die Daten der Patienten gesammelt, die im „Expanded Access Program“, also nach Ende der Zulassungsstudien, aber noch vor der formalen Zulassung mit diesem Antikörper behandelt wurden. Wie Jessica Hassel, Heidelberg, in Chicago berichtete [14], zeigte Pembrolizumab bei diesen 560 Patienten ein sehr akzeptables Sicherheitsprofil und konnte seine Wirksamkeit mit einer Remissionsrate von 23% (4% Komplettremissionen) und einer Krankheitskontrollrate von 43% im Vergleich mit der KEYNOTE-002-Studie [15] und dem US-amerikanischen „Expanded Access Program“ bestätigen.
Mukosa- und akrale Melanome
Die Wirksamkeit von Checkpoint-Inhibitoren ist streng genommen nur für „normale“ kutane Melanome nachgewiesen, die in den entsprechenden klinischen Studien bei der weit überwiegenden Mehrzahl aller Patienten vorlagen. Es ist nicht selbstverständlich, dass die Ergebnisse gleichermaßen für seltenere Formen wie Mukosa- oder akrale Melanome gelten: Diese unterscheiden sich genetisch und klinisch vom kutanen Melanom und haben eine geringere Mutationslast – was bei Immuntherapien sehr wohl eine Rolle spielen könnte – und eine schlechtere Prognose. Einer großen, überwiegend US-amerikanischen Arbeitsgruppe gelang es, retrospektiv Daten von 60 solchen Patienten (35 mit fortgeschrittenen Mukosa- und 25 mit akralen Melanomen) zu sammeln, die mit Nivolumab (etwa ein Drittel) oder Pembrolizumab behandelt worden waren. Rodrigo Munhoz, Sao Paulo, stellte die Ergebnisse beim ASCO-Kongress vor [16]:
Bei beiden Entitäten waren die Antikörper wirksam, wobei die akralen Tumoren etwas besser abschnitten: Hier zeigte sich eine Ansprechrate von 32%, ein medianes progressionsfreies Überleben von 4,1 Monaten und ein medianes Gesamtüberleben von 31,7 Monaten, während die entsprechenden Werte für die Mukosa-Tumoren bei 23%, 3,9 Monaten bzw. 12,4 Monaten lagen. Die Nebenwirkungsprofile beider Antikörper unterschieden sich nicht von dem, was aus den bisherigen Studien bekannt ist, sodass man diese Varietäten von Melanomen durchaus genauso behandeln kann wie kutane Tumoren. Gleichwohl ist es dringend erforderlich, so Munhoz, die Genetik dieser Tumoren (v. a. vorliegende Treibermutationen) und ihre Immunologie sorgfältig zu erforschen, um so vielleicht die Therapie weiter zu optimieren.
Aderhautmelanom
Kaum untersucht ist bisher die Wirkung von PD1-Antikörpern beim metastasierten Aderhautmelanom. Kathy Tsai, San Francisco, stellte in Chicago eine ebenfalls retrospektive Zusammenstellung von 58 Patienten mit solchen Tumoren vor, von denen 40 mit Pembrolizumab, 16 mit Nivolumab und zwei mit Atezolizumab behandelt worden waren [17]. Die Verträglichkeit der Therapien war gut, aber die Wirksamkeit sehr beschränkt mit lediglich zwei Remissionen und kurzem progressionsfreiem (median 2,7 Monate) und Gesamtüberleben (median 9,5 Monate). Offenbar, so Tsai, müssen andere Therapieoptionen gefunden werden, um dieser speziellen Subgruppe von Patienten weiterhelfen zu können.
Zielgerichtete Therapien
Kombinationen von BRAF- und MEK-Inhibitoren
Für die Hälfte aller Melanome, die Mutationen im BRAF-Gen tragen, stehen als zielgerichtete Therapien BRAF-Inhibitoren zur Verfügung, die heute durchweg mit MEK-Inhibitoren kombiniert werden, weil das die Wirksamkeit erhöht und gleichzeitig bestimmte Toxizitäten, vor allem die Entstehung von Hautveränderungen, verhindert. Die Kombination aus dem BRAF-Inhibitor Dabrafenib und dem MEK-Inhibitor Trametinib beispielsweise hatte in einer gepoolten Analyse einer Phase-II- und von zwei Phase-III-Studien (COMBI-d und COMBI-v) mit insgesamt 614 Patienten hohe Ansprechraten (67%) und Gesamtüberlebenszeiten (median 25,6 Monate) gezeigt. In einer weiteren Analyse dieses großen Patientenkollektivs ging es vor allem um die Sicherheitsdaten, so Jean-Jacques Grob, Marseille [18]. Es zeigte sich, dass das Nebenwirkungsprofil in allen drei Studien relativ einheitlich war: Bei einem medianen Follow-up von 20 Monaten zeigte sich Fieber als die häufigste Nebenwirkung, die bei 57% der Patienten auftrat. Das war aber in der Regel im ersten halben Jahr der Therapie der Fall – hier lag die Häufigkeit bei 52%, während sie in den folgenden Halbjahren höchstens halb so hoch ausfiel. Trotz seiner Häufigkeit ist dieses Symptom aber kein prädiktiver Marker für die Wirksamkeit der Therapie.
Das zweite zugelassene BRAF-/MEK-Inhibitor-Paar, Vemurafenib und Cobimetinib, hat seine klinische Wirksamkeit vor allem in der BRIM-7- und in der coBRIM-Studie unter Beweis gestellt. BRIM-7 war die Pilotstudie gewesen, in der Patienten mit BRAF-mutiertem Melanom, die entweder unter Vemurafenib progredient oder therapienaiv waren, die Kombination erhalten hatten. In der Phase-III-Studie coBRIM wurde deren Überlegenheit gegenüber der Vemurafenib-Monotherapie dann endgültig nachgewiesen. In Chicago stellte Adil Daud, San Francisco, nun eine Analyse der Daten der 129 Patienten aus der BRIM-7-Studie vor [19].
Das Follow-up für die 64 BRAF-Inhibitor-naiven Patienten betrug median 26 Monate, die Ansprechrate wie bei der ersten Analyse 87%, aber zwei weitere Patienten hatten nun eine Komplettremission erreicht, sodass deren Anteil von 16% auf 19% anstieg. Das progressionsfreie Überleben für die BRAF-Inhibitor-naiven Patienten lag bei median 13,8 Monaten, das Gesamtüberleben bei median 31,2 Monaten. Die Patienten, die die Kombination erst nach Progression unter Vemurafenib erhalten hatten, schnitten mit 15% Ansprechrate, 2,8 Monaten progressionsfreiem und 8,5 Monaten Gesamtüberleben deutlich schlechter ab. Offenbar, so implizieren die späten Konversionen von partiellen nach kompletten Remissionen laut Daud, ist die Kombination bei fortgesetzter Therapie weiter wirksam.
KIT-Inhibition bei Melanom-Subtypen
Bei bestimmten Subtypen von Melanomen, z. B. solchen vom Mukosa-Typ, mit akraler oder vulvo-vaginaler Lokalisation oder solar induzierten, spielen Mutationen im c-KIT-Rezeptor eine wichtige Rolle. In klinischen Studien haben solche Tumoren auf Inhibitoren, die gegen die KIT-Tyrosinkinase wirksam sind – wie Imatinib und Sunitinib – angesprochen. Diese Inhibitoren wirken nicht gegen die häufigste Mutation in Exon 11 (L576P), wohl hingegen Dasatinib – zumindest in Zelllinien mit dieser Mutation. In einer Phase-I-Studie waren nur drei Patienten mit KIT-Mutation enthalten gewesen und hatten von Dasatinib mit Überlebenszeiten von über 13 Monaten profitiert. In der Phase II wurden 24 Patienten mit KIT-Mutationen eingeschlossen, bevor die Studie wegen langsamer Rekrutierung geschlossen wurde. Wie Kevin Kalinsky, New York, berichtete [20], liegt das progressionsfreie Überleben bei median 4,0 und das Gesamtüberleben bei median 12,3 Monaten. Für die zehn noch überlebenden Patienten beträgt die mediane Nachbeobachtungszeit bisher 15,2 Monate. 48% der Patienten erlitten Nebenwirkungen vom Grad 3, darunter vor allem Fatigue, Anämie und Dyspnoe, aber Dasatinib scheint bei diesen seltenen Tumorentitäten genauso wirksam zu sein wie Imatinib.
Neuer MEK-Inhibitor
Ungefähr ein Fünftel aller Melanome trägt Mutationen im NRAS-Onkogen, gegen die es aber keine spezifischen Therapien gibt. Auch Immuncheckpoint-Inhibitoren können versagen, sodass für diese Patienten Bedarf an neuen Behandlungsoptionen besteht. In der Phase-III-Studie NEMO wurden 393 Patienten mit Melanomen und NRAS-Mutationen, die therapienaiv waren oder vorher bereits eine Immuntherapie bekommen hatten, im Verhältnis 2 : 1 randomisiert, den MEK-Inhibitor Binimetinib (MEK ist Bestandteil des Signalwegs, der von den RAS-Kinasen eröffnet wird) oder Dacarbazin zu erhalten [21]. Ansprechraten von 15% versus 7% und Krankheitskontrollraten von 58% versus 25% sowie progressionsfreie Überlebenszeiten von median 3,9 versus 1,7 Monaten (HR 0,65; p < 0,001) bei guter Verträglichkeit sprechen dafür, Binimetinib als eine neue Behandlungsoption für NRAS-mutierte Melanome mit und ohne vorangegangene Immuntherapie anzusehen, so Reinhard Dummer, Zürich.
Checkpoint- und BRAF-/MEK-Inhibition kombinieren?
Die „Arbeitsteilung“ zwischen Checkpoint-Inhibitoren und BRAF-/MEK-Inhibitoren sieht bisher etwa so aus: Patienten, deren Tumoren keine BRAF-Mutation tragen, erhalten sofort eine Immuntherapie, diejenigen mit BRAF-Mutation können zunächst mit den niedermolekularen Inhibitoren behandelt werden – insbesondere dann, wenn ein hoher Remissionsdruck besteht, weil diese Substanzen in der Regel schneller wirken als die Antikörper. Wenn beide Substanzklassen aber über nachgewiesene Wirksamkeit verfügen, warum sollte man sie dann bei Melanomen mit BRAF-Mutation nicht kombinieren, um möglicherweise die Wirksamkeit noch weiter zu erhöhen – zumal die Kinaseinhibitoren im Gegensatz zu den Antikörpern eher kurz wirken?
In einer US-amerikanisch-australischen Phase-I/II-Studie wurden deshalb Pembrolizumab einerseits und Dabrafenib und Trametinib andererseits in steigenden Dosierungen bei therapienaiven Patienten mit BRAF-mutiertem Melanom gegeben [22]. Bei 15 in die Phase I eingeschlossenen Patienten lag die (noch unbestätigte) Ansprechrate bei 60%, die mediane Zeit bis zum Ansprechen bei 84 Tagen. Die Studie wird deshalb nun in die Phase II übergehen, so Antoni Ribas, Los Angeles, wo die Dosierungen für Pembrolizumab 2 mg/kg alle drei Wochen, für Dabrafenib zweimal 150 mg/d und für Trametinib 2 mg/d betragen werden.
Basalzellkarzinom und Merkel-Zellkarzinom
Die Erfolge der Therapieforschung der letzten Jahre beim Melanom haben andere Hauttumoren etwas in den Hintergrund gedrängt, obwohl sie gar nicht so selten – wie das Basalzellkarzinom – oder extrem aggressiv – wie das Merkel-Zellkarzinom – sind. Dessen ungeachtet hat sich beim ersteren für fortgeschrittene Stadien ebenfalls eine neue Therapie etabliert, für das Merkel-Zellkarzinom scheinen die Immuncheckpoint-Inhibitoren eine neue Chance zu bedeuten. Beide Aspekte wurden auch beim diesjährigen ASCO-Kongress beleuchtet.
Das fortgeschrittene Basalzellkarzinom, dem chirurgisch nicht mehr beizukommen ist, kann seit einiger Zeit mit dem ersten überhaupt zugelassenen Hedgehog-Inhibitor Vismodegib wirksam behandelt werden. In den klinischen Studien war bis zur Progression oder bis zum Auftreten inakzeptabler Nebenwirkungen behandelt worden, aber Unterbrechungen von bis zu vier Wochen waren dabei zulässig gewesen. Patienten mit multiplen Tumoren, z. B. aufgrund eines Basalzellkarzinom-Nävus-Syndroms, müssen längerfristig behandelt werden, und hierfür erscheint es sinnvoll, sich intermittierende Therapieprotokolle zu überlegen. In der Phase-II-Studie MIKIE, die Gary Rogers, Beverley, beim ASCO-Kongress vorstellte, wurden zwei solche Regimes randomisiert und doppelblind miteinander verglichen [23]:
229 Patienten mit mindestens sechs Basalzellkarzinomen erhielten Vismodegib in der gängigen Tagesdosis von 150 mg entweder für vier 12-Wochen-Zyklen, die jeweils von achtwöchigen Placebo-Phasen unterbrochen wurden (Arm A), oder der erste Zyklus Vismodegib dauerte 24 Wochen, und auf ihn folgten dreimal abwechselnd acht Wochen Placebo und acht Wochen Vismodegib (Arm B). Die Gesamtbehandlungsdauer betrug also in beiden Armen 72 Wochen, und als primärer Endpunkt war die prozentuale Abnahme der Zahl der Einzeltumoren in Woche 73 gegenüber dem Beginn der Therapie definiert.
In Arm A war die Abnahme der Tumorzahl mit 62,1% etwas höher als in Arm B mit 54%. Außerdem hatte sich die Größe von drei vorab bestimmten Zielläsionen in Arm A um 82,9% reduziert, in Arm B nur um 68,8%. Gleichzeitig war bei 65,5% der Patienten in Arm A, aber nur bei 50,4% in Arm B die Zahl der Tumoren um mindestens 50% zurückgegangen. Fast alle Patienten in beiden Armen berichteten über behandlungsbedingte Nebenwirkungen, die aber überwiegend vom Grad 1 oder 2 waren, am häufigsten Muskelspasmen, Dysgeusie und Alopezie. Behandlungsabbrüche waren in Arm A mit 44% seltener als in Arm B (50,4%), 19,8% bzw. 26,5% davon waren durch Nebenwirkungen veranlasst. In beiden Armen fand sich eine klinisch relevante Verbesserung der Lebensqualität.
Beide hier eingesetzten Regimes waren offenbar wirksam, wobei die per Protokoll vorgesehenen Unterbrechungen der Therapie die Wirksamkeit nicht zu beeinträchtigen schienen. Regime A mit den gleichmäßigeren Intervallen scheint numerisch überlegen zu sein, was Ansprechen, aber auch Abbruchrate angeht.Merkel-Zellkarzinom
Das Merkel-Zellkarzinom ist ein seltener, aber äußerst aggressiver Hauttumor. Fortgeschrittene Tumoren zeigen zwar ein Ansprechen auf Chemotherapie, das aber im Median kaum viel länger als drei Monate dauert. Hauptrisikofaktoren für Merkel-Zellkarzinome sind UV-Strahlung und das Merkel-Zell-Polyomavirus; letzteres scheint bei etwa vier von fünf Tumoren eine Rolle zu spielen. Weil er häufiger bei immunsupprimierten Patienten vorkommt und dort eine schlechtere Prognose hat, gilt dieser Tumor schon lange als immunogen. Nachdem dort oft PD-1- und PD-L1-Antigene gefunden werden, bot sich ein Versuch mit Immuncheckpoint-Inhibitoren an, die diesen Kontrollmechanismus der zellulären Immunität blockieren können.
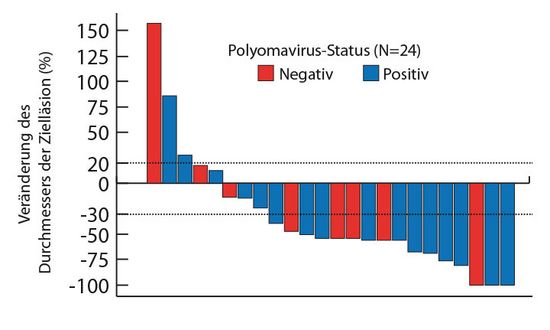
In einer kürzlich publizierten US-amerikanischen Phase-II-Studie wurden bei Patienten mit fortgeschrittenen Merkel-Zellkarzinomen, die vorher keine systemische Therapie erhalten hatten, Ansprechraten zwischen 44% und 62% auf den PD-1-Antikörper Pembrolizumab gefunden (Abb. 2; [24]). In der ebenfalls amerikanischen Phase-II-Studie JAVELIN Merkel 200, die Howard Kaufman, New Brunswick, in Chicago vorstellte, wurde hingegen der PD-L1-Antikörper Avelumab verwendet [25]. Die 88 Patienten waren vorbehandelt, ein Drittel von ihnen hatte bereits mehr als eine Therapie bekommen. Von 61 Patienten, die über mindestens 24 Wochen beobachtet werden konnten, erlebten 18 (29,5%) eine Remission, davon waren sechs (9,8%) Komplettremissionen. 15 der 18 Remissionen dauern an, zum Teil seit deutlich über einem Jahr. Avelumab war gut verträglich – es gab keine Nebenwirkungen vom Grad 4.
Beide Studien zeigen, dass die Behandlung mit Checkpoint-Inhibitoren beim metastasierten Merkel-Zellkarzinom eine vielversprechende Strategie sein könnte, die aber sicherlich weitergehender Studien bedarf.
Literatur
1. Ribas A et al. Lancet Oncol 2015; 16: 908-18.
2. Robert C et al. N Engl J Med 2015; 372: 2521-32.
3. Robert C et al. ASCO 2016, Abstract #9503.
4. Schadendorf D et al. J Clin Oncol 2015; 33: 1889-94.
5. Schachter J et al. ASCO 2016, Abstract #9504.
6. Daud A et al. ASCO 2016, Abstract #9513.
7. Larkin J et al. N Engl J Med 2015; 373: 23-34.
8. Wolchock JD et al. ASCO 2016, Abstract #9505.
9. Long GV et al. ASCO 2016, Abstract #9506.
10. Postow MA et al. N Engl J Med 2015; 372: 2006-17.
11. Hodi FS et al. ASCO 2016, Abstract #9518.
12. Weber JS et al. ASCO 2016, Abstract #9517.
13. Weber JS et al. Lancet Oncol 2016; 17: 943-55.
14. Hassel JC et al. ASCO 2016, Abstract #9558.
15. Ribas A et al. Lancet Oncol 2015; 16: 908-18.
16. Munhoz RR et al. ASCO 2016, Abstract #9516.
17. Tsai KK et al. ASCO 2016, Abstract #9507.
18. Grob JJ et al. ASCO 2016, Abstract #9534.
19. Daud A et al. ASCO 2016, Abstract #9510.
20. Kalinsky K et al. ASCO 21016, Abstract #9501.
21. Dummer R et al. ASCO 2016, Abstract #9500.
22. Ribas A et al. ASCO 2016, Abstract #3014.
23. Rogers G et al. ASCO 2016, Abstract #9509.
24. Nghiem PT et al. N Engl J Med 2016; 374: 2542-52.
25. Kaufman H et al. ASCO 2016, Abstract #9508.

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstraße 911/Thalkirchner Straße 48
80337 München
+49 89 4400-0

