Multiples Myelom: CD38-Antikörper neu zugelassen
Die Onkologie und in diesem Kontext v. a. die Hämatologie ist das medizinische Fachgebiet, in dem es in den letzten Jahren wohl die meisten therapeutischen Innovationen gab. Beim Multiplen Myelom wurde der Anti-CD38-Antikörper Daratumumab als neues Therapieprinzip eingeführt. Wichtige Ergebnisse dazu wurden bereits beim Kongress der American Society of Hematology (ASH) Ende Dezember 2015 in Orlando gezeigt; 2016 haben sie zur Zulassung von Daratumumab als erster Antikörper für die Myelom-Therapie geführt.
Daratumumab (Darzalex®) hat einen neuartigen Wirkmechanismus, so Hartmut Goldschmidt, Heidelberg: Aufgrund der Expression des CD38-Antigens auf Myelomzellen wirkt der Antikörper zytotoxisch, indem er an das Antigen bindet und die Zellen dadurch für zytotoxische Immunzellen markiert. Regulatorische T-Lymphozyten tragen ebenfalls CD38; sie bremsen zytotoxische T-Zellen, werden aber in dieser Funktion durch Daratumumab behindert.
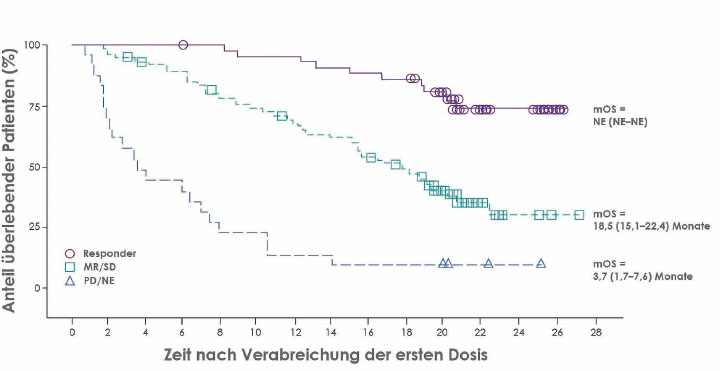
Basis der Zulassung des Antikörpers zur Behandlung mehrfach vorbehandelter erwachsener Myelom-Patienten waren die Phase-I/II-Studie GEN501 [1] und die PHASE-II-Studie MMY2002 (SIRIUS; [2]), so Hermann Einsele, Würzburg, bei der Zulassungspressekonferenz. Die stark vorbehandelten Patienten erzielten eine Gesamtansprechrate von 31% und eine mediane Gesamtüberlebenszeit von 20,1 Monaten. Das Ergebnis war umso besser, je besser das Ansprechen, so Einsele: Bei Patienten mit mindestens einer partiellen Remission ist der Medianwert des Überlebens nach zwei Jahren noch nicht erreicht, bei denen mit geringem Ansprechen oder Krankheitsstabilisierung liegt er bei 18,5 Monaten, und bei den Patienten, die überhaupt nicht auf den Antikörper reagierten, bei 3,7 Monaten (Abb.).
Der Antikörper ist sehr sicher: Nebenwirkungen vom Grad 3 oder höher waren selten und bestanden v. a. aus Zytopenien (Anämie 17,6%, Thrombozytopenie 14,2%, Neutropenie 10,1%). 48% der Patienten zeigten (fast ausschließlich bei der ersten Gabe) infusionsbedingte Reaktionen, die nie vom Grad 4 waren und bei keinem Patienten zu einem Therapieabbruch führten. Der Antikörper wird in einer Dosierung von 16 mg/kg i. v. infundiert, die ersten acht Dosen im Wochenabstand und weitere acht Dosen in zweiwöchigem Abstand; im Anschluss daran wird bis zum Auftreten einer Progression alle vier Wochen behandelt.
Die derzeitige Zulassung gilt für eine Daratumumab-Monotherapie, aber beim diesjährigen ASCO- und EHA-Kongress wurden die ersten Ergebnisse zweier Phase-III-Studien vorgestellt, in denen Daratumumab mit dem Proteasominhibitor Bortezomib und Dexamethason (DVd; CASTOR-Studie [4]) bzw. mit dem Immunmodulator Lenalidomid und Dexamethason kombiniert worden war (DRd; POLLUX-Studie [5]). In beiden Studien war die Dreier- der jeweiligen Zweierkombination beim progressionsfreien Überleben deutlich und hochsignifikant überlegen – mit einer Hazard Ratio von 0,39 (p < 0,0001) in der CASTOR- und 0,37 (p < 0,0001) in der POLLUX-Studie. Auch die progressionsfreie Zeit und Ansprechraten verbesserte der Antikörper deutlich: So wurde etwa in der CASTOR-Studie der Anteil der Patienten mit sehr guter partieller Remission von 29% auf 59% und derer mit Komplettremissionen von 9% auf 19% verdoppelt. Für vorbehandelte Patienten, die bisher lediglich die Zweierkombination (Vd oder Rd) erhalten hätten, wird die Dreierkombination mit dem CD38-Antikörper künftig einen neuen Therapiestandard darstellen [4, 5].
Josef Gulden
Literatur
1. Lokhorst HM et al. N Engl J Med 2015; 373: 1207-19.
2. Lonial S et al. Lancet 2016; 387: 1551-60.
3. Usmani S et al. Blood 2016; 128: 37-44.
4. Palumbo A et al. ASCO 2016, Abstract #LBA4.
5. Dimopoulos MA et al. EHA 2016, Abstract #LB2238.
Presseworkshop „Janssen in der Hämatologie: Neue Daten vom ASH zu aktuellen und zukünftigen zielgerichteten Therapien maligner Neoplasien“ in Frankfurt/Main am 27.1.2016, und Launch-Pressekonferenz „Darzalex® – gute Aussichten für Myelompatienten in Frankfurt/Main am 16.6.2016, veranstaltet von Janssen-Cilag GmbH, Neuss.

