Ovarialkarzinom – Diagnostik, operative und systemische Therapiekonzepte
Das Ovarialkarzinom ist die zweithäufigste tödliche gynäkologische Krebserkrankung der Frau. Screening-Programme haben bisher nicht vermocht, die Mortalität zu senken. Entscheidend für die Therapiesteuerung ist ein möglichst genaues Staging, das sich nur operativ adäquat durchführen lässt. Eine möglichst komplette zytoreduktive chirurgische Therapie zählt zu den wichtigsten Prognosefaktoren und sollte von erfahrenen Gynäko-Onkologen durchgeführt werden. In frühen Stadien ist eine adjuvante Carboplatin-basierte Chemotherapie vorteilhaft, in fortgeschrittenen Stadien stellt sie in Kombination mit Paclitaxel den Standard in der Erstlinie dar, gegebenenfalls ergänzt um den anti-angiogenen Antikörper Bevacizumab. Bei der Rezidivtherapie ist zwischen Platin-sensitiven und Platin-resistenten Rezidiven zu unterscheiden: Für erstere stehen heute neben der Chemotherapie Bevacizumab, Trabectedin und bei Vorliegen einer BRCA-Mutation Olaparib zur Verfügung, für die Platin-resistenten Rezidive Bevacizumab in Kombination mit einer Monochemotherapie.
Das Ovarialkarzinom ist in Deutschland die sechsthäufigste bösartige Erkrankung der Frau und nach dem Mammakarzinom die häufigste tödliche gynäkologische Krebserkrankung. Die Erkrankungsraten steigen bis zum 85. Lebensjahr kontinuierlich an; nur 5–10% aller Erkrankungen betreffen jüngere Frauen (vor dem 45. Lebensjahr), das Lebenszeitrisiko insgesamt liegt bei 1,5%, d. h. etwa eine von 67 Frauen wird im Lauf ihres Lebens erkranken. Flächendeckende Screening-Maßnahmen haben bisher nicht vermocht, die Sterblichkeit positiv zu beeinflussen; ungefähr drei Viertel aller Fälle werden weiterhin im fortgeschrittenen Stadium entdeckt, und die Prognose ist weiterhin schlechter als bei anderen gynäkologischen Krebserkrankungen: Die 5-Jahres-Überlebensrate für alle Stadien liegt bei 41% [1].
Screeninguntersuchungen nicht zu empfehlen
Ein generelles Screening für das Ovarialkarzinom mit transvaginalem Ultraschall oder Tumormarkern (CA 125) wird wegen der niedrigen Inzidenz der Erkrankung weiterhin nicht empfohlen. Von drei multizentrischen, prospektiv randomisierten Studien, in denen die Wirkung dieser Untersuchungen getestet wurde, konnten die PLCO-Studie (Prostate, Lung, Colorectal and Ovarian Cancer Screening; [2]) und die japanische SCSOCS-Studie (Shizuoka Cohort Study of Ovarian Cancer Screening; [3]) teilweise eine Tendenz zu niedrigeren Tumorstadien in der gescreenten Population, aber keinen signifikanten Nutzen bezüglich des Gesamtüberlebens nachweisen. In der 2015 publizierten UKCTOCS-Studie (UK Collaborative Trial of Ovarian Cancer Screening; [4]) wurde eine Reduktion der Mortalität erst im längeren Verlauf nach 7–14 Jahren gefunden. Beim Einsatz eines speziellen Algorithmus (transvaginaler Ultraschall erst bei auffälligen CA 125-Werten) war der Anteil falsch-positiver Ergebnisse im Vergleich zum alleinigen Ultraschall reduziert (1% vs. 3,2%). Obgleich ermutigend, reichen diese Ergebnisse nicht aus, ein generelles Screening zu empfehlen. Gesunde Frauen, die sich trotzdem dazu entschließen, müssen sorgfältig über mögliche Nachteile aufgeklärt werden [5].
Auch ein Screening in Risikopopulationen (s. unten) durch Ultraschall, Tumormarker und/oder gynäkologische Untersuchung war bisher nicht effektiv zur Früherkennung des Ovarialkarzinoms und zur Senkung der Mortalität [z. B. 6].
Diagnostik des Ovarialkarzinoms
Auch bei fortgeschrittenem Ovarialkarzinom sind die Patientinnen oft noch lange Zeit symptomfrei bzw. haben unspezifische Symptome, die nicht unbedingt zur Diagnose eines Ovarialkarzinoms führen, darunter v. a. abdominelle Schmerzen, eine Zunahme des Bauchumfangs, Völlegefühl, Blähungen oder eine Zunahme der Miktionsfrequenz. Treten solche Symptome in Kombination bei über 50-jährigen Patientinnen auf, so sollte das Anlass zu weiteren Untersuchungen sein, bei Verdacht auf einen ovariellen Tumor zunächst eine gynäkologische Untersuchung sowie eine transvaginale Sonografie.
Zum primären Staging ist der transvaginale Ultraschall wegen der eingeschränkten Darstellung des Beckens nur bedingt geeignet, während Computertomografie (CT), Kernspintomografie (MRT) und Positronenemissions-Tomografie (PET) einen Überblick auch über das restliche Abdomen geben. Peritoneale und mesenteriale Aussaat sind auch mit CT und MRT nur eingeschränkt beurteilbar; ein Aszites begründet hier eine Verdachtsdiagnose, die sich am besten mittels FDG-PET erhärten lässt, mit dem sich eine Peritonealkarzinose ebenso wie Lymphknotenmetastasen besser darstellen lassen als mit CT und MRT [7]. Keine apparative Diagnostik kann allerdings ein operatives Staging des Ovarialkarzinom ersetzen, mit dessen Hilfe alleine sich die Operabilität zuverlässig einschätzen lässt.
Bei der Diagnose eines Rezidivs kann man sich auf die Klinik verlassen, weil auch ein früherer Therapiebeginn (z. B. in Abhängigkeit von einem CA 125-Anstieg) keinen Überlebensvorteil bringt [8]. Bei Auftreten von Symptomen ist eine apparative Diagnostik zu empfehlen, wobei die Sensitivität des PET/PET-CTs in der Rezidivdiagnostik mit 90% am höchsten ist [9]. Im Gegensatz zur Einschätzung des IQWiG [10] sehen die Autoren der S3-Leitlinie Ovarialkarzinom bei bestimmten klinischen Konstellationen klare Vorteile von PET bzw. PET/CT für die Patientinnen [5].
Genetik, Prävention und Risikofaktoren
Ein etablierter Risikofaktor für ein Ovarialkarzinom ist die familiäre Häufung bestimmter Tumoren, die dann oft früher auftreten als sporadische Tumoren. In der Gynäkologie spielen v. a. das familiäre Brust- und Eierstockkrebs-Syndrom („hereditary breast ovarian cancer syndrome“, HBOC) und das familiäre nicht-polypöse Kolonkarzinom-Syndrom (HNPCC, „hereditary non-polyposis colorectal carcinoma syndrome“, auch Lynch-Syndrom genannt) eine Rolle. Genetische Veränderungen finden sich beim HBOC meist in den Genen BRCA1 und BRCA2, beim Lynch-Syndrom in den Mismatch-Repair-Genen (MLH1, MSH2, MLH3, MSH6, PMS2). Bestimmte Familienkonstellationen sollten den Verdacht auf das Vorliegen eines HBOC (Tab. 1) oder eines Lynch-Syndroms (Tab. 2) wecken und Anlass sein, der Patientin eine Tumorrisiko-Beratung und gegebenenfalls eine genetische Testung vorzuschlagen.

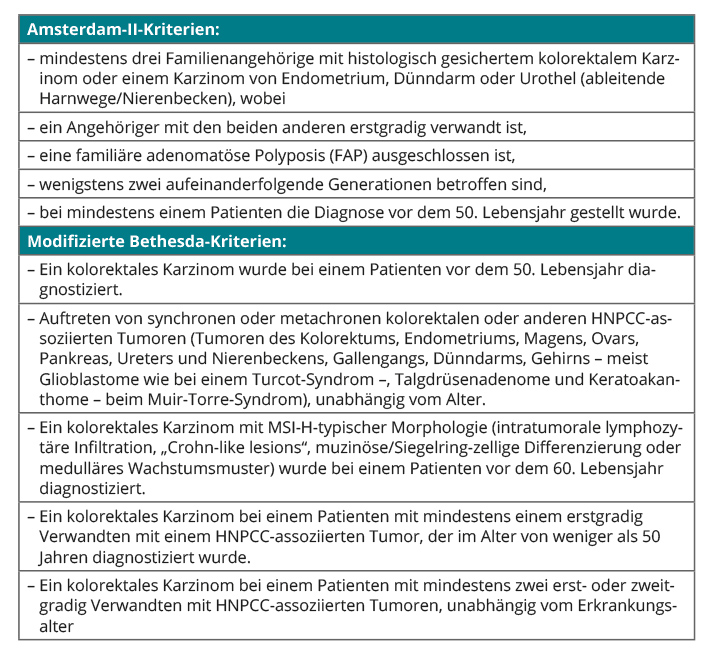
Trägerinnen einer BRCA1-Mutation haben bis zu einem Alter von 70 Jahren ein kumulatives Risiko von 46–65% für Brust- und 39% für Eierstockkrebs, bei Trägerinnen einer BRCA2-Mutation liegt das Mammakarzinom-Risiko bei etwa 45% (wobei die Erkrankung im Mittel später eintritt), das Risiko für ein Ovarialkarzinom bei ungefähr 11% [12]. Rund jedes zehnte Ovarialkarzinom geht auf eine Mutation im BRCA1- oder BRCA2-Gen zurück.
Frauen mit einer Mutation im MSH2- oder MLH1-Gen haben bis zum Alter von 40 Jahren ein Risiko von lediglich ungefähr 1% für ein Ovarialkarzinom, aber bis zum 70. Lebensjahr vervielfacht es sich auf 24% (MSH2) bzw. 20% (MLH1) [13, 14].
Prävention: Bilaterale Salpingo-Oophorektomie (BSO)
Bei Vorliegen einer BRCA-Mutation oder einer anderen nachgewiesenen Risikokonstellation muss eine Patientin über Maßnahmen zur Prävention aufgeklärt werden: Die prophylaktische beidseitige Salpingo-Oophorektomie (BSO) reduziert das Erkrankungsrisiko für ein Ovarial- oder Tubenkarzinom bei Patientinnen mit Mutationen von BRCA1 oder BRCA2 um 80–90% [15]. Bei prämenopausalen Patientinnen sinkt dadurch überdies das Mammakarzinom-Risiko etwa um die Hälfte. Am wirkungsvollsten ist der prophylaktische Eingriff bei Patientinnen mit BRCA1-Mutation ab dem 35.–40., bei Patientinnen mit BRCA2-Mutation ab dem 40.–45. Lebensjahr. Der Eingriff scheint die Lebensqualität nicht zu verschlechtern, und die Angst vor einer Erkrankung nimmt ab. Allerdings verschlechtern sich hormonabhängige Beschwerden und Sexualfunktion [16]. Eine Hormonersatztherapie bis zum Eintreten der natürlichen Wechseljahre (50 Jahre) ist möglich.
Pathologische Diagnostik und Prognosefaktoren
Histologisch finden sich im Ovar sehr heterogene Tumoren – neben dem eigentlichen Ovarialkarzinom und den Borderline-Tumoren zum Beispiel auch peritoneale Karzinome, Keimzelltumoren, Keimstrang-Stromatumoren, und Ovarialmetastasen anderer Primärtumoren
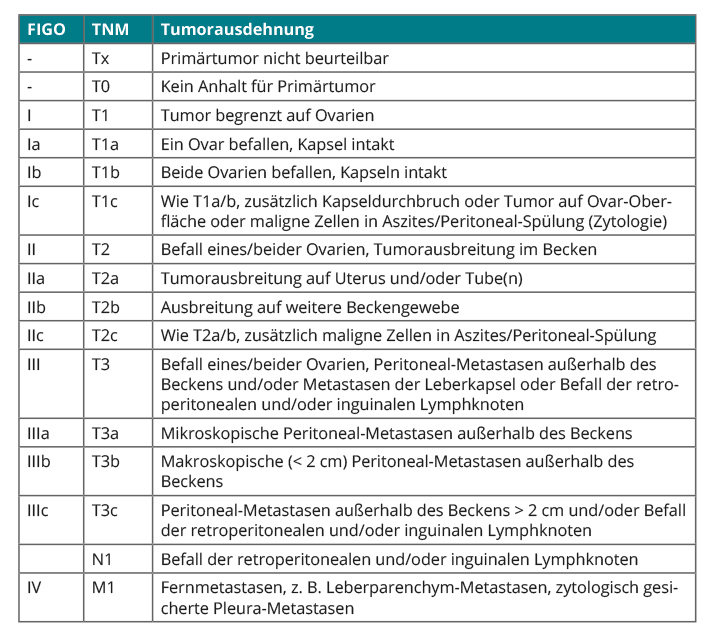
(s. WHO-Klassifikation [17]). Das Ovarialkarzinom, auf das sich diese Übersicht beschränken soll, wird nach der WHO-Klassifikation in seröse, muzinöse, endometroide, klarzellige, transitionalzellige, plattenepitheliale, gemischte sowie undifferenzierte/unklassifizierte Typen eingeteilt. Für das histologische Grading des Ovarialkarzinoms gibt es verschiedene Systeme, am häufigsten werden die Klassifikation der FIGO (International Federation of Gynecology and Obstetrics; [18] und die damit eng verwandte TNM-Klassifikation [19] angewendet (Tab. 3).
Es gibt eine Reihe etablierter Prognosefaktoren beim Ovarialkarzinom [5]:
• Das Tumorstadium, d. h. die präoperative Tumorlast, korreliert ebenso mit einer schlechteren Prognose wie
• der postoperative Tumorrest, d. h. das Ausmaß der chirurgischen Resektion: Eine erfolgreiche makroskopische abdominelle Komplettresektion (egal von welchem Ausgangsstadium) geht mit einem deutlich längeren Überleben einher als ein Tumorrest von 1–10 mm Größe.
• Höheres Alter ist ebenso prognostisch ungünstiger wie ein schlechterer Allgemeinzustand.
• Histologischer Typ: Die Prognose klarzelliger und muzinöser Tumoren ist signifikant ungünstiger als die von serös-papillären und endometrioiden Karzinomen.
• Tumorgrading: Höheres histopathologisches Grading, d. h. stärkere Entdifferenzierung des Tumors geht mit ungünstigerer Prognose einher. Klinisch wirkt sich das nur beim sehr gut differenzierten frühen Ovarialkarzinom (FIGO-Stadium IA, Grading G1) aus, wo man auf eine adjuvante Chemotherapie verzichten kann.
• Die Durchführung einer leitliniengerechten Therapie in gynäkologisch-onkologischen Zentren mit hohen Fallzahlen durch onkologisch qualifizierte Gynäkologen scheint von Vorteil zu sein.
Für andere tumorbiologische Marker gibt es keine Daten, die eine Anwendung in der Klinik rechtfertigen könnten, ebenso wenig für Genom- und Proteom-Analysen, die allerdings für die Zukunft großes Potenzial haben dürften: Vor allem die Tumorgenetik verspricht neue Erkenntnisse zur Biologie des Ovarialkarzinoms und zu neuen, stärker personalisierten Therapieansätzen.
Operative Therapie des frühen Ovarialkarzinoms
Bei gut jeder vierten Patientin wird das Ovarialkarzinom erstmals in einem frühen, auf das Becken beschränkten Stadium (FIGO I oder IIA) diagnostiziert. Auch in solchen frühen Stadien ist ein umfassendes operatives Staging zwingend erforderlich, weil der Nachweis weiterer, radiologisch nicht erkennbarer Tumormanifestationen zu einem Upstaging führen würde, das die Therapiestrategie grundlegend beeinflusst. Ein optimales Staging soll laut der Konsensus-basierten Empfehlung in der S3-Leitlinie folgende Operationsschritte umfassen [5]:
• eine Längsschnitt-Laparotomie,
• die Inspektion und Palpation der gesamten Abdomenhöhle,
• eine Peritoneal-Zytologie,
• Biopsien von allen auffälligen Stellen,
• Peritoneal-Biopsien auch aus unauffälligen Bereichen,
• die beidseitige Adnex-Exstirpation, sofern nicht bei jüngeren Patientinnen die Option einer Fertilitätserhaltung offengehalten werden soll,
• die Hysterektomie dito,
• die Omentektomie infragastrisch, mindestens infrakolisch,
• bei muzinösem/unklarem Tumortyp eine Appendektomie sowie
• die systematische beidseitige Lymphonodektomie pelviner und paraaortaler Lymphknoten der Paraaortal-, Parakaval- und Inter-Aortokaval-Region sowie der Vasa iliaca communis, externa und interna, in der Fossa obturatoria und präsakral. Die kraniale Grenze bildet der Nierengefäß-Stiel, die kaudale Grenze das Leistenband.
Wird bei Patientinnen mit frühem Ovarialkarzinom ein komplettes operatives Staging durchgeführt, so bessern sich dadurch progressionsfreies (79% vs. 61%) und Gesamtüberleben nach fünf Jahren (89% vs. 71%), wie in einer großen Studie der European Organization for Research and Treatment of Cancer (EORTC) gezeigt werden konnte [20]).
Management inkomplett operierter früher Tumoren
Ist ein operatives Staging nicht möglich, weil ein Ovarialkarzinom zum Beispiel unerwartet bei einer anderen Operation im Abdomen entdeckt wird, so sollte auf jeden Fall eine histologische Sicherung des Tumors erfolgen und das Staging in einer weiteren Operation nachgeholt werden. In vielen Fällen werden hierbei weitere Tumorreste gefunden, deren Entfernung die Prognose deutlich verbessert.
Fertilitätserhalt
Zum Fertilitäts-erhaltenden Vorgehen beim frühen Ovarialkarzinom gibt es bisher keine randomisierten Studien, lediglich Daten aus kleinen Kohortenstudien legen eine erhöhte Rezidivrate nahe [21]. Unter der Voraussetzung eines adäquaten operativen Stagings kann man bei unilateralen serösen, muzinösen oder endometroiden Ovarialkarzinomen im Stadium FIGO IA, Grad 1 (und eventuell Grad 2) unter Erhaltung der Fertilität operieren, möglicherweise sogar im Stadium FIGO IC, Grad 1. Die Patientinnen sollten in jedem Fall darüber aufgeklärt werden, dass je nach den vorliegenden Prognosefaktoren bei einem solchen Vorgehen das Rezidivrisiko erhöht ist, und sich einer engmaschigen Nachsorge unterziehen.
Endoskopische Operationsverfahren
Ob laparoskopische den offenen Operationsverfahren beim frühen Ovarialkarzinom gleichwertig sind, wurde bislang nicht in kontrollierten randomisierten Studien untersucht. Auch wenn das komplett laparoskopische Staging eines frühen Ovarialkarzinoms technisch möglich erscheint, kann man es laut einer Cochrane-Analyse nicht empfehlen, weil die Exploration des gesamten Abdomens hierbei deutlich schwieriger ist als bei offener Operation [22].
Operative Therapie des fortgeschrittenen Ovarialkarzinoms
Das bisher Gesagte legt nahe, dass auch beim fortgeschrittenen Ovarialkarzinom die Prognose stark von der Vollständigkeit der operativen Entfernung von Tumorresten abhängt. Nach einer Metaanalyse von klinischen Phase-III-Studien mit über 3.000 Patientinnen kann eine erfolgreiche makroskopische Komplettresektion bei Tumoren im Stadium FIGO IIB–IIIB die mediane Gesamtüberlebenszeit um rund fünf Jahre verlängern; im Stadium FIGO IIIC sind es noch 47 Monate und selbst im Stadium FIGO IV immerhin noch 30 Monate [23]. Verbleiben Tumorresiduen von höchstens 1 cm Durchmesser, so ist der mediane Überlebensvorteil gegenüber einem Resttumor von mehr als 1 cm zwar immer noch signifikant (im Stadium FIGO IIB-IIIB ca. elf Monate, im Stadium FIGO IIIC ca. fünf Monate und im Stadium FIGO IV ca. zwei Monate), aber im Vergleich zu einer Komplettresektion deutlich geringer. Eine makroskopische Tumorfreiheit erreichen gynäkologische Onkologen häufiger als nicht gynäkologisch spezialisierte Operateure [24].
Dass eine systematische Lymphonodektomie mit einem Überlebensvorteil einhergeht, erscheint beim fortgeschrittenen Ovarialkarzinom bisher lediglich aufgrund retrospektiver Studien wahrscheinlich [25]. Für Patientinnen, bei denen intraabdominal Tumorfreiheit erreicht wurde und die Lymphknoten makroskopisch unauffällig sind, wird die Rolle der Lymphknoten-Entnahme zurzeit in der internationalen randomisierten LION-Studie unter Federführung der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) überprüft [26].
Multiviszerale Resektionen
Multiviszerale Resektionen, bei denen gleichzeitig mit den Genitalorganen etwa Teile des Darms oder Oberbauchorgane wie Milz, Leber oder Pankreas operiert werden, sind angezeigt, wenn makroskopische Tumorfreiheit nur so erreichbar ist. Eine Darmresektion kann auch bei nicht möglicher Komplettresektion als palliative Maßnahme indiziert sein, etwa wenn dadurch eine Darmobstruktion beseitigt werden kann. Prospektiv randomisierte Studien gibt es dazu nicht, aber Metaanalysen von Kohortenstudien und Fallserien weisen auf eine Verlängerung des Überlebens durch radikales operatives Vorgehen hin [27]. Bei umfangreichen multiviszeralen Eingriffen empfiehlt sich die interdisziplinäre Zusammenarbeit etwa mit Viszeralchirurgen, Urologen, Gefäß- und/oder Thoraxchirurgen.
Inadäquat operiertes primäres Ovarialkarzinom
Wird ein fortgeschrittenes Ovarialkarzinom zufällig, etwa bei einer Operation aus anderen Gründen, entdeckt und fehlt bei diesem Eingriff die gynäko-onkologische Expertise, so sollte man lediglich eine histologische Sicherung und eine möglichst präzise Dokumentation der Ausbreitung anstreben und die Operation beenden, um die definitive Behandlung möglichst bald in einem gynäko-onkologisch versierten Zentrum nachzuholen.
OP-Zeitpunkt und präoperative Chemotherapie
Ob man bei fortgeschrittenem Ovarialkarzinom sofort operieren oder eine neoadjuvante Chemotherapie vorschalten sollte, wurde lange Zeit kontrovers diskutiert, aber mittlerweile ist klar, dass ein primäres operatives Debulking das Vorgehen der Wahl ist. Am eindrucksvollsten wurde das durch eine große randomisierte Studie der European Organisation for Research and Treatment of Cancer (EORTC) bestätigt, in der 632 Patientinnen mit Ovarialkarzinom der Stadien FIGO IIIC und IV randomisiert entweder primär operiert wurden und dann sechs Zyklen einer Carboplatin-haltigen Therapie (meist in Kombination mit Paclitaxel) oder zunächst drei Zyklen Chemotherapie erhielten, dann operiert wurden und anschließend die restlichen drei Zyklen bekamen [28]. Zwar gelang bei den neoadjuvant chemotherapierten Patientinnen signifikant häufiger eine makroskopische Komplettresektion, aber beim Gesamtüberleben unterschieden sich beide Arme nicht. Hingegen war eine makroskopische Tumorfreiheit mit einem signifikant längeren Überleben assoziiert, wenn sie durch die primäre Operation erreicht wurde. Hinsichtlich der Lebensqualität unterschieden sich die Patientinnen in beiden Gruppen nicht, aber in Zentren mit einer guten Compliance bezüglich der Lebensqualität waren sowohl die Komplettresektionsraten als auch die Überlebenszeiten signifikant besser [29]. In einer Subgruppenanalyse zeigte sich ein Überlebensvorteil für die primäre Operation bei Patientinnen mit Tumoren im Stadium FIGO IIIC und geringer Metastasierung, während Patientinnen im Stadium FIGO IV mit ausgedehnter Metastasierung von der vorgeschalteten Chemotherapie zu profitieren schienen [30].
Für eine Second-Look Operation zum Nachweis eventueller Tumorresiduen nach Chemotherapie gibt es keine Indikation, weil das allenfalls prognostische Aussagen ermöglicht, bisher dafür aber keine Verbesserung der Prognose nachgewiesen wurde.
Systemische Therapie
Frühes Ovarialkarzinom
Die Rolle einer adjuvanten, platinhaltigen Chemotherapie beim frühen Ovarialkarzinom wurde in den zwei großen randomisierten Studien ICON 1 [31] und ACTION [32] untersucht. Ergibt sich bei einem adäquaten operativen Staging ein Tumor des Stadiums FIGO IA, Grad 1, so ist keine adjuvante Chemotherapie erforderlich. Hingegen profitierten Patientinnen mit den FIGO-Stadien I-IIA (außer Stadium IA, Grad 1) in einer gepoolten Analyse der beiden Studien von einer platinhaltigen Chemotherapie nach fünf Jahren mit einer Gesamtüberlebensrate von 82% versus 75% und einer progressionsfreien Überlebensrate von 76% versus 65% [33]. Der Nutzen steigt offenbar mit dem Stadium an. Eine adjuvante Chemotherapie sollte Carboplatin enthalten und möglichst über sechs Zyklen gegeben werden. Dabei ist eine Monotherapie mit dem besser verträglichen Carboplatin (AUC 5) vorzuziehen, weil ein Vorteil einer Kombinationstherapie bisher nicht prospektiv und randomisiert nachgewiesen worden ist.
Fortgeschrittenes Ovarialkarzinom
Primärtherapie des fortgeschrittenen Ovarialkarzinoms
Im Gegensatz zum frühen Ovarialkarzinom stellen bei fortgeschrittenen Stadien sechs Zyklen einer Kombination aus Carboplatin (AUC 5) und Paclitaxel (175 mg/m2 über 3 Stunden i. v.) im Anschluss an die Operation den Standard dar. In einer Metaanalyse konnte die Überlegenheit der Kombination gegenüber einer Platin-Monotherapie bezüglich des progressionsfreien ebenso wie des Gesamtüberlebens bestätigt werden [34]. Carboplatin ist bei gleicher Wirksamkeit und besserer Verträglichkeit Cisplatin vorzuziehen [35], Paclitaxel und Docetaxel sind ebenfalls äquipotent [36].
Da die ovariellen Tumoren gut durchblutet sind, wurde der gegen den vaskulären endothelialen Wachstumsfaktor (VEGF) gerichtete Antikörper Bevacizumab hier ebenfalls in Kombination mit der Chemotherapie und danach für zwölf bis 15 Monate als Erhaltungstherapie getestet und bewirkte in zwei Phase-III-Studien, der GOG-0218- und der ICON7-Studie, eine signifikante Verlängerung des progressionsfreien Überlebens [37, 38]. Daten zum Gesamtüberleben liegen bisher nicht vor.
Systemische Rezidivtherapie
Wird ein Rezidiv eines Ovarialkarzinoms diagnostiziert, so ist für die weitere therapeutische Strategie entscheidend, ob es platinsensitiv, d. h. mehr als sechs Monate nach Ende einer platinhaltigen Chemotherapie aufgetreten ist, oder ob es eine Resistenz gegenüber Platin zeigt, d. h. ob weniger als sechs Monate nach der platinhaltigen Therapie vergangen sind: Beim platinsensitiven Rezidiv ist das Ziel der weiteren Therapie eindeutig eine Verlängerung von progressionsfreiem bzw. Gesamtüberleben der Patientin, während beim platinresistenten Rezidiv eine eher palliative Zielsetzung mit Symptomkontrolle und Erhalt der Lebensqualität in den Vordergrund tritt.
Platin-resistentes Rezidiv
Bei Platin-resistenten Rezidiven (zu denen auch die Platin-refraktären, d. h. innerhalb von vier Wochen nach Ende der platinhaltigen Therapie auftretenden Rezidive zählen), verbietet sich die Wiederholung einer platinhaltigen Chemotherapie. Man kann hier eine Monochemotherapie geben, z. B. Topotecan oder pegyliertes liposomales Doxorubicin [39], bei Taxan-naiven Patientinnen auch Paclitaxel [40]. In der Phase-III-Studie AURELIA konnte die Zugabe des Anti-VEGF-Antikörpers Bevacizumab zu einer Monotherapie mit wöchentlich gegebenem Paclitaxel, pegyliertem liposomalem Doxorubicin oder Topotecan Ansprechraten und progressionsfreies Überleben [41] ebenso wie die von den Patientinnen selbst bewerteten Lebensqualitätsparameter signifikant verbessern [42]. Das galt für alle Chemotherapien, beim Gesamtüberleben war hingegen kein Vorteil von Bevacizumab zu erkennen [43]. Bevacizumab ist zugelassen in dieser Indikation, wenn die Patientin vorher keine gegen VEGF oder seinen Rezeptor gerichteten Medikamente erhalten hat.
Platin-sensitives Rezidiv
Patientinnen mit Platin-sensitivem Rezidiv sollten wieder eine platinhaltige Kombination erhalten. In Betracht kommen folgende Kombinationen, die in randomisierten Studien besser als die jeweiligen Vergleichstherapien abschnitten: Carboplatin in Kombination mit Gemcitabin [44], pegyliertem liposomalem Doxorubicin [45] oder Paclitaxel [46].
Bevacizumab, zusätzlich zu einer Chemotherapie mit Carboplatin und Gemcitabin gegeben, konnte in der-Phase-III-Studie OCEANS die Ansprechrate erhöhen und das progressionsfreie Überleben von median 8,4 auf 12,4 Monate (Hazard Ratio 0,484; p < 0,0001; [47]), nicht aber das Gesamtüberleben signifikant verlängern [48]. Es ist für diese Indikation zugelassen, wenn die Patientin vorher keine am VEGF-Signalweg angreifenden Medikamente erhalten hat.
In einer Phase-III-Studie zeigte sich die Kombination von pegyliertem liposomalem Doxorubicin mit dem aus einem Meeresorganismus gewonnenen Zytostatikum Trabectedin der Monotherapie mit dem Anthrazyklin überlegen, was progressionsfreies Überleben und Ansprechen betraf [49]. In der Subgruppe von Patientinnen mit partiell Platin-sensitivem Rezidiv (Rezidiv zwischen sechs und zwölf Monaten nach Ende der Chemotherapie) war dieser Vorteil besonders ausgeprägt mit einer Verlängerung des progressionsfreien Überlebens von median 5,5 auf 7,4 (HR 0,65; p = 0,0152) und des Gesamtüberlebens von 17,1 auf 23,0 Monate (HR 0,59; p = 0,0015; [50]).
Ein neues Therapieprinzip, das vor Kurzem erstmals beim Platin-sensitiven Ovarialkarzinom mit BRCA-Mutation eingeführt wurde, ist die Hemmung der humanen Poly(ADP-ribose)-Polymerasen (PARP-1, PARP-2 und PARP-3). Diese Enzyme sind an der Reparatur von DNA-Einzelstrangbrüchen beteiligt. Hemmt man diesen Mechanismus durch spezifische PARP-Inhibitoren, so kommt es in replizierenden Zellen zu Doppelstrangbrüchen. In intakten Zellen kann dieser Schaden durch homologe Rekombination repariert werden, wofür jedoch intakte BRCA1- und BRCA2-Proteine erforderlich sind. Liegen hingegen Mutationen im BRCA1- oder BRCA2-Gen vor (in der Keimbahn oder im Tumor), die die Funktion der Proteine beeinträchtigen, können PARP-Inhibitoren wie Olaparib die Reparatur effizient unterbinden, und die Zellen gehen durch Akkumulation von DNA-Schäden zugrunde.
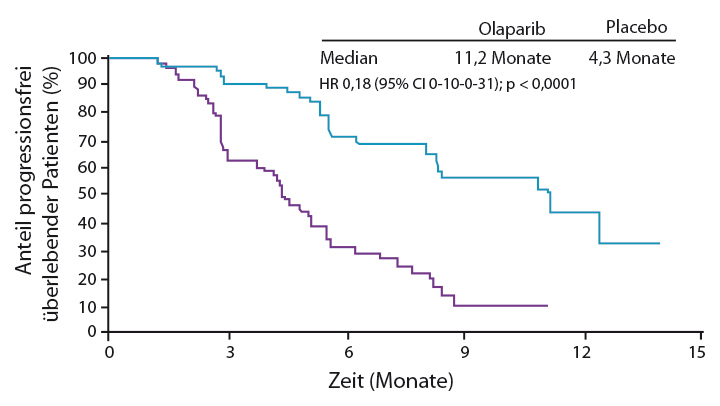
Olaparib wurde in einer randomisierten Phase-II-Studie als Erhaltungstherapie (400 mg zweimal täglich) gegen Placebo bei Patientinnen mit Platin-sensitivem rezidivierendem high-grade serösem Ovarialkarzinom, Eileiterkarzinom oder primärem Peritonealkarzinom getestet, die zuvor mindestens zwei platinhaltige Therapien erhalten hatten [51]. Primärer Endpunkt war das progressionsfreie Überleben, das unter der Olaparib-Erhaltungstherapie deutlich von median 4,8 auf 8,4 Monate verlängert werden konnte (HR 0,35; p < 0,00001). In einer vorab geplanten Subgruppenanalyse profitierten besonders Patientinnen mit BRCA-mutiertem Ovarialkarzinom, bei denen sich das progressionsfreie Überleben von median 4,3 auf 11,2 Monate beinahe verdreifachte (HR 0,18; p < 0,00001; Abb. 1; [52]). Nicht signifikant verlängert konnte das Gesamtüberleben werden (Median 34,9 vs. 31,9 Monate; HR 0,73; p = 0,19;). Bei den Patientinnen mit BRCA-Mutation lag die Krankheitskontrollrate nach 24 Wochen bei 57% in der Olaparib- und bei 24% in der Placebogruppe.
Operative Rezidivtherapie
Erscheint bei einem Platin-sensitiven Rezidiv eine makroskopische Komplettresektion durch eine weitere Operation möglich, kann man der Patientin eine solche Rezidivoperation anbieten. Bisher gibt es dazu allerdings nur retrospektive Studien und eine Cochrane-Analyse [53]. Prädiktiv für das Erreichen von Tumorfreiheit sind offenbar ein guter Allgemeinzustand, Tumorfreiheit nach der zurückliegenden Primäroperation und das Fehlen eines Aszites im Rezidiv [54]. Zur operativen Therapie beim Platin-resistenten Rezidiv gibt es keine prospektiven Daten.
Literatur
1. Krebs in Deutschland 2011/2012. 10. Ausgabe. Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg). Berlin, 2015.
2. Buys SS et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal andOvarian(PLCO)Cancer Screening Randomized Controlled Trial. JAMA 2011; 305: 2295–303.
3. Kobayashi H et al. et al. A randomized study of screening for ovarian cancer: A multicenter study in Japan. Int J Gynecol Cancer 2008; 18: 414–20.
4. Jacobs IJ et al. Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): A randomized controlled trial. Lancet 2016; 387: 945-56.
5. AWMF, Deutschen Krebsgesellschaft e.V. und Deutschen Krebshilfe e.V. S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren. Version 1.0, 2013.
6. van der Velde NM et al. Time to stop ovarian cancer screening in BRCA1/2 mutation carriers? Int J Cancer 2009; 124: 919-23.
7. Yuan Y et al. Computer tomography, magnetic resonance imaging, and positron emission tomography or positron emission tomography/computer tomography for detection of metastatic lymph nodes in patients with ovarian cancer: A meta-analysis. Eur J Radiol 2012; 81: 1002-6.
8. Rustin GJ et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): A randomised trial. Lancet 2010; 376: 1155-63.
9. Gu P et al. CA 125, PET alone, PET-CT, CT and MRI in diagnosing recurrent ovarian carcinoma: A systematic review and meta-analysis. Eur J Radiol 2009; 71: 164-74.
10. IQWIG. Positronenemissionstomographie (PET) und PET/CT bei Ovarialkarzinom. 2011.
11. Kast K, Arnold N. Gendiagnostik bei familiären Tumoren. Der Gynäkologe 2012; 45: 28-34.
12. Eccles DM et al. Selecting patients with ovarian cancer for germline BRCA mutation testing: Findings from guidelines and a systematic literature review. Adv Ther 2016; 33: 129-50.
13. Bonadona V et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. J Am Med Ass 2011; 305: 2304-10.
14. Dreyer G. Screening for gynaecologic cancers in genetically predisposed women. Best Pract Res Clin Obstet Gynaecol 2012; 26: 267-82.
15. Finch A et al. Salpingo-oophorectomy and the risk of ovarian, fallopian tube, and peritoneal cancers in women with a BRCA1 or BRCA2 Mutation. J Am Med Ass 2006; 296: 185-92.
16. Madalinska JB et al. Quality-of-life effects of prophylactic salpingo-oophorectomy versus gynecologic screening among women at increased risk of hereditary ovarian cancer. J Clin Oncol 2005; 23: 6890-8.
17. WHO, Classification of Tumours. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Third Edition ed. 2003.
18. Classification and staging of malignant tumours in the female pelvis. Acta Obstet Gynecol Scand 1971; 50: 1-7.
19. Wittekind C et al. TNM Klassifikation maligner Tumoren. 2010, Wiley-VCH: Weinheim.
20. Trimbos B et al. Surgical staging and treatment of early ovarian cancer: Long-term analysis from a randomized trial. J Natl Cancer Inst 2010; 102: 982-7.
21. Denschlag D et al. Clinical recommendation on fertility preservation in borderline ovarian neoplasm: Ovarian stimulation and oocyte retrieval after conservative surgery. Gynecol Obstet Invest 2010; 70: 160-5.
22. Medeiros LR et al. Laparoscopy versus laparotomy for FIGO Stage I ovarian cancer. Cochrane Database Syst Rev 2008: CD005344.
23. du Bois A et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: A combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d'Investigateurs Nationaux Pour les Etudes des Cancers de l'Ovaire (GINECO). Cancer 2009; 115: 1234-44.
24. du Bois A et al. Variations in institutional infrastructure, physician specialization and experience, and outcome in ovarian cancer: A systematic review. Gynecol Oncol 2009; 112: 422-36.
25. du Bois A et al. Potential role of lymphadenectomy in advanced ovarian cancer: A combined exploratory analysis of three prospectively randomized phase III multicenter trials. J Clin Oncol 2010; 28: 1733-9.
26. clinicaltrials.gov/ct2/show/NCT00712218.
27. Bristow RE et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol 2002; 20: 1248-59.
28. Vergote I et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010; 363: 943-53.
29. Greimel E et al. Quality of life of advanced ovarian cancer patients in the randomized phase III study comparing primary debulking surgery versus neo-adjuvant chemotherapy. Gynecol Oncol 2013; 131: 437-44.
30. van Meurs HS et al. Which patients benefit most from primary surgery or neoadjuvant chemotherapy in stage IIIC or IV ovarian cancer? An exploratory analysis of the European Organisation for Research and Treatment of Cancer 55971 randomised trial. Eur J Cancer 2013; 49: 3191-201.
31. Colombo N et al. International Collaborative Ovarian Neoplasm trial 1: A randomized trial of adjuvant chemotherapy in women with early-stage ovarian cancer. J Natl Cancer Inst 2003; 95: 125-32.
32. Trimbos JB et al. Impact of adjuvant chemotherapy and surgical staging in early-stage ovarian carcinoma: European Organisation for Research and Treatment of Cancer-Adjuvant ChemoTherapy in Ovarian Neoplasm trial. J Natl Cancer Inst 2003; 95: 113-25.
33. Colombo N, Pecorelli S. What have we learned from ICON1 and ACTION? Int J Gynecol Cancer 2003; 13 (Suppl 2): 140-3.
34. du Bois A et al. First line chemotherapy with carboplatin plus paclitaxel in advanced ovarian cancer – a new standard of care? Ann Oncol 1999; 10 (Suppl 1): 35-41.
35. du Bois A et al. A randomized clinical trial of cisplatin/paclitaxel versus carboplatin/paclitaxel as first-line treatment of ovarian cancer. J Natl Cancer Inst 2003; 95: 1320-1329.
36. Vasey PA et al. Phase III randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma. J Natl Cancer Inst 2004; 96: 1682-91.
37. Burger RA et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med 2011; 365: 2473-83.
38. Perren TJ et al. A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 2011; 365: 2484-96.
39. Gordon AN et al. Recurrent epithelial ovarian carcinoma: A randomized phase III study of pegylated liposomal doxorubicin versus topotecan. J Clin Oncol 2001; 19: 3312-22.
40. ten Bokkel Huinink W et al. Long-term survival in a phase III, randomised study of topotecan versus paclitaxel in advanced epithelial ovarian carcinoma. Ann Oncol 2004; 15: 100-3.
41. Pujade-Lauraine E et al: Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: The AURELIA open-label randomized phase III trial. J Clin Oncol 2014; 32: 1302-8.
42. Stockler MR et al. Patient-reported outcome results from the open-label phase III AURELIA trial evaluating Bevacizumab-containing therapy for platinum-resistant ovarian cancer. J Clin Oncol 2014; 43: 1309-16.
43. Poveda AM et al. Bevacizumab combined with weekly paclitaxel, pegylated liposomal doxorubicin, or topotecan in platinum-resistant recurrent ovarian cancer: Analysis by chemotherapy cohort of the randomized phase III AURELIA trial. J Clin Oncol 2015; 33: 3836-9.
44. Pfisterer J et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum-sensitive recurrent ovarian cancer: An intergroup trial of the AGO-OVAR, the NCIC CTG, and the EORTC GCG. J Clin Oncol 2006; 24: 4699-707.
45. Pujade-Lauraine E et al. Pegylated liposomal doxorubicin and carboplatin compared with paclitaxel and carboplatin for patients with platinum-sensitive ovarian cancer in late relapse. J Clin Oncol 2010; 28: 3323-9.
46. Parmar MK et al. Paclitaxel plus platinum-based chemotherapy versus conventional platinum-based chemotherapy in women with relapsed ovarian cancer: The ICON4/AGO-OVAR-2.2 trial. Lancet 2003; 361: 2099-106.
47. Aghajanian C et al. OCEANS: A randomized, double-blind, placebo-controlled phase III trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer. J Clin Oncol 2012; 30: 2039-45.
48. Aghajanian C et al. Final overall survival and safety analysis of OCEANS, a phase 3 trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent ovarian cancer. Gynecol Oncol 2015; 139: 10-6.
49. Monk BJ et al. Trabectedin plus pegylated liposomal doxorubicin in recurrent ovarian cancer. J Clin Oncol 2010; 28: 3107-14.
50. Poveda A et al. Trabectedin plus pegylated liposomal doxorubicin in relapsed ovarian cancer: Outcomes in the partially platinum-sensitive (platinum-free interval 6-12 months) subpopulation of OVA-301 phase III randomized trial. Ann Oncol 2011; 22: 39-48.
51. Ledermann J et al. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med 2012; 366: 1382-92.
52. Ledermann J et al. Olaparib maintenance therapy in patients with platinumsensitive relapsed serous ovarian cancer: A preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol 2014; 15: 852-61.
53. Galaal K et al. Cytoreductive surgery plus chemotherapy versus chemotherapy alone for recurrent epithelial ovarian cancer. Cochrane Database Syst Rev 2010: CD007822.
54. Harter P et al. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: The Multicenter Intergroup Study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO. Int J Gynecol Cancer 2011; 21: 289-95.

Prof. Dr. Marion Kiechle
Frauenklinik im Klinikum rechts der Isar der Technischen Universität München (TUM)
Lehrstuhl für Gynäkologie und Geburtshilfe
Ismaninger Straße 22, 81675 München
+49 89 4140 2420
+49 89 4140 4831
Marion.kiechle[at]lrz.tu-muenchen[dot]de

