Gastrointestinale Stromatumoren
Johanna Falkenhorst, Sebastian Bauer
Gastrointestinale Stromatumoren sind die häufigsten Sarkome des Gastrointestinaltrakts und ganz überwiegend durch aktivierende Mutationen der KIT-Kinase sowie des Rezeptors für Platelet-Derived Growth Factor Typ A (PDGFRA) charakterisiert. Neben der Erhebung klinischer Risikofaktoren ist die Bestimmung des Genotyps essenzieller Bestandteil der Diagnostik. Für verschiedene Mutationen konnte eine unabhängige prognostische Relevanz herausgearbeitet werden, die eine wichtige Ergänzung der bisherigen Risikofaktoren (Zahl der Mitosen, Größe und Primärlokalisation) darstellt. Die Erhebung des Genotyps ist zudem bei Wahl und Dosierung medikamentöser Therapien relevant.
Bislang stehen mit Imatinib, Sunitinib und Regorafenib drei medikamentöse Optionen für die sequenzielle Therapie von GIST zur Verfügung. Wesentlicher Mechanismus für eine Resistenz gegenüber der Imatinib-Therapie stellen sekundäre Mutationen von KIT dar. Salvagetherapien zielen daher auf eine effektivere Inhibition dieses mutierten Rezeptors ab. Neben mutationsspezifischen KIT-Inhibitoren befinden sich dabei auch allosterische Inhibitoren in klinischer Testung. Weitere Therapieansätze richten sich gegen KIT-unabhängige Targets wie den FGF-Rezeptor, MET sowie den RAS/RAF/MAPK- und den PI3K/AKT/mTOR-Signalweg.
Die Behandlung von GIST sollte von Beginn an unter Einbindung spezialisierter Zentren erfolgen.
Schlüsselwörter: Sarkom, GIST, Tyrosinkinaseinhibitoren, Imatinib, KIT, PDGFRA
Gastrointestinale Stromatumoren (GIST) stellen einen Sammelbegriff für mesenchymale Tumoren des Magen-Darm-Traktes dar, die typische Differenzierungsmerkmale der interstitiellen Zellen von Cajal (ICC) aufweisen. Dazu zählt insbesondere die hohe Expression der Rezeptor-Tyrosinkinase KIT.
GIST zählen zu den häufigsten Sarkomen, sind aber mit einer Inzidenz von 1–1,5 Neuerkrankungen pro 100.000 Einwohner jährlich insgesamt dennoch selten [1]. Sehr viel häufiger sind sogenannte Mini-GIST, die meist inzidentell bei Endoskopien oder Autopsien entdeckt werden. Eine systematische Analyse von Gastrektomie-Präparaten ergab, dass sich diese auch als „GISTlets“ bezeichneten Neoplasien in mehr als 20% aller Mägen nachweisen lassen [2]. Interessanterweise zeigen bereits diese kleinen Tumoren schon aktivierende KIT-Mutationen, obgleich nur extrem selten ein behandlungsbedürftiger Befund vorliegt [3].
Das mittlere Erkrankungsalter liegt bei 60 Jahren mit ausgewogener Geschlechterverteilung, wobei GIST bis ins junge Erwachsenenalter auftreten können. Häufigste Primärlokalisationen sind Magen (55,6%) und Dünndarm (31,8%); GIST von Ösophagus, Rektum oder auch extraintestinalen Lokalisationen sind Raritäten [4]. GIST metastasieren unbehandelt nahezu ausschließlich hepatisch und peritoneal. Ossäre, kutane oder muskuläre Metastasen sind meist nur nach langer Vorbehandlung oder bei sehr weit fortgeschrittener Metastasierung nachweisbar [5].
Pathologie
Neben den typischen histomorphologischen Merkmalen von GIST beruht die Diagnostik auf dem immunhistochemischen Nachweis einer hohen Expression von KIT (CD117) und DOG1 [6]. In diagnostischen Grenzfällen kann zudem eine Mutationsanalyse für KIT oder PDGFRA zusätzliche diagnostische Sicherheit bieten. Die Zahl der Mitosen auf einer Fläche von 5 mm² sollte in jedem pathologischen Befund enthalten sein. In älteren Publikationen wird diese Fläche auch mit 50 großen Gesichtsfeldern („High-Power-Fields“ oder HPF) gleichgesetzt – für die es allerdings keinen einheitlichen Größenstandard gibt und die daher nicht mehr verwendet werden sollten. Die Durchführung einer Mutationsanalyse der häufigsten bei GIST mutierten Exone des KIT- (11, 9, 13, 17) und des PDGFRA-Gens (12, 14, 18) gilt als Standard, mit Ausnahme von kleinsten GIST, für die eine medizinische Therapie nicht indiziert ist.
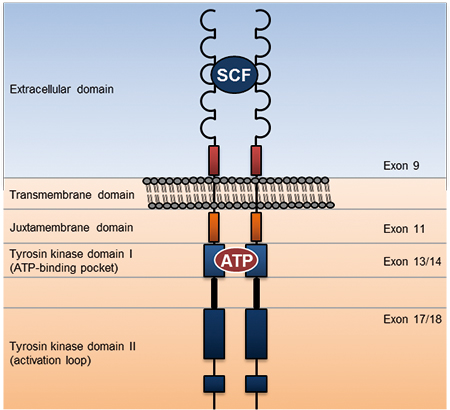
Der ganz überwiegende Anteil (85%) von GIST-Patienten weist sporadische Mutationen der Rezeptor-Tyrosinkinasen c-KIT oder PDGFRA auf [7]. Davon betreffen etwa 60% die juxtamembranöse Domäne von KIT, die durch Exon 11 kodiert wird (Abb. 1) und zu 9% die extrazelluläre Domäne (Exon 9). 7% aller lokalisierten GIST weisen Mutationen im Exon 18 des PDGFRA-Gens auf. Die Mutationen führen zu einer Liganden-unabhängigen Aktivierung des Rezeptors mit konsekutiver Aktivierung des PI3K- sowie des RAS/RAF/MAPK-Signalweges [8]. Während sich Exon-11-Mutationen bei GIST-Primärlokalisationen nachweisen lassen, treten Exon-9-Mutationen fast ausschließlich außerhalb des Magens auf. PDGFRA-Mutationen (D842V) finden sich nahezu ausschließlich im Magen [8].
GIST, bei denen sich keine Mutationen in c-KIT oder PDGFRA nachweisen lassen, wurden bislang irreführend als „Wildtyp-GIST“ bezeichnet, obgleich die Mehrzahl dieser GIST charakteristische genetische Veränderungen aufweist, die sinnvollerweise namensgebend verwendet werden sollten. Bei „SDH-defizienten GIST“ findet sich in 50% der Fälle ein Verlust der Expression verschiedener Succinat-Dehydrogenase-Untereinheiten, die im SDH-Ubiquinon-Komplex eine Komponente des Krebszyklus und der zellulären Atmungskette bilden [9]. SDH-Defizienzen finden sich beim Carney-Stratakis-Syndrom (SDH-Keimbahnmutation) und bei der Carney-Triade (sporadische SDHC-Mutation oder andere genetische Veränderungen). Die exakte Diagnose dieser syndromalen GIST ist von großer Bedeutung für Nachsorge, Vorsorge und genetische Beratung. Patienten sollten daher immer an spezialisierte Zentren angebunden sein. GIST treten auch im Rahmen der Neurofibromatose vom Typ 1 auf (NF1-assoziierte GIST). Auch diese GIST weisen typischerweise keine KIT- oder PDGFRA-Mutationen auf, sondern Keimbahnmutationen des NF1-Gens, die meist noch mit Mutationen im PI3K-Signalweg einhergehen [10]. Im Weiteren finden sich noch selten Mutationen von BRAF, deren Identifizierung therapeutisch bedeutsam sein kann [11].
Diagnose und Klinik
GIST werden aufgrund ihrer Symptom-Armut häufig erst in fortgeschrittenen Erkrankungsstadien diagnostiziert. Späte Symptome sind eine Zunahme des Bauchumfangs (35–70%), Schmerzen (75%), gastrointestinale Blutungen (25–50%), Gewichtsverlust (20%), Obstipation (45%) oder Dysphagie [12]. Einige GIST werden zufällig im Rahmen von Magen- oder Darmspiegelungen diagnostiziert.
Bei Verdacht auf einen GIST sollte eine endoskopische Biopsie erfolgen. Ist dies aufgrund der Primärlokalisation nicht möglich, sollte alternativ eine perkutane Biopsie durchgeführt werden. Eine in Kürze erscheinende Subgruppenanalyse der SSG/AIO-Studie zur adjuvanten Therapie bei GIST ergab keine Hinweise für ein erhöhtes Metastasierungsrisiko infolge einer Biopsie ([13], Eriksson M et al., Eur J Cancer, in press). Insbesondere wenn die Resektion eines Tumors mit erhöhter Morbidität einherzugehen droht, muss eine Biopsie erzwungen werden, um gegebenenfalls präoperative Therapien einsetzen zu können. Aufgrund des nahezu ausschließlich hepatischen und peritonealen Metastasierungsmusters sind ein CT oder MRT des Abdomens sowie ein Röntgen-Thorax für das Staging lokalisierter GIST als ausreichend anzusehen. Lediglich bei Verdacht auf Vorliegen eines syndromalen GIST (z. B. Carney-Komplex) sollte ein CT-Thorax zum Ausschluss pulmonaler Chondrome oder Hamartome durchgeführt werden.
Stadieneinteilung und Prognose
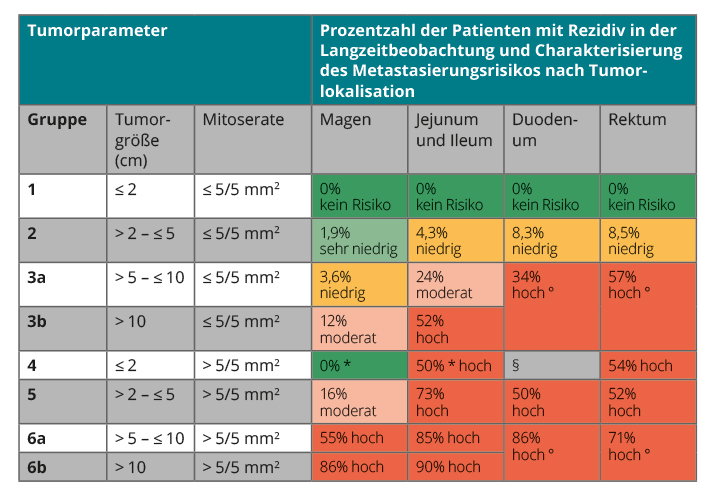
Klinische und histologische Charakteristika stellten bislang die wichtigsten Parameter für die Prognose lokalisierter GIST dar. Die AFIP-Klassifikation (Armed Forces Institute of Pathology) verwendet dabei die Risikofaktoren Primärlokalisation, Mitosezahl (≤ 5 Mitosen vs. > 5 Mitosen/5 mm²) und Tumorgröße [14].
Während diese Klassifikation verlässlich das Risiko mitotisch niedrig-aktiver oder großer Tumoren mit hoher Mitosezahl vorhersagt, ist die Genauigkeit insbesondere bei Tumoren mit einer Mitosezahl um 5/5 mm² ungenau. In diesem Zusammenhang stellen die „Kontur-Karten“ („contour maps“) eine wichtige und im Alltag sehr einfach zu verwendende Verbesserung dar [15]. Basierend auf den Daten von über 2.000 Patienten konnten Joensuu und Mitarbeiter die prognostische Bedeutung der Mitosen herausarbeiten und zudem den Risikofaktor „Tumorruptur“ einarbeiten. Hinsichtlich der Mitosen wird im Gegensatz zur dichotomischen Unterteilung der AFIP-Klassifikation eine Graduierung mithilfe der absoluten Mitosezahlen vorgenommen. Gerade bei kleinen Magentumoren mit hoher Mitosezahl wird die höhere prognostische Trennschärfe deutlich.
Bislang wurde der Mutationsstatus als Risikofaktor nicht in den Klassifikationen berücksichtigt. Zwei unabhängig voneinander durchgeführte Arbeiten konnten jedoch kürzlich die Unterschiede im progressionsfreien und Gesamtüberleben in Abhängigkeit vom Genotyp zeigen. Auch wenn die klinischen Daten (v. a. Mitosezahl und Größe) weiterhin die wichtigsten Prognosefaktoren darstellen, konnte für Patienten, deren Tumoren Deletionen der Kodons 557 und 558 des KIT-Gens aufweisen, ein deutlich erhöhtes Rezidivrisiko nachgewiesen werden [16, 17]. Im Gegensatz dazu scheinen andere KIT-Mutationen, insbesondere Duplikationsmutationen in Exon 11, sowie Mutationen im PDGFRA-Exon 18 mit einer günstigeren Prognose einherzugehen. Gerade für Patienten mit intermediärem Risiko nach klinischen Kriterien kann die Hinzunahme des Genotyps eine wichtige Entscheidungshilfe sein. Wozniak und Kollegen haben diese Beobachtungen in einen neuen Behandlungsalgorithmus integriert, der die existierenden Prognosetafeln ergänzt [16]. Für die nächsten Jahre ist durch die Erhöhung von Patientenzahlen sowie die Integration zusätzlicher genetischer Marker (z. B. Verlust von CDKN2A oder Verlust von Dystrophin) eine weitere Verbesserung in der Prognostizierung lokalisierter GIST zu erwarten.
Therapie lokalisierter GIST
Die kürzlich aktualisierte ESMO-Leitlinie empfiehlt eine adjuvante Therapie mit Imatinib (Dauer drei Jahre) für Patienten mit hohem Rückfallrisiko, während Patienten mit niedrigem Risiko keine Therapie erhalten sollten. Bei Patienten mit intermediärem Risiko besteht Raum für eine gemeinsame Entscheidung („shared decision“) mit dem Patienten.
Grundlage für diese Empfehlungen sind die Ergebnisse der ACOSOG sowie der SSG/AIO-Studie zur adjuvanten Therapie mit Imatinib. Die ACOSOG-Studie randomisierte dabei Patienten mit GIST ab einer Größe von 3 cm auf eine einjährige Behandlung mit Imatinib oder Placebo. Da der Einschluss unabhängig von anderen Risikofaktoren erfolgte, bestand das Studienkollektiv überwiegend aus Patienten mit intermediärem Risiko. Die bisherigen Analysen ergaben eine Verbesserung des rückfallfreien Überlebens, aber keinen Vorteil für das Gesamtüberleben [18, 19], weshalb viele Zentren zurückhaltend mit einer Behandlungsempfehlung bei dieser Risikokonstellation sind.
Im Gegensatz dazu wurden bei der SSG-Studie überwiegend Hochrisiko-Patienten rekrutiert und zudem zwischen ein- und dreijähriger Behandlung randomisiert. Bei der Auswertung fand sich eine Verbesserung nicht nur des rückfallfreien Überlebens um 18%, sondern auch des Gesamtüberlebens um 7%, weshalb die dreijährige Therapie den aktuellen Goldstandard darstellt. Im Jahr 2016 wird zudem eine gemeinsame Studie der SSG/AIO anlaufen, bei der der Stellenwert einer adjuvanten Therapie für fünf Jahre (im Vergleich zu einer dreijährigen Therapie) untersucht wird. Dabei können auch Patienten eingeschlossen werden, bei denen die adjuvante Therapie schon begonnen hat.
Eine kürzlich publizierte Analyse der molekularen Subgruppen der ACOSOG-Studie ergab für Patienten mit „Wildtyp“-GIST und mit Mutationen im Exon 9 von KIT keinen Vorteil in Bezug auf das rückfallfreie Überleben durch die adjuvante Therapie [18]. Vor dem Hintergrund der geringen Aktivität von „Wildtyp“-GIST in der metastasierten Situation erscheint daher eine adjuvante Therapie, v. a. bei den syndromalen GIST (Carney, Carney-Stratakis, NF1), nicht gerechtfertigt.
Die META-GIST Analyse hatte vor einigen Jahren für Patienten mit Mutationen im Exon 9 von KIT und metastasierter Erkrankung einen Vorteil für dosisintensives Imatinib (800 mg/d) ergeben [20]. Die aktuellen ACOSOG-Daten unterstützen nun die Hypothese, dass bei diesen Patienten eine Standarddosierung (400 mg/d Imatinib) keinen Vorteil bringt. Obgleich es für diese molekulare Subgruppe keine prospektiven Daten gibt, ist eine adjuvante Therapie mit 800 mg/d bei Exon-9-mutierten GIST vertretbar und wird von vielen GIST-Zentren angewendet.
Tumoren, die aktivierende Mutationen im Codon 842 (D842V) des PDGFRA-Gens aufweisen, sprechen auf Imatinib nicht an [21]. Eine adjuvante Therapie sollte bei Patienten mit dieser Mutation auf keinen Fall erfolgen.
Zur Vermeidung von Überbehandlungen, unnötigen Kosten und Nebenwirkungen muss vor Einleitung einer adjuvanten Therapie bei jedem Patienten eine Genotypisierung erfolgen.
Nachsorge bei lokalisierten GIST
Während im Fall kleinster GIST (sehr niedriges Rückfallrisiko) auf eine Nachsorge verzichtet werden kann, wird bei Patienten mit intermediären GIST eine Nachsorge mittels Schnitt-Bildgebung alle drei bis sechs Monate, bei Patienten mit hohem Rezidivrisiko alle drei Monate empfohlen. Dieses Intervall sollte insbesondere in den ersten zwei Jahren nach Resektion bzw. Abschluss der adjuvanten Therapie eingehalten werden. Aufgrund des gehäuften Vorkommens von Spätrezidiven muss eine Nachsorge gegebenenfalls auch für bis zu zehn Jahre erwogen werden.
Da Rezidive unter laufender adjuvanter Therapie bei Patienten mit Exon-11-Mutationen von KIT sehr selten sind, ist bei diesen Patienten eine Bildgebung in Intervallen von sechs Monaten vertretbar.
Lokal fortgeschrittene Erkrankung
Patienten mit lokal fortgeschrittener Erkrankung müssen eine präoperative Therapie mit Imatinib erhalten, sofern eine Imatinib-empfindliche Mutation vorliegt. Eine neoadjuvante Behandlung sollte auch bei resektablen Tumoren erwogen werden, wenn man durch Tumorverkleinerung eine Verringerung des Resektionsausmaßes erreichen kann. Insbesondere bei großen Magen-GIST kann durch die Vorbehandlung u. U. das Ausmaß der Magenresektion verringert werden, was neben der verbesserten Lebensqualität auch Relevanz für die Pharmakokinetik nachfolgender medikamentöser Therapien haben kann. Auch in dieser Situation ist für die Auswahl der Therapie sowie die Imatinib-Dosierung die Erhebung des Genotyps Grundvoraussetzung. Das maximale Therapieansprechen wird bei den meisten Patienten nach sechs bis neun Monaten erreicht, weshalb eine Resektion in diesem Zeitraum angestrebt werden sollte [22].
Metastasierte Erkrankung
Bislang sind drei Medikamente – unabhängig vom vorliegenden Genotyp – für die sequenzielle Behandlung metastasierter GIST zugelassen: Imatinib, Sunitinib und Regorafenib.
Imatinib in einer Dosierung von 400 mg/d ist Standard für Patienten in der Erstlinie. Eine Dosissteigerung auf 800 mg/d führt bei Patienten mit Exon-11-Mutationen ausschließlich zum Anstieg von Nebenwirkungen und keinerlei klinischem Vorteil [20]. Im Gegensatz dazu konnte bei Vorliegen von Exon-9-Mutationen im KIT-Gen eine signifikante Verbesserung des progressionsfreien Überlebens (PFS) sowie der objektiven Remissionsrate durch eine Tagesdosis von 800 mg erreicht werden [20]. Insbesondere bei Patienten mit hohem Therapiedruck oder Patienten, die Kandidaten für eine Metastasektomie sind, sollte eine höhere Dosierung angestrebt werden [22].
Das Vorhandensein einer Exon-11-Mutation von KIT ist dabei im Vergleich mit Exon-9-Mutationen mit einer höheren Remissionsrate und auch einem längeren medianen PFS verbunden [23].
Kürzlich wurde von der französischen Sarkom-Studiengruppe noch eine weitere spannende Analyse vorgestellt, bei der sich zeigte, dass die Lokalisation der Mutation innerhalb von Exon 11 prädiktiv für die Dauer des Therapieansprechens ist. Die Untergruppe der Patienten mit Deletionen von Kodon 557 und/oder 558 zeigten ein signifikant schlechteres PFS (31 Monate) gegenüber denen, bei denen KIT-Mutationen oberhalb („upstream“; 49 Monate) oder unterhalb („downstream“; 63 Monate) dieser Kodons lagen [24]. Diese Arbeit ist nicht nur für die Beratung von Patienten bedeutsam, sondern erlaubt zudem die Identifizierung von Hochrisiko-Kollektiven für zukünftige klinische Studien in der Erstlinientherapie.
Kürzlich wurden zudem die Ergebnisse der Phase-III-Studie ENESTg1 vorgestellt, bei der der ABL/KIT-Inhibitor Nilotinib randomisiert mit Imatinib in der Erstlinienbehandlung verglichen wurde. Nilotinib war ebenso wie Imatinib zunächst für die Behandlung der chronischen myeloischen Leukämie (CML) entwickelt worden und ist für diese Indikation zugelassen. Präklinische Daten hatten auch eine Aktivität gegenüber verschiedenen Imatinib-resistenten KIT-Mutanten angezeigt, weshalb eine bessere Wirksamkeit als die von Imatinib vermutet wurde.
Die ENESTg1-Studie konnte diese Hypothese nicht belegen, da Nilotinib hinsichtlich des progressionsfreien Überlebens (52% vs. 59%) sowie des Gesamtüberlebens (82% vs. 90%) nach 24 Monaten sogar unterlegen war [25]. Die molekularen Subgruppenanalysen dieser Studie sind nichtsdestotrotz bemerkenswert und klinisch relevant: Patienten mit Exon-9-Mutation von KIT sprachen auf Nilotinib gar nicht an (Hazard Ratio für Progression 32), und der Großteil der Patienten wies eine Progression innerhalb von drei Monaten auf. Dies allein erklärt vermutlich schon die Unterlegenheit von Imatinib in der Gesamtpopulation. Im Gegensatz dazu war Nilotinib bei Patienten mit Exon-11-Mutationen bezüglich des PFS (bei zentraler radiologischer Auswertung) besser als Imatinib (HR 0,65). Vor dem Hintergrund nahezu vergleichbar guter Toxizitätsdaten kann daher bei Patienten mit Exon-11-Mutationen, bei denen eine Imatinib-Unverträglichkeit besteht, ein Therapieversuch mit Nilotinib überlegt werden. Nilotinib hat ein günstigeres Nebenwirkungsprofil als Sunitinib oder Regorafenib.
Stellenwert der Metastasenchirurgie bei GIST
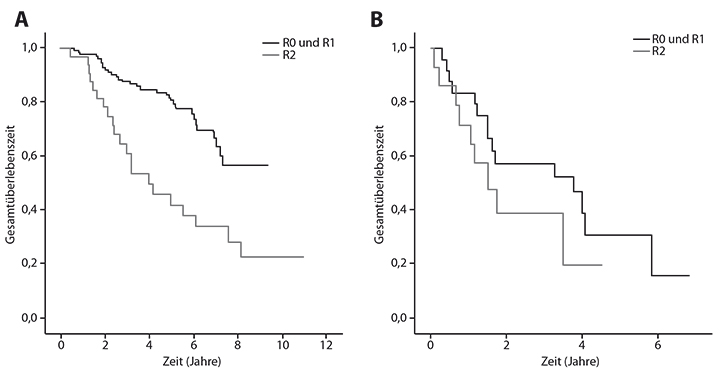
Die prospektiv randomisierte Studie SURGIST sollte den Stellenwert einer Metastasektomie gegenüber einer alleinigen medikamentösen Behandlung überprüfen. Aufgrund mangelnder Akzeptanz von Patienten und Ärzten musste sie abgebrochen werden, weshalb lediglich retrospektive Analysen für die Beratung von Patienten verfügbar sind. Eine Analyse mehrerer europäischer Zentren konnte dabei ein deutlich längeres Gesamtüberleben für Patienten nachweisen, bei denen zum Zeitpunkt eines Therapieansprechens eine makroskopisch komplette Resektion möglich war (Abb. 2). Der Medianwert der Zeit bis zur Progression nach Resektion einer residuellen Erkrankung wurde nicht erreicht bei den Patienten mit R0/R1-Resektion und betrug 1,9 Jahre bei Patienten, die nicht komplett operiert werden konnten (p=0,0001).
Eine Metastasektomie sollte für alle Patienten mit vertretbarem Operationsrisiko zum Zeitpunkt des maximalen Therapieansprechens geprüft werden. Postoperativ sollte Imatinib unverändert lebenslang eingenommen werden. Teilresektionen scheinen das Überleben nicht zu verlängern und sollten daher nur zur Symptomverbesserung erwogen werden.
Progression unter Imatinib-Therapie
Pro Behandlungsjahr entwickeln etwa 20% der Patienten eine sekundäre Resistenz gegenüber Imatinib, wobei bei etwa 10–20% aller Patienten eine langfristige Krankheitskontrolle durch eine kontinuierliche Therapie zu beobachten ist [27]. Kommt es unter Imatinib oder während der Nachsorge zur Progression der Erkrankung, wird zwischen einem generalisiertem und einem limitiertem Progress unterschieden. Radiologisch sind bei GIST häufig „lesions within a mass“, d. h. neu aufgetretene, Kontrastmittel-affine Noduli innerhalb meist liquefizierter Metastasen zu beobachten. Gegebenenfalls kann bei isoliertem Progress eine lokale Behandlung der Manifestation erfolgen. Hier kommen die operative Entfernung, die Radiofrequenz-Ablation von hepatischen Metastasen oder die Bestrahlung ossärer Metastasen infrage [22].
Bei einem generalisierten Progress sollte – nach Ausschluss mangelnder Compliance – eine Therapieumstellung erfolgen. Eine Erhöhung der Imatinib-Dosis auf 800 mg pro Tag scheint v. a. bei Patienten mit Exon-9-Mutationen von KIT sinnvoll zu sein – bei Patienten mit Exon-11-Mutationen ist die Wahrscheinlichkeit eines Therapieansprechens mit Sunitinib deutlich höher. Sunitinib ist in einer Dosierung von 50 mg (vier Wochen „on“/zwei Wochen „off“) auf der Basis einer placebokontrollierten Studie zugelassen [28]. Aufgrund der verhältnismäßig hohen Nebenwirkungsrate dieser Dosierung kann alternativ auch eine kontinuierliche Therapie mit 37,5 mg/d eingesetzt werden, die eine ähnliche Wirksamkeit bei besserer Verträglichkeit aufweist [29]. Bei Therapieversagen auf (oder Intoleranz gegenüber) Imatinib und Sunitinib ist Regorafenib in der Dosierung von 160 mg (drei Wochen „on“ /eine Woche „off“) in der Drittlinie zugelassen.
Während mit Imatinib eine Ansprechrate (RR) von 50% und ein medianes Überleben von fünf Jahren assoziiert ist, hat Sunitinib eine RR von 7% und ein medianes PFS von 6–7 Monaten. Bei Regorafenib wurde in der Zulassungsstudie eine Remissionsrate von 5% und ein medianes PFS von 4–5 Monaten beobachtet [30, 31]. Generell wird ein Therapieabbruch im Sinne eines vollständigen Absetzens von Tyrosinkinaseinhibitoren nicht empfohlen, da es danach zu schnellerem Tumorwachstum kam. In dieser Situation kann man z. B. eine erneute Therapie mit Imatinib im Rahmen eines Best-Supportive-Care-Konzeptes in Betracht ziehen [22].
Mechanismen der Imatinib-Resistenz
Häufigste Resistenzmechanismen sind sekundäre Punktmutationen im Bereich der ATP-Bindungstasche von KIT (Exon 13/14) sowie in der Aktivierungsschleife (Exon 17/18; [32]). Bedeutsam für die Entwicklung von Rezidivtherapien ist dabei die Beobachtung, dass die Resistenz sich klonal entwickelt und sich bei vielen Patienten genetisch unterschiedliche Resistenzmutationen finden. Für die Salvage-Therapie zugelassene KIT-Inhibitoren (Sunitinib und Regorafenib) wirken gegen einen Teil der Resistenzmutationen, decken aber nicht das gesamte Spektrum ab. Anhand eines kürzlich von Gardner und Mitarbeitern vorgestellten Mutagenese-Screens konnte eindrücklich rekapituliert werden, wie sekundäre und tertiäre Resistenzen entstehen. Während Sunitinib effektiv Mutationen in Exon 13/14 hemmt, kommt es unter dieser Behandlung zu einer Selektion von Sunitinib-resistenten Exon-17/18-Mutationen. Im Gegensatz dazu weist Regorafenib eine bessere Wirksamkeit gegenüber einigen Exon-17-Mutationen von KIT auf, eine längere Therapie führt jedoch zu einer Selektion von Exon-13/14-Mutationen bzw. Regorafenib-resistenten Exon-17-Mutationen (z. B. D816E; [33]). Die aktuell in den USA laufende SURE-Studie basiert auf dieser Beobachtung und untersucht ein Therapiekonzept, bei dem ein rascher Wechsel von Sunitinib und Regorafenib die Selektion von Resistenzen verhindern soll.
Die Resistenzmechanismen scheinen jedoch v. a. nach längerer Therapie noch komplexer zu sein. Neben sekundären KIT-Mutationen wurden kürzlich auch erstmals Mutationen beschrieben, die zu einer KIT-unabhängigen Aktivierung des PI3K- oder MAPK-Signalweges z. B. durch RAS oder PTEN führen [34]. Die umfassende Behandlung dieser polyklonalen Resistenz stellt daher ein wesentliches Ziel aktueller Studien dar.
Aktuelle Therapiestudien
Eine Reihe direkter, ATP-kompetitiver KIT-Inhibitoren wurde in den letzten Jahren bei refraktären GIST klinisch evaluiert:
Pazopanib, ein Multi-Tyrosinkinaseinhibitor, der neben VEGFR1–3 auch KIT potent inhibiert, wurde bei Imatinib- und Sunitinib-refraktären GIST randomisiert gegen „Best Supportive Care“ (BSC) getestet (PAZOGIST-Studie). Erste Ergebnisse zeigen ein 4-Monats-PFS von 47,7% für Pazopanib plus BSC versus 19,5% für BSC alleine (HR 0,56, p = 0,02; [31]). Interessanterweise zeigte ein Patient mit SDH-defizientem GIST ein Ansprechen über 17 Zyklen [35].
Ponatinib, ein speziell für die BCR-ABL-Gatekeeper-Mutationen entwickelter Inhibitor, weist als bisher einziger KIT-Inhibitor auch bei KIT-D816-Mutationen eine hohe Wirksamkeit auf [33]. Die vorläufigen Daten einer Phase-II-Studie bei Patienten mit überwiegend stark vorbehandelten GIST wurden kürzlich vorgestellt. Dabei zeigte sich bei 37% der Patienten, bei denen eine primäre Exon-11-Mutation von KIT vorgelegen hatte, ein klinischer Nutzen (Clinical Benefit, CBR), bei Patienten mit primärer Exon-11-Mutation in 37% und bei Patienten mit anderen Mutationen in 14% der Fälle. Das Toxizitätsprofil von Ponatinib war dabei verhältnismäßig günstig. Die im Rahmen der Behandlung von CML-Patienten beobachteten vermehrten vaskulären Ereignisse wie Schlaganfälle und Herzinfarkte sind bislang bei GIST nicht berichtet worden [36]. Die POETIG-Studie wird in Kürze den Stellenwert von Ponatinib in einer Dosierung von 30 mg/d bei vorbehandelten Patienten mit GIST untersuchen. Dabei wird auch die klinische Bedeutung einer Plasma-Sequenzierung zur Prädiktion des Therapieansprechens validiert.
Präklinische Arbeiten haben kürzlich die Rolle des Rezeptors für Fibroblasten-Wachstumsfaktor (FGFR) auf eine Resistenzentstehung hin untersucht. Dabei konnte demonstriert werden, dass eine FGFR-Aktivierung die Effizienz der KIT-Inhibition durch Imatinib abschwächt [37, 38]. Zudem führten FGFR-Liganden zu einer Kreuzaktivierung von KIT und könnten dadurch trotz fehlender Sekundärmutation zu einer Resistenz beitragen. Kombinierte KIT/FGFR-Inhibitoren wurden bereits bei GIST untersucht. Zwei Studien aus Korea und Europa [Joensuu H et al. ESMO 2014, Abstract #LBA46] wiesen auf eine Wirksamkeit hin. So zeigte Dovitinib bei Patienten in der zweiten Therapielinie eine CBR von 47% bei einem medianen PFS von 4,6 Monaten.
Eine Hemmung von KIT zusammen mit Inhibitoren KIT-abhängiger Signalwege könnte zum einen die genomische Heterogenität verschiedener sekundärer KIT-Mutationen, aber auch KIT-unabhängige aktivierende Mutationen z. B. von BRAF oder KRAS adressieren. Eine laufende Phase-I/II-Studie untersucht aktuell die Kombination von Imatinib mit dem MEK-Inhibitor Binimetinib.
Als weiteres therapeutisch relevantes Ziel wurde kürzlich der MET-Signalweg identifiziert. Imatinib führte in vitro zu einer Aktivierung von MET, die sich über eine MET-Inhibition therapeutisch adressieren ließ [39]. Im Rahmen einer Phase-I-Studie konnte für den KIT/MET-Inhibitor Cabozantinib eine Remission bei einem mit Imatinib vorbehandelten GIST beobachtet werden. Vor diesem Hintergrund wird in Kürze im Rahmen einer EORTC-Studie der klinische Nutzen von Cabozantinib bei Imatinib- und Sunitinib-resistenten GIST untersucht werden.
Für Patienten, die eine Mutation des Kodons 842 des PDGFR-Gens aufweisen, gibt es bislang keine wirksame Therapie. Crenolanib, ein spezifischer PDGFRA-Inhibitor, hat erste klinische Wirksamkeit gezeigt und wird in Kürze im Rahmen einer randomisierten Studie geprüft werden [40]. BLU-285 ist ein mutationsspezifischer Inhibitor der PDGFRA-D842V-Mutation sowie einer Reihe von KIT-Exon-17-Mutationen. Präklinische Untersuchungen weisen eine IC50 im einstelligen nanomolaren Bereich auf. Eine First-in-man-Studie läuft aktuell auch unter deutscher Beteiligung (Westdeutsches Tumorzentrum Essen).
Inwieweit immuntherapeutische Ansätze künftig bei der Behandlung von GIST eine Rolle spielen, ist derzeit noch unklar. Erste Analysen konnten zeigen, dass der Nachweis von CD3-positiven Tumor-infiltrierenden Lymphozyten mit einem besseren progressionsfreien Überleben assoziiert waren [41]. Eine Studie, bei der Dasatinib und der CTLA4-blockierende Antikörper Ipilimumab in Kombination bei GIST untersucht werden, zeigte bei einem von acht Patienten eine dauerhafte Remission [Shoushtari et al. ASCO 2015 Abstract #10521].
Zusammenfassung
Die Behandlung von GIST erfordert eine umfassende molekulare Profilierung, da der Genotyp in nahezu jedem Krankheitsstadium die Behandlungsentscheidungen beeinflusst. Durch ein verbessertes Verständnis der Resistenzmechanismen stehen eine Vielzahl innovativer neuer Behandlungsansätze zur Verfügung oder sind in klinischer Testung. Die Anbindung an spezialisierte Zentren sollte daher jedem Patienten angeboten werden.
Interessenskonflikte: S. Bauer hat Forschungsförderung von Novartis, Blueprint Medicines und Ariad erhalten; nimmt beratende Tätigkeiten für GSK, Novartis, Pfizer, Bayer, Fresenius, Lilly und Blueprint Medicines wahr; erhielt Honorare von Pharmamar, GSK, Pfizer und Bayer und Reisekostenunterstützung von Pharmamar und Bayer.
Literatur
1. Nilsson B et al. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era - a population-based study in western Sweden. Cancer 2005; 103: 821-9.
2. Kawanowa K et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 2006; 37: 1527-35.
3. Corless CL et al. KIT mutations are common in incidental gastrointestinal stromal tumors one centimeter or less in size. Am J Pathol 2002; 160: 1567-72.
4. Soreide K et al. Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol 2016; 40: 39-46.
5. Wang Y, Fletcher JA. Cell cycle and dystrophin dysregulation in GIST. Cell Cycle 2015; 14: 2713-4.
6. ESMO/European Sarcoma Network Working Group. ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25 (Suppl 3): iii21-6.
7. Corless CL. Gastrointestinal stromal tumors: What do we know now? Mod Pathol 2014; 27 (Suppl 1): S1-16.
8. Corless CL et al. Gastrointestinal stromal tumours: Origin and molecular oncology. Nat Rev Cancer 2011; 11: 865-78.
9. Janeway KA et al. Defects in succinate dehydrogenase in gastrointestinal stromal tumors lacking KIT and PDGFRA mutations. Proc Natl Acad Sci USA 2011; 108: 314-8.
10. Miettinen M,Lasota J. Gastrointestinal stromal tumors: Review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006; 130: 1466-78.
11. Falchook GS et al. BRAF mutant gastrointestinal stromal tumor: First report of regression with BRAF inhibitor dabrafenib (GSK2118436) and whole exomic sequencing for analysis of acquired resistance. Oncotarget 2013; 4: 310-5.
12. Bauer S. Individualisierte Therapie von Sarkomen - Standards und Perspektiven. 2015: Unimed Verlag.
13. ErikssonM et al. Needle biopsy through the abdominal wall for the diagnosis of GIST – does it pose any risk for tumor cell seeding and recurrence? Connective Tissue Oncology Ssociety Meeting 2012, Prague.
14.Miettinen M,Lasota J. Gastrointestinal stromal tumors: Pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23: 70-83.
15.Joensuu H et al. Risk of recurrence of gastrointestinal stromal tumour after surgery: An analysis of pooled population-based cohorts. Lancet Oncol 2012; 13: 265-74.
16.Wozniak A et al. Tumor genotype is an independent prognostic factor in primary gastrointestinal stromal tumors of gastric origin: A European multicenter analysis based on ConticaGIST. Clin Cancer Res 2014; 20: 6105-16.
17. Joensuu H et al. KIT and PDGFRA mutations and the risk of GI stromal tumor recurrence. J Clin Oncol 2015; 33: 634-42.
18. Corless CL et al. Pathologic and molecular features correlate with long-term outcome after adjuvant therapy of resected primary GI stromal tumor: The ACOSOG Z9001 trial. J Clin Oncol 2014; 32: 1563-70.
19. Dematteo RP et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: A randomised, double-blind, placebo-controlled trial. Lancet 2009; 373: 1097-104.
20. Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: A meta-analysis of 1,640 patients. J Clin Oncol 2010; 28: 1247-53.
21. Corless CL et al. PDGFRA mutations in gastrointestinal stromal tumors: Frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol 2005; 23: 5357-64.
22. Network NCC. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines(R)). 2016: www.nccn.org/professionals/physician_gls/PDF/sarcoma.pdf.
23. Heinrich MC et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 2003; 21: 4342-9.
24. Patrikidou A et al. Long-term outcome of molecular subgroups of GIST patients treated with standard-dose imatinib in the BFR14 trial of the French Sarcoma Group. Eur J Cancer 2016; 52: 173-80.
25. Blay JY et al. Nilotinib versus imatinib as first-line therapy for patients with unresectable or metastatic gastrointestinal stromal tumours (ENESTg1): A randomised phase 3 trial. Lancet Oncol 2015; 16: 550-60.
26. Bauer S et al. Long-term follow-up of patients with GIST undergoing metastasectomy in the era of imatinib - Analysis of prognostic factors (EORTC-STBSG collaborative study). Eur J Surg Oncol 2014; 40: 412-9.
27. Blanke CD et al. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 2008; 26: 626-32.
28. Demetri GD et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: A randomised controlled trial. Lancet 2006; 368: 1329-38.
29. George S et al. Clinical evaluation of continuous daily dosing of sunitinib malate in patients with advanced gastrointestinal stromal tumour after imatinib failure. Eur J Cancer 2009; 45: 1959-68.
30. Demetri GD et al. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): An international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 295-302.
31. Blay JY et al. A randomized multicentre phase II study of pazopanib plus best supportive care (BSC) vs BSC alone in metastatic gastroIntestinal stromal tumors (GIST) resistant to imatinib and sunitinib. in 39th ESMO Congress. ESMO 2014, Abstract #LBA45.
32. Heinrich MC et al. Molecular correlates of imatinib resistance in gastrointestinal stromal tumors. J Clin Oncol 2006; 24: 4764-74.
33. Garner AP et al. Ponatinib inhibits polyclonal drug-resistant KIT oncoproteins and shows therapeutic potential in heavily pretreated gastrointestinal stromal tumor (GIST) patients. Clin Cancer Res 2014; 20: 5745-55.
34. Serrano C et al. KRAS and KIT gatekeeper mutations confer polyclonal primary imatinib resistance in GI stromal tumors: Relevance of concomitant phosphatidylinositol 3-kinase/AKT dysregulation. J Clin Oncol 2015; 33: e93-6.
35. Ganjoo KN et al. A multicenter phase II study of pazopanib in patients with advanced gastrointestinal stromal tumors (GIST) following failure of at least imatinib and sunitinib. Ann Oncol 2014; 25: 236-40.
36. Heinrich MC et al. Ponatinib efficacy and safety in patients (pts) with advanced gastrointestinal stromal tumors (GIST) after tyrosine kinase inhibitor (TKI) failure: Results from a phase 2 study. ASCO 2015, Abstract #10535.
37. Javidi-Sharifi N et al. Crosstalk between KIT and FGFR3 promotes gastrointestinal stromal tumor cell growth and drug resistance. Cancer Res 2015; 75: 880-91.
38. Li F et al. FGFR-mediated reactivation of MAPK signaling attenuates antitumor effects of imatinib in gastrointestinal stromal tumors. Cancer Discov 2015; 5: 438-51.
39. Cohen NA et al. Pharmacological inhibition of KIT activates MET signaling in gastrointestinal stromal tumors. Cancer Res 2015; 75: 2061-70.
40. Heinrich MC et al. Crenolanib inhibits the drug-resistant PDGFRA D842V mutation associated with imatinib-resistant gastrointestinal stromal tumors. Clin Cancer Res 2012; 18: 4375-84.
41. Rusakiewicz S et al. Immune infiltrates are prognostic factors in localized gastrointestinal stromal tumors. Cancer Res 2013; 73: 3499-510.

Dr. med. Johanna Falkenhorsta
Prof. Dr. med. Sebastian Bauerab
aInnere Klinik (Tumorforschung), Sarkom-Zentrum, Universitätsklinikum Essen,
Universität Duisburg-Essen
bDeutsches Konsortium für Translationale Krebsforschung (DKTK), Heidelberg
Korrespondierender Autor
Prof. Dr. med. Sebastian Bauer
Innere Klinik (Tumorforschung), Sarkom-Zentrum, Westdeutsches Tumorzentrum
Universitätsklinikum Essen
Hufelandstr. 55, 45122 Essen
sebastian.bauer[at]uk-essen[dot]de

