Individualisierte Therapie des Mammakarzinoms auf Basis molekularer Marker
Die Begriffe molekular und individualisiert wurden in den vergangenen zehn Jahren zu – inzwischen geradezu inflationär verwendeten – Schlagwörtern der onkologischen Diagnostik und Therapie. Man könnte einwenden, dass sich die Diagnostik seit über einem Jahrhundert chemischer und damit „molekularer“ Verfahren bedient, und dass jede Therapie, die auf einer persönlichen Anamnese und Untersuchung des Patienten basiert, letztlich „individualisiert“ ist. Aber im Zuge des Human-Genom-Projekts wurden beide Begriffe präzisiert: Das zentrale Molekül des molekularen Paradigmas ist die DNA mit der darin enthaltenen genetischen Information, und unter Individualisierung der Therapie versteht man eine Abkehr vom Gießkannenprinzip der Blockbuster (one size fits all) hin zu zielgerichteten Therapien (targeted therapies), deren biochemische Grundlage das individuell veränderte Genom mit seinen Expressionsprodukten (RNA, Proteine) ist. In der Onkologie spielt gerade der letzte Punkt eine große Rolle, weil somatische Mutationen mit nachfolgender Über- oder Unterexpression von Genen das Wesen der Krebserkrankung ausmachen.
Mammakarzinom als Vorreiter
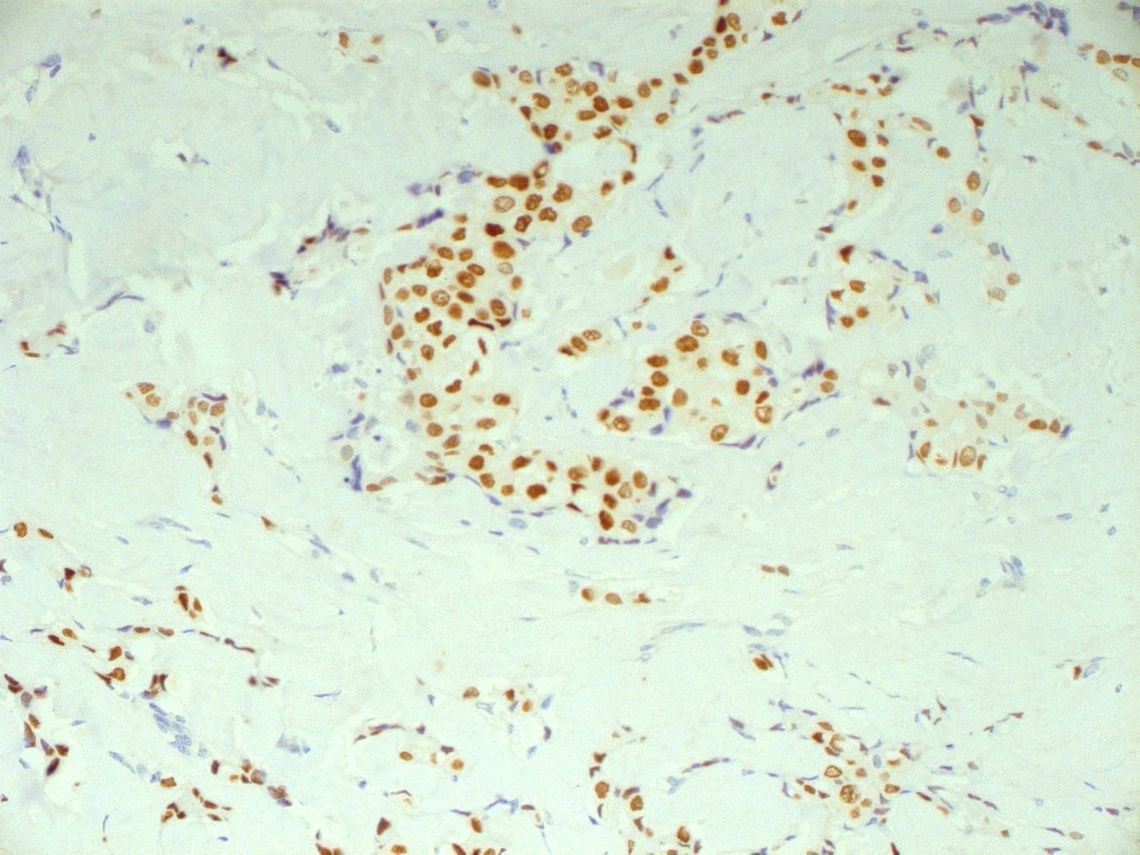
Die Ursprünge der individualisierten Therapie auf Basis molekularer Marker reichen fast 50 Jahre zurück, wobei das Mammakarzinom eine Vorreiterrolle spielte (Tab. 1). Bereits seit 1970 wird die Expression von Steroidhormonrezeptoren (Östrogen) in den Tumorzellen von Mammakarzinomen untersucht. Nach der anfänglichen Bestimmung mit Radioimmunoassays hat sich nun seit Jahrzehnten die immunhistochemische Analyse als Standardmethode etabliert (sog. Immun-Reaktiver Score (IRS) als Produkt aus Intensität der Kernfärbung (0–3) udn Anzahl positiver Tumorzellen (1–4; Abb. 1). Eine antihormonelle Therapie ist nur bei positivem Befund sinnvoll.
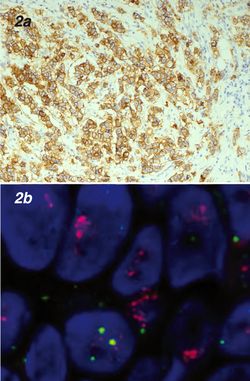
Als eigentlicher Startpunkt einer gezielten Therapie auf Basis molekularer Marker gilt allerdings die Einführung von Trastuzumab (Herceptin) im Jahr 1998 in den USA (2000 in der EU). Dieser monoklonale Antikörper richtet sich gegen den Wachstumsfaktoren-Rezeptor HER2, der – im Gegensatz zu den auch im gesunden Mammagewebe exprimierten Steroidhormonrezeptoren – durch eine pathologische Vervielfachung (Amplifikation) des HER2-Gens in den Tumorzellen überexprimiert wird. In der Immunhistochemie erkennt man dies an einer intensiven und vollständigen Membranfärbung von zumindest 30% der Tumorzellen (Abb. 2a); in Zweifelsfällen sorgt eine In-situ-Hybrisidierung (FISH oder CISH), bei der man die Genkopien pro Zelle direkt auszählt, für Klarheit (Abb. 2b). Inzwischen wird Trastuzumab auch bei anderen Tumorentitäten mit HER2-Überexpression wie zum Beispiel fortgeschrittenem Magenkarzinom und nicht-kleinzelligem Lungenkarzinom eingesetzt.
Der Abschluss des Human-Genom-Projekts kurz nach der Jahrtausendwende markiert auch den Beginn einer explosionsartigen Zunahme von Medikamenten, die nun sehr viel gezielter auf Basis molekularer Veränderungen in malignen Tumoren konzipiert werden konnten (Abb. 3).
Derzeit gibt es knapp 30 Substanzen, die nur dann verabreicht werden dürfen, wenn der entsprechende molekularpathologische Nachweis eines bestimmten Zielmoleküls geführt werden konnte. Zehn davon sind beispielhaft in Tabelle 2 zusammengestellt. In den nächsten Jahren ist mit einer raschen Zunahme zu rechnen, da mittlerweile rund zwei Drittel aller neuen Krebsmedikamente auf molekularer Basis entwickelt werden.
Genetische Fingerabdrücke
Ein sehr aktueller Trend in der individualisierten Krebstherapie, der über die Bestimmung isolierter genetischer Veränderungen hinausgeht, ist die Erfassung ganzer Genexpressionsmuster, häufig auch als Signaturen oder genetischer Fingerabdruck bezeichnet. Das Ziel dieser Aktivitäten ist es, auch komplexere Fragen zu beantworten, insbesondere solche wie „Chemotherapie ja oder nein?“ und „Wenn ja, dann in welchen Kombinationen?“
Bei der St. Gallen-Brustkrebskonferenz von 2009 bejahten 71% der Experten die Frage, ob genomic grading die etablierten klassischen Prognosefaktoren ergänzen soll. Ein validiertes Genprofil, so die dort verabschiedete Leitlinie, könne als Zusatz zu einer Hoch-Qualitäts-Phänotypisierung von Brustkrebsfällen eingesetzt werden, bei denen die Nützlichkeit des Einsatzes einer adjuvanten Chemotherapie fraglich ist.
Speziell für einen Großteil operierter Patientinnen mit Hormonrezeptor-positiven, Her2/neu-negativen Tumoren, die ca. 60% aller Mammakarzinome repräsentieren, wäre eine adjuvante anti-hormonelle Therapie alleine häufig ausreichend. Nebenwirkungen und Behandlungskosten einer zusätzlichen Chemotherapie könnten deutlich reduziert werden.
Zu diesem Zweck stehen mittlerweile drei validierte Multigen-Tests (MammaPrint/Agendia, Niederlande, Oncotype DX/Genomic Health, USA und EndoPredict/Sividon, Deutschland) zur Verfügung.
MammaPrint analysiert die Genexpression im Microarray-Verfahren. Dieser Test ist mit frischem oder mit formalin-fixiertem Tumorgewebe möglich. Letzteres muss jedoch sofort nach der Operation in einem speziellen
mRNA-Konservierungsmittel aufbewahrt und anschließend in das Labor von Agendia in die Niederlande gesendet werden, da deutsche Brustzentren den Test derzeit noch nicht vor Ort durchführen können.
Die Genexpressionsanalysen von Oncotype DX und EndoPredict beruhen auf Multiplex-PCR-Verfahren. Beide Tests benötigen formalinfixiertes und in Paraffin eingebettetes Tumorgewebe (FFPE). Während für die Bearbeitung von Oncotype DX das Tumorgewebe im Paraffinblock in das Labor von Genomic Health in die USA geschickt wird, kann EndoPredict von Pathologen oder Molekularpathologen in Kooperation mit klinischen Brustzentren in Deutschland eingesetzt werden. Mit einem Testergebnis ist bei MammaPrint und Oncotype DX nach ein bis zwei Wochen, bei EndoPredict nach etwa zwei Tagen zu rechnen.
Tests bewerten Rückfallrisiko
MammaPrint analysiert die Expression von 70 Genen, die im Zusammenhang mit der Prognose und Therapierbarkeit des Mammakarzinoms stehen. Das Ergebnis „geringes Risiko“ bedeutet eine nur zehnprozentige Wahrscheinlichkeit, dass der Tumor ohne Zusatzbehandlung wie Hormon- oder Chemotherapie innerhalb von zehn Jahren erneut auftreten kann. Bei „hohem Risiko“ erhöht sich diese Wahrscheinlichkeit auf knapp 30%.
Oncotype DX untersucht die Expression einer Gruppe von 21 Genen – 16 Krebs- und 5 Kontrollgene. Das Resultat ist ein sogenannter Recurrence-Score. Dieser numerische Wert – zwischen 0 und 100 – korreliert mit dem individuellen Risiko eines Rezidivs und erlaubt so eine Einschätzung, ob die Patientin von einer zusätzlich zur Hormontherapie durchgeführten Chemotherapie profitiert.
EndoPredict testet die Ausprägung und Aktivität von acht Genen – drei mit der Zellteilung und fünf mit Hormonrezeptoren assoziierte Gene. Der molekulare EP-Score kombiniert im EPclin-Score (auf einer Skala von 1–8) die Faktoren Tumorgröße mit dem Befall von Lymphknoten, dem Nodalstatus. EPclin-Score ≤ 3,3 bedeutet „niedriges Rezidivrisiko“ (< 10% in zehn Jahren). Eine adjuvante Chemotherapie wird bei diesem Testergebnis nicht empfohlen. Ein EPclin-Score > 3,3 weist hingegen auf ein „hohes Rezidivrisiko“ hin (> 10% in zehn Jahren), weshalb in der Regel eine Chemotherapie anzuraten ist.
Vergütung
Seit 1. April 2015 können gesetzlich versicherte Brustkrebspatientinnen laut Beschluss des Gemeinsamen Bundesausschusses (G-BA).mit einem Genexpressionstest untersucht werden, um für sie die beste und schonendste Behandlung auszuwählen.
In einer Pressemitteilung vom 10. Februar 2015 vertrat der Berufsverband Deutscher Pathologen (BDP) die Auffassung, dies markiere zwar einen Fortschritt, da Genexpressionstests bisher meist privat versicherten Frauen vorbehalten waren, trage aber wissenschaftlichen Erkenntnissen nicht hinreichend Rechnung.
Grund für die Kritik ist die Beschränkung auf Tumoren mit einer Mindestgröße von 2 cm. Es gibt kleinere Tumoren mit hochgradig aggressivem Verhalten, die von der Vergütung durch die GKV ausgeschlossen werden. Der Verband setzt sich dafür ein, dass die Beschränkung künftig entfällt.
Dr. med. Peer Dettmar
Pathologie München-Nord
Ernst-Platz-Straße 2
80992 München
QuIP-Ringversuch zur molekularpathologischen BRCA-1/2 Testung

