Diagnostik und Therapie der Weichteilsarkome aus orthopädischer Sicht
Torsten Kluba
Weichteilsarkome sind eine heterogene Gruppe maligner Tumoren mesenchymalen Ursprungs (Muskulatur, Fett- und Bindegewebe, Gefäße, Nerven, [2, 5]). Weichteilsarkome machen nur 0,7% aller Malignome im Erwachsenenalter aus [1]. Die Inzidenz wird mit drei Neuerkrankungen pro 100.000 Einwohner pro Jahr angegeben [14].
Ihre Bedeutung für den orthopädischen Tumorchirurgen ergibt sich aus ihrer Lokalisation überwiegend an den Extremitäten. Die verschiedenen Entitäten weisen altersabhängige Häufigkeitsgipfel auf. Auch ihr biologisches Verhalten ist bei Kindern und Erwachsene unterschiedlich [8]. Regelmäßig imponieren große, progrediente, schmerzlose Schwellungen. Nicht selten wurden über Wochen ambulant erfolglos symptomatische Maßnahmen wie Massagen oder physikalische Anwendungen durchgeführt, ohne dass zuvor eine wegweisende Diagnostik eingeleitet worden wäre.
Diagnostik
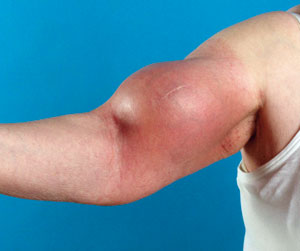
Mit der klinischen Untersuchung kann man eine erste Einschätzung zur Ausdehnung der Geschwulst treffen. Die Konsistenz des Tumors sowie die Verschieblichkeit gegenüber der darüber liegenden Haut werden beurteilt. V. a. nach Voroperationen und Radiotherapie ist die manuelle Untersuchung für die Rekonstruktionsplanung im Rahmen der Operation wichtig (Abb. 1). Die Notwendigkeit plastischer Deckungen muss abgeschätzt werden. Bestehende Einschränkungen im Bewegungsumfang der angrenzenden Gelenke werden bestimmt. Die regionalen Lymphknoten sind bei den überwiegend hämatogen streuenden Sarkomen zwar nur selten betroffen, sollten aber v. a. bei Patienten mit Klarzell-, Synovial- und ephiteloidzelligem Sarkom palpiert werden.
Die nativ-radiologische Diagnostik in zwei Ebenen ist bei tiefen und eventuell dem Knochen adhärenten Läsionen indiziert. V. a. nach knöchernen Voroperationen ist das Nativ-Röntgenbild unerlässlich, um eine korrekte Interpretation der Schnittbilddiagnostik zu gewährleisten (Artefakte durch Implantate). Röntgendichte Strukturen im Tumor können darüber hinaus bereits nicht-invasiv differenzialdiagnostische Hilfe leisten. Interventionell radiologisch lassen sich gezielt einzelne Lokalisationen mit Metallkörpern markieren (Coils), die intraoperativ unter Verwendung eines Bildverstärkers der besseren Orientierung dienen können (Abb. 2).
Die Computertomografie (CT) wird routinemäßig im Rahmen der Staging-Untersuchungen (Ganzkörper-CT) eingesetzt. Im Rahmen der Nachsorge erfolgt mittels Thorax-CT die Kontrolle der Lunge (Tabelle 1), die die mit Abstand häufigste Lokalisation einer Filialisierung bei Extremitäten-Sarkomen ist. Zur Planung knöcherner Eingriffe am Becken kann die CT ebenfalls sinnvoll beitragen.

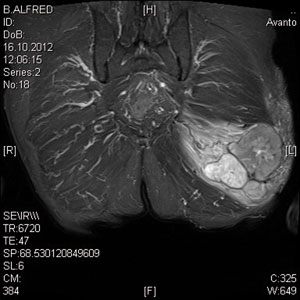
Die beste Weichteildarstellung erzielt man mit der Magnetresonanztomografie (MRT). Die Darstellung von Gefäßen und Nerven ist für die präoperative Planung entscheidend. Weichteilsarkome sind in der Regel von einer reaktiven Zone umgeben. Auch diese lässt sich am besten mittels MRT darstellen (Abb. 3). Dies hat besondere Bedeutung für die Festlegung der Resektionsgrenzen, da sich in dieser Zone variable Tumorzellen (Satelliten) befinden können. Die präoperative Darstellung des gesamten Kompartiments senkt das Risiko, Satellitenherde zu übersehen.
Die Positronenemissionstomografie (PET) wird bei Sarkom-Patienten derzeit bei speziellen Fragestellungen eingesetzt. Bewährt hat sie sich in der klinischen Routine bei Patienten mit Neurofibromatose und vermuteter solitärer maligner Entartung (MPNST).
Besteht nach Abschluss der nicht-invasiven Diagnostik weiterhin der Verdacht auf einen malignen Tumor, ist die histopathologische Sicherung indiziert. Es ist sinnvoll, bei subfaszialer Lage und einem Durchmesser > 5 cm den Patienten in eine spezialisierte Klinik zu überweisen, die ihn auch definitiv versorgen kann. Im eigenen Patientengut war das Risiko für ein Lokalrezidiv bei auswärts voroperierten Patienten um den Faktor 2,7 höher als bei Patienten mit primärer Biopsie am Comprehensive Cancer Center in Tübingen.
Biopsie
Das Ziel ist, so schonend wie möglich vorzugehen und dennoch sicher und zügig eine verlässliche histopathologische Diagnose des Tumors zu erzwingen, die Grundlage für weitere therapeutische Planungen und prognostische Aussagen ist.
Dabei kann die Gewebeprobe perkutan oder offen erfolgen. Beide Verfahren haben Vor- und Nachteile. Die perkutane Stanzbiopsie zeichnet sich durch ein minimales Trauma aus. Unter Berücksichtigung limitierter Ressourcen und ökonomischer Aspekte wird sie zunehmend in der eigenen Routine im ambulanten Betrieb eingesetzt. Die Menge an gewonnenem Gewebe ist aber beschränkt. Bei anatomisch schwieriger Lage des Tumors kann man die Punktion CT- oder MRT-gesteuert durchführen. Bei der offenen Probengewinnung lässt sich ein größeres Volumen an Tumorgewebe sichern. Dies ist v. a. für die verschiedenen immunhistopathologischen Untersuchungen und für den Ausbau von Gewebebanken (Forschung) von Vorteil.
Häufig werden bei der Durchführung der Biopsien Fehler begangen, die die definitive tumorchirurgische Versorgung erschweren bzw. eine Extremitäten-erhaltende Operation unmöglich machen und die Prognose des Patienten verschlechtern (Abb. 4). Insbesondere sind folgende Punkte zu beachten [13]:
• Vorliegen der vollständigen Bildgebung zum Lokalbefund präoperativ.
• Ausrichtung der Inzision, sodass der Zugang bei definitiver Operation spindelförmig exzidiert werden kann.
• Zugang direkt durch den Muskel ohne Kontamination mehrerer Kompartimente oder Darstellung von Nerven und Gefäßen.
• Ausleitung von Drainagen im Wundwinkel ohne Kontamination weiteren Gewebes.
• Längsinzision entlang der Achse der Extremität.
• Sorgfältige Blutstillung und wasserdichte Faszien-Naht, um postoperative Hämatome zu vermeiden.
• Gewinnung einer ausreichend großen und repräsentativen Probe. Vitale periphere Anteile sind wesentlich ergiebiger als zentrale Tumorbereiche, die häufig bereits nekrotisch sind.
• Atraumatische Operationstechnik mit sparsam greifender Hautnaht.
Interdisziplinäre Therapie
Am eigenen Zentrum erfolgt im Rahmen der interdisziplinären Sarkomkonferenz zwischen Tumorchirurg, Onkologe, Pathologe, Strahlentherapeut und Radiologe die Konsensusbildung über das weitere sinnvolle Vorgehen. Eine primäre Operation ohne diese Diskussion muss heute als obsolet gelten.
V. a. wird die Entscheidung über die zeitliche Reihenfolge der möglichen Therapien gemeinsam getroffen. Im Rahmen klinischer Studien erhalten die eigenen Patienten mit entdifferenzierten Sarkomen (G2–3) nach Möglichkeit neoadjuvant eine Radio-/Chemotherapie. Hierdurch kann man eine Verbesserung der Gesamtprognose erzielen. Darüber hinaus wird durch eine mögliche Verkleinerung des Tumors, eine Verringerung der reaktiven Zone und das Zurückdrängen in ein Kompartiment u. U. ein größerer Abstand zu Nerven, Gefäßen und Knochen erreicht. Damit verbessern sich die Chancen für den Operateur, trotz weiter Resektion lokal funktionserhaltend operieren zu können.
Ist bereits bei der präoperativen Planung die Wahrscheinlichkeit für eine R0-Resektion gering, sollte man weitere adjuvante Maßnahmen wie die Einlage von Kathetern zur postoperativen Brachytherapie, die direkte intraoperative Bestrahlung oder die isolierte Extremitäten-Perfusion prüfen [4], bevor man die Entscheidung zur Amputation fällt.
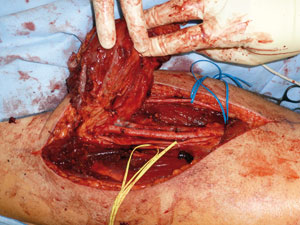
Tumorresektion
Behandlungsziel ist ein tumorfreies Überleben bei möglichst vollständig erhaltener Funktion der Extremität und minimalem Risiko für perioperative Komplikationen. Prognostisch wichtigster Bestandteil der lokalen Sarkom-Therapie ist dabei die operative Tumorentfernung (R0-Resektion). Das Risiko eines Lokalrezidivs korreliert direkt mit dem tumorfreien Abstand zum Resektat-Rand [9, 12]. Nur in palliativer Situation mit generalisierter Filialisierung ist aufgrund der damit verbundenen Morbidität die lokale Resektion hinter die dann in den Vordergrund rückende systemische Therapie zurückzustellen.
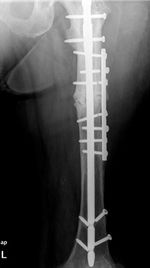
Den Standard in der operativen Therapie sieht man derzeit in der weiten Resektion [7]. Das heißt, die Resektionslinien verlaufen durch gesundes Gewebe und der Tumor wird en bloc ohne Eröffnung entfernt (Abb. 5). Ein chirurgisch weiter Abstand kann unterschiedlich groß ausfallen, abhängig von den Barriere-Eigenschaften der einzelnen Gewebe. So sind Faszien oder Periost eine stärkere Barriere für den Tumor mit höherer biologischer Wertigkeit und schon 1–2 mm sind hier als weit anzusehen. Bei Fett- und Muskelgewebe wird im Allgemeinen 2–3 cm als ausreichender Sicherheitsabstand gewertet, von anderen Arbeitsgruppen auch geringere Abstände [10, 12].
Intraläsionales oder marginales Vorgehen führen unweigerlich zum Lokalrezidiv und sollten bei kurativem Therapieanspruch unterbleiben. Bei der akzidentellen intraoperativen Tumoreröffnung ist für die weitere adjuvante Behandlung von einem R1-Zustand auszugehen.
Bei geringem Sicherheitsabstand oder einer R1-Situation in der histopathologischen Aufarbeitung ist die Möglichkeit der Nachresektion zu überprüfen. Auch wenn der Zweiteingriff regelmäßig deutlich ausgedehnter und in der Rekonstruktion aufwendiger ausfällt, rechtfertigt die Verbesserung der Prognose in Bezug auf das Lokalrezidiv-Risiko dieses Vorgehen [6]. Gleiches gilt für Patienten nach akzidenteller Sarkom-Entfernung im Rahmen einer „Woops“-Operation.
Auch unter Einsatz moderner neoadjuvanter Behandlungsmethoden ist bei extra-kompartimenteller Lokalisation des Tumors (Fossa poplitea, Rückfuß, Ellenbeuge) im Einzelfall eine Amputation notwendig, um onkologisch adäquat resezieren zu können. International wird in Sarkom-Zentren von einem Anteil Extremitäten-erhaltender Sarkomresektionen von 90% berichtet. Im eigenen Patientengut wird mit dieser Strategie eine lokale Rezidivrate von unter 10% erreicht.
Bei generalisiertem Tumorleiden mit diffuser Fernmetastasierung ist eine palliative Therapie mit Wahrung der Lebensqualität indiziert. Bei diesen Patienten sind ausgedehnte Eingriffe mit hoher Morbidität oder Mutilation nicht angezeigt. Im Einzelfall kann auch die Metastasenresektion sinnvoll sein.
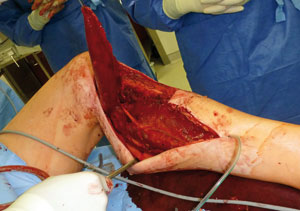
Komplikationen
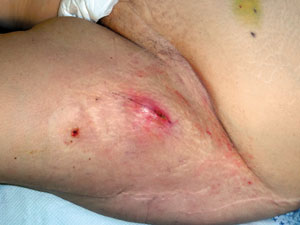
Wundheilungsstörungen und Infektionen stellen die häufigsten perioperativen Komplikationen der Sarkom-Chirurgie dar. In Abhängigkeit von der neoadjuvanten Vorbehandlung mit Radio- und Chemotherapie werden Inzidenzen von 15–50% angegeben. Als negative Prädiktoren sind ein hohes Patientenalter, eine große Wundhöhle mit Hämatom- oder Serom-Bildung sowie ein hoher intraoperativer Blutverlust mit Transfusionsbedürftigkeit bekannt. Eine spannungsfreie Weichteildeckung zur Verringerung des Risikos kann häufig nur mit plastischen Maßnahmen (Lappenplastik, Mesh graft) erreicht werden (Abb. 6).

Eine postoperative Drainage-Ableitung unter konsequenter Kompressionsbehandlung hat sich in der eigenen Routine bewährt (elastische Wickelung). Abweichend zum allgemeinen Vorgehen in der elektiven Extremitätenchirurgie ist eine vorübergehende Immobilisierung (2–5 Tage) und eine prophylaktische Antibiotika-Gabe bis zum Abschluss der Wundheilung sinnvoll, insbesondere nach neoadjuvanter Radio-/Chemotherapie.
Bei manifesten Wundheilungsstörungen sind eine Revision mit Débridement und ggf. eine temporäre Vakuumversiegelung zur Konditionierung der Wundverhältnisse durchzuführen.
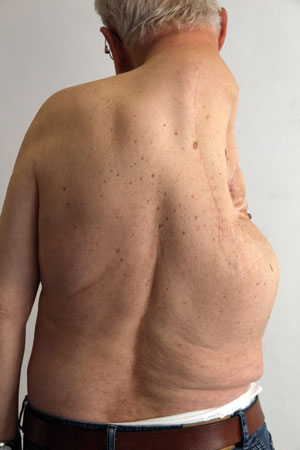
Längerfristig treten in Abhängigkeit vom Ausmaß der Resektion Lymphabfluss-Störungen mit Ödembildung auf. Hier ist die konsequente Kompressionsbehandlung mit Maßstrümpfen indiziert. Bedingt durch Narbenkontrakturen und post-radiogene Veränderungen (Gewebeinduration) werden Bewegungseinschränkungen und Gelenkkontrakturen beobachtet (Abb. 7). Diese sollten im Rahmen der klinischen Kontrolluntersuchungen (Tab. 1) frühzeitig mit physikalischen Maßnahmen und Physiotherapie behandelt werden.
Nachsorge
Das Risiko des Auftretens von Lungenmetastasen und Lokalrezidiv ist in den ersten beiden Jahren postoperativ am größten. Hier erfolgen die Kontrolluntersuchungen deshalb engmaschiger (Tab. 1). Über Häufigkeit und angewandte Modalitäten der Bildgebung herrscht keine Einigkeit in den verschiedenen Sarkomzentren [15]. In der eigenen Nachsorge-Ambulanz werden bei der Nachsorgefrequenz auch individuelle Gesichtspunkte berücksichtigt. Die Bildgebung sechs Wochen postoperativ stellt häufig noch postoperative Veränderungen (Serom, Signalstörung der Muskulatur) dar. Im Vergleich können aber mit den folgenden MRT-Untersuchungen leichter Befundungen erfolgen und reaktive Veränderungen von Lokalrezidiven differenziert werden.
Vorgehen bei Lokalrezidiv oder Filiae
Isolierte Lokalrezidive sind nach Möglichkeit erneut unter kurativer Zielsetzung zu resezieren. U. U. ist bei zu erwartender Funktionslosigkeit der Extremität die Ablation indiziert ([3], Abb. 8). Zuvor sollte man die Möglichkeit einer erstmaligen oder erneuten adjuvanten Behandlung überprüfen. Die Resektion vereinzelter Lungenfiliae hat einen positiven Effekt auf die Überlebenszeit der Sarkom-Patienten [11].
Literatur
1. Adigun IA, Rahman GAA. Review of soft tissue sarcoma. Niger J Med 2007; 16: 94-101.
2. Campanacci, M. Bone and soft tissue tumours. 2nd ed. Springer, New York 1999.
3. Clark MA, Thomas JM. Major amputation for soft tissue sarcoma. Br J Surg 2003; 90: 102-7.
4. Eggermont AM et al. Isolated limb perfusion with tumour necrosis factor and mephalan for limb salvage in 186 patients with locally advanced soft tissue extremity sarcomas. The cumulative multicenter European expierence. Ann Surg 1996; 224: 756-65.
5. Fletcher CDM et al. WHO classification of tumours of soft tissue and bone. IARC press 2013, Lyon.
6. Funovics P et al. The impact of re-excision of inadequately resected soft tissue sarcomas on surgical therapy, results and prognosis. J Surg Oncol 2010; 102: 626-633.
7. Leitlinien der Deutschen Gesellschaft für Orthopädie und Orthopädische Chirurgie: Weichteilsarkome. Dt. Ärzteverlag, 2. Auflage, Köln 2002.
8. Mankin HJ, Hornicek FJ. Diagnosis, classification and management of soft tissue sarcomas. Cancer Control 2005; 12: 5-21.
9. McKee MD et al. The prognostic significance of margin width for extremity and trunk sarcoma. J Surg Oncol 2004; 85: 68-76.
10. Rechl H et al. Weichteilsarkome. Epidemiologie, Diagnostik und Therapie. Orthopäde 2006; 35: 1269-78.
11. Rehders A et al. Benefit of surgical treatment of lung metastasis in soft tissue sarcoma. Arch Surg 2007; 142: 70-5.
12. Sampo M et al. Impact of the smallest surgical margin on local control in soft tissue sarcoma. Br J Surg 2008; 95: 237-43.
13. Scarborough MT. The biopsy. Instr Course Lect 2004; 53: 639-44.
14. Winkelmann W. Orthopädie und Orthopädische Chirurgie. Tumoren und tumorähnliche Erkrankungen. Thieme, Stuttgart New York 2005.
15. Yi-Sheng C et al. Follow-up after primary treatment of soft tissue sarcoma of the extremities: Impact of frequency of follow-up imaging on disease specific survival. J Surg Oncol 2012; Wiley Online Library.

Prof. Dr. Torsten Kluba
Orthopädische Universitätsklinik Tübingen
Hoppe-Seyler-Str. 3, 721076 Tübingen

