Pathologie und Molekularpathologie des Pankreaskarzinoms
Steffen Ormanns, Irene Esposito, Jens T. Siveke, Thomas Kirchner, Jens Neumann
Epidemiologie und Morphologie des Pankreaskarzinoms
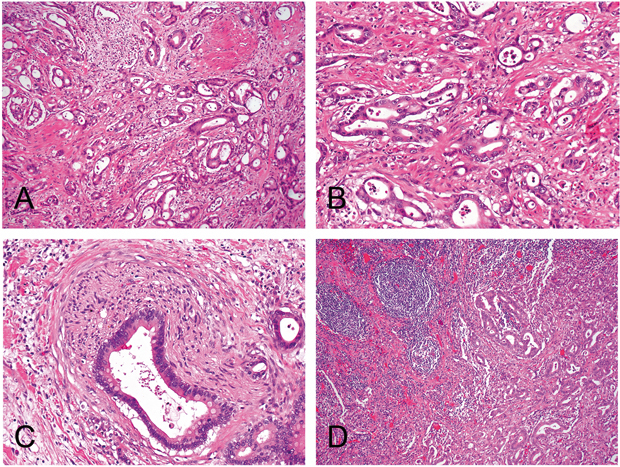
Tumoren des exokrinen Pankreas stellen bei Männern die neunthäufigste und bei Frauen die siebthäufigste Krebserkrankung dar und treten mit einer Inzidenz von 9,0 Fällen pro 100.000 Männer und 6,4 Fällen pro 100.000 Frauen auf. Männer erkranken in westlichen Industrienationen um nahezu 50% häufiger als Frauen (Geschlechtsrelation männlich/weiblich 1,6:1, [18]). Das Erkrankungsalter liegt meist zwischen 60 und 80 Jahren, extrem selten finden die Tumoren sich vor dem 40. Lebensjahr [24]. Meist sind sie im Kopf (60–70%), seltener im Korpus (5–15%) oder im Schwanz des Pankreas (10–15%) lokalisiert [4]. Die malignen epithelialen Tumoren des exokrinen Pankreas werden nach der WHO-Klassifikation von 2010 eingeteilt, wobei duktale Adenokarzinome mit 85–90% die weitaus häufigste Entität darstellen (Tab. 1, [4]). Histologisch zeigen diese Tumoren unregelmäßig gestaltete, zum Teil schleimbildende drüsige Strukturen mit duktaler Differenzierung in einem desmoplastischen Stroma (Abb. 1). Seltene Sonderformen des duktalen Adenokarzinoms sind in Tabelle 1 zusammengefasst. Davon abzugrenzen sind seltenere Entitäten wie das Azinuszellkarzinom (ca. 1–2% aller exokrinen Pankreasneoplasien), neuroendokrine Neoplasien (ca. 1–2% aller Pankreasneoplasien) sowie Karzinome, die sich von intraduktalen papillären muzinösen Neoplasien (IPMN) oder muzinös-zystischen Neoplasien (MCN) des Pankreas ableiten. Daneben können auch Mischformen der genannten Typen auftreten (Tabelle 1). Als Vorläuferläsionen der exokrinen Pankreaskarzinome werden neben der pankreatischen intraepithelialen Neoplasie Grad III (PanIN III) auch die IPMN und die MCN mit zumindest mäßiggradiger Dysplasie angesehen. Die solid-pseudopapilläre Neoplasie (SPN), eine seltene, niedrig-maligne Neoplasie des Pankreas, die vorwiegend bei jungen Frauen auftritt, wird hingegen nicht als Vorläufer des PDAC angesehen.
Molekulare Pathogenese des Pankreaskarzinoms
Der Prozess der Entartung einer „normalen“ zu einer malignen Pankreaszelle ist ein schrittweiser Vorgang, bei dem es zur progressiven Akkumulation genetischer und epigenetischer Veränderungen kommt. Histomorphologisch und genetisch ist für das PDAC ein Progressionsmodell mit verschiedenen Tumorvorläufer-Läsionen beschrieben worden. Ob die beiden häufigsten präneoplastischen Läsionen, PanIN und IPMN, die gleiche Ursprungszelle besitzen, ist ungeklärt. In der Mehrzahl der Fälle entwickelt sich das klassische duktale Adenokarzinom aus PanIN-Läsionen, die je nach Stadium zunehmende zelluläre, nukleäre und molekulare Anomalitäten akkumulieren [14]. Studien zeigen, dass höhergradige
PanIN bereits multiple genetische und molekulare Veränderungen aufweisen [14]. Neben einer onkogenen KRAS-Mutation, zumeist G12D oder G12V im Exon 2 als praktisch immer vorhandener Initiator-Mutation, die sich bereits in niedriggradigen PanIN-Läsionen nachweisen lässt, finden sich in hoher Frequenz Mutationen oder Deletionen in den Tumorsuppressor-Genen TP53, CDKN2a und SMAD4. Dabei sind CDKN2a und TP53 in > 80% der Karzinome verändert, während SMAD4 in 40–50% inaktiviert wird. Neben diesen vier wesentlichen Gen-Alterationen (KRAS, CDKN2A, TP53, SMAD4) sind Veränderungen weiterer Gene deutlich seltener, mit einer langen Liste von Genen, die in weniger als 5% der Fälle verändert sind. Zwei große Sequenzierungs-Studien konnten zeigen, dass in entwickelten PDAC multiple Gene und Signalwege verändert sind [2, 17]. Jones et al. definierten zwölf Signalwege, in denen assoziierte Gene in allen untersuchten Tumoren verändert waren und die zu den sogenannten hallmarks von Tumoren beitragen [17].
Obwohl das PDAC eine vergleichsweise geringe Variation in klinischem Verlauf und Therapieansprechen aufweist, haben individuelle Tumoren sehr unterschiedliche genetische Veränderungen. Die ausgeprägte chromosomale Instabilität und genetische Heterogenität mit zahlreichen Mutationen, Amplifikationen, Genverlusten und chromosomalen Rearrangements machen das Pankreaskarzinom zu einer genetisch komplexen Erkrankung und sind eine mögliche Ursache für die ausgeprägte Therapieresistenz dieser Tumorentität. Die derzeitige Schwierigkeit besteht u.a. darin, relevante (sog. driver mutations) von irrelevanten (passenger) Veränderungen zu differenzieren.
TNM-Klassifikation, histopathologische Aufarbeitung und Bedeutung des Resektionsstatus
Die TNM-Klassifikation des duktalen Pankreaskarzinoms erfolgt nach den Vorgaben der UICC (7. Auflage 2009, Tab. 2), die histologische Einteilung der verschiedenen Subtypen und die Graduierung (Tab. 3) nach den Kriterien der aktuellen WHO-Klassifikation von 2010 [4].
Zum Zeitpunkt der Operation liegen bei der Mehrheit (> 80%) der primär resektablen duktalen Pankreaskarzinome ein organüberschreitendes Wachstum und regionäre Lymphknotenmetastasen vor, entsprechend einem pT3N1-Stadium [8, 16, 25]. Eine Ausnahme sind die invasiven Adenokarzinome, die auf dem Boden einer IPMN oder einer MCN entstehen und häufiger in früheren Stadien (pT1/pT2) diagnostiziert werden [6, 22].
Tumoren des Pankreaskopfes zeigen häufig eine Infiltration des intrapankreatischen Gallengangs und/oder des Duodenums, während eine Infiltration der Milz, des Magens, des Kolons und der linken Nebenniere seltener bei Tumoren des Korpus-Schwanzes beobachtet wird. Sehr häufig ist außerdem die Ausbreitung des Tumors in das peripankreatische Fettgewebe und eine Infiltration der Perineuralscheiden (Pn1-Stadium). Eine mikroskopische Invasion von Lymph- oder Blutgefäßen (entsprechend L1 bzw. V1) wird mit unterschiedlicher Frequenz beobachtet, in Abhängigkeit von der Anzahl der untersuchten Tumorproben und der angewendeten histopathologischen Kriterien (intra- versus peritumorale Angioinvasion, [8, 25]). Lymphknotenmetastasen treten zunächst in den regionären Stationen (peripankreatische Lymphknoten, Lymphknoten des Ligamentum hepatoduodenale, entlang der A. hepatica communis und der A. mesenterica superior) auf, weitere Stationen (paraaortale und parakavale Lymphknoten) sind bei weniger als 10% der primär resektablen duktalen Adenokarzinome befallen [38] und werden als Fernmetastasen (pM1) nach TNM kategorisiert. Die aktuelle TNM-Klassifikation fordert für eine korrekte Klassifikation die Untersuchung von mindestens zehn Lymphknoten. Die neue S3-Pankreaskarzinom-Leitlinie empfiehlt die Angabe der Lymphknoten-Ratio (Verhältnis von befallenen zu resezierten Lymphknoten), die einen prognostisch relevanten Marker bei einem Grenzwert von 0,2 darstellt [31]. Eine peritoneale Ausbreitung und/oder hämatogene Fernmetastasen werden in mehr als 50% der PDAC bei Diagnosestellung beobachtet [27]. Hämatogene Fernmetastasen befinden sich primär in der Leber (in etwa zwei Dritteln der Fälle bei primärer Metastasierung), in fortgeschrittenen Stadien in der Lunge, im Skelett und selten im Gehirn [9]. Die Tumorgröße bzw. das lokale Wachstum (pT-Kategorie), die Lymphknoten-Ratio und der M-Status sind in einer der größten chirurgischen Serien der letzten Jahre unter den wichtigsten prognostisch relevanten Faktoren [13].
Ein weiterer prognostisch relevanter histopathologischer Faktor für das duktale Adenokarzinom ist das dreistufige Grading (G1–G3, [5, 13]), das nach zytologischen Kriterien und der Bestimmung der Mitoserate erfolgt (Tab. 3).

Eine standardisierte Aufarbeitung der Resektionspräparate erlaubt somit eine sorgfältige und reproduzierbare Beurteilung von Faktoren, die prognostische Bedeutung besitzen und besonders relevant sind, wenn sie im klinischen Kontext interpretiert und in multizentrischen Studien verglichen werden [19, 35]. Aufgrund der aggressiven Biologie und des infiltrativen Wachstums des duktalen Pankreaskarzinoms [35] sowie der ungünstigen anatomischen Lage des Organs liegt bei solchen Protokollen ein besonderes Augenmerk auf der Feststellung von mikroskopischem residualem Tumorgewebe (R-Status). Bei der histologischen Aufarbeitung der Operationspräparate müssen durch den Pathologen alle Resektionsflächen auf Tumorfreiheit überprüft werden, wobei die zirkumferenziellen Resektionsränder bzw. -flächen, nämlich die dorsale, die mediale (zur Gefäßfurche) und die ventrale Fläche besondere Bedeutung haben. Der Gallengangs-Absetzungsrand (bei Pankreaskopf-Resektaten) und der Absetzungsrand (AR) zum Pankreasparenchym werden gemäß Empfehlung der S3-Leitlinie im Schnellschnitt untersucht, während die AR vom Magen (bei klassischen Kausch-Whipple-Resektionen) und Duodenum äußerst selten infiltriert sind und in der Regel nicht im Schnellschnitt untersucht werden müssen [8, 29].
Standardisierte Protokolle für die Aufarbeitung der Operationspräparate im frischen oder fixierten Zustand basieren auf einer farbigen Markierung der Resektionsränder/-flächen, gefolgt von einer axialen Lamellierung in dünne (0,3–0,5 cm) Scheiben und die Einbettung von Tumorgewebe mit Bezug zu jedem AR und zu jeder für das Staging relevanten anatomischen Struktur. Diese Art der Aufarbeitung erlaubt eine genaue Korrelation der morphologischen Ergebnisse mit der Schnitt-Bildgebung; darüber hinaus kann histologisch genau gemessen werden, wie weit die Tumorzellen von den jeweiligen Resektionsrändern entfernt sind. In Analogie zur R-Klassifikation des Rektumkarzinoms, werden die zirkumferenziellen Resektionsränder als „positiv“ (CRM+) klassifiziert, wenn der Abstand der Tumorzellen zum Resektionsrand ≤ 1 mm beträgt. Hier werden sowohl der Haupttumorherd (direkte Infiltration) als auch Lymphknotenmetastasen und Karzinominfiltrate in Perineuralscheiden, Lymph- und Blutgefäße (lokoregionale Ausbreitung/Metastase) berücksichtigt [8].
Die Anwendung solcher Protokolle hat gezeigt, dass die zirkumferenziellen dorsalen und medialen (zur Gefäßfurche) Ränder am häufigsten positiv sind bei einer R1-Rate von insgesamt > 70% [36]. Diese hohe R1-Rate spiegelt die lokale Rezidivrate [21], das infiltrative Wachstum und somit die aggressive Biologie [20] des duktalen Pankreaskarzinoms wieder. Sie ist zudem eine der wichtigsten prognostischen Faktoren des duktalen Pankreaskarzinoms [13] und stellt einen Qualitätsindikator einer hoch-standardisierten und somit reproduzierbaren pathologischen Aufarbeitung dar [30].
Die standardisierte Aufarbeitung der Pankreas-Resektate und die Bestimmung der R-Situation nach dem CRM-Konzept werden in der aktuellen S3-Pankresakarzinom-Leitlinie empfohlen [26, 31]. Außerdem wurde die wichtige prognostische Bedeutung einer sog. „R0-close“-Resektion (d. h. mit einem Abstand der Tumorzellen zum AR von ≤ 1 mm) auch in der US-amerikanischen Literatur [10, 23] und in den Leitlinien des National Comprehensive Cancer Network (NCCN) von 2014 (www.nccn.org) neulich anerkannt. Eine standardisierte Aufarbeitung und eine national und international einheitliche Klassifikation sind Voraussetzungen für eine verbesserte Vergleichbarkeit von Studien und für das Erzielen von aussagekräftigeren klinisch-pathologischen Korrelationen.
Stellenwert der Biopsie in der Diagnostik des Pankreaskarzinoms
Bei primärer Inoperabilität klinisch-radiologisch tumorverdächtiger Läsionen des Pankreas, sowie bei klinisch-radiologisch metastasenverdächtigen Leberherden, ist nach wie vor die Abklärung durch Biopsie-basierte histopathologische Diagnostik Goldstandard [31]. Häufig entstehen Missverständnisse zwischen klinisch tätigen Ärzten und Pathologen aus den Erwartungen, was die histopathologische Diagnostik einer solchen Biopsie leisten kann und was nicht. Die diagnostisch stärkste Aussagekraft liegt hierbei im Nachweis maligner Neoplasien, da bei Abwesenheit maligner Zellen in der Biopsie auch die Möglichkeit einer Fehlbiopsie („sampling error“) besteht. Für die Diagnostik des PDAC stehen bislang keine spezifischen Marker zur Verfügung. Beim Nachweis von Infiltraten eines Adenokarzinoms kann lediglich anhand der Morphologie (duktales Wachstumsmuster) und eines begrenzten Panels immunhistochemischer Marker (Positivität der Tumorzellen für CK7, CK19, MUC1, CEA und CA19.9) die Herkunft der Neoplasie auf das Pankreas, die ableitenden Gallenwege oder den Magen eingegrenzt werden. Die diagnostische Wertigkeit von SMAD4 wurde in letzter Zeit immer wieder diskutiert. In bis zu 55% der PDAC wird ein Ausfall dieses Proteins beschrieben [12]. Da sich ein Verlust der SMAD4-Expression aber auch in zahlreichen anderen Karzinomen des Gastrointestinaltraktes nachweisen lässt [7], handelt es sich nicht um einen organspezifischen Marker. Der diagnostische Nutzen der SMAD4-Immunhistochemie liegt vielmehr in der Abgrenzung von regeneratorischen Epithelveränderungen von dysplastischen Veränderungen oder von Infiltraten eines PDAC, was in der Biopsie-Diagnostik eine große Herausforderung darstellt, da meist nur spärliche Tumoranteile erfasst sind.
Eine weiterführende Zuordnung der Primärlokalisation ist immunhistochemisch mithilfe der derzeit zur Verfügung stehenden Marker nicht möglich. Für die Eingrenzung der Primärlokalisation ist beim entsprechenden morphologischen und immunhistochemischen Befund somit das klinisch-radiologische Bild (Herdbefund im Pankreas, Lokalisation der Haupttumormasse, Metastasen-typischer Leberherd) ausschlaggebend. Bei metastatischen Leberherden kann darüber hinaus mittels spezifischer Gewebsmarker die Herkunft aus dem Dickdarm (CK20+, CDX-2+), der Lunge (TTF-1+), der Prostata (PSA+) oder der Mamma (GATA3+, Hormonrezeptoren+) ausgeschlossen werden. In Zusammenschau mit dem radiologischen und klinischen Befund kann so in der Regel die Diagnose eines Pankreaskarzinoms mit ausreichender Sicherheit gestellt werden. Darüber hinaus hat das Biopsiematerial einen unschätzbaren Wert in der translationalen Forschung und somit für eine zukünftige Verbesserung von Diagnostik, Therapie und Prävention.
Prognostische und prädiktive Biomarker des Pankreaskarzinoms
Trotz der intensiven präklinischen und translationalen Forschungsbemühungen der vergangenen Jahre, haben sich beim duktalen Adenokarzinom des Pankreas bisher nur wenige Moleküle als nützliche Biomarker erwiesen. Sie lassen sich in prognostische und prädiktive Marker unterteilen. Prognostische Marker erlauben Aussagen über das Überleben eines Patienten oder das Fortschreiten der Erkrankung, während prädiktive Marker das Ansprechen des Tumors auf eine bestimmte Therapie voraussagen können. Teilweise erfüllen Biomarker auch beide Funktionen. Da es sich hierbei jedoch lediglich um statistische Zusammenhänge handelt, sind auch mithilfe der besten Biomarker bisher keine absoluten Aussagen möglich.
Prognostische Biomarker
KRAS
Das Protein KRAS ist ein essenzieller Bestandteil des MAPK-Signalweges, der die Wirkungen von Wachstumsfaktor-Rezeptoren (u. a. EGFR) vermittelt. KRAS spielt eine herausragende Rolle in der Tumorigenese von PDAC, da sich hier in der großen Mehrzahl aktivierende KRAS-Mutationen finden, je nach Quelle in bis zu 90% aller Fälle. Im Gegensatz zum kolorektalen Karzinom, hat sich das Vorliegen einer KRAS-Mutation jedoch bisher nicht als prädiktiver Marker für eine gegen EGFR gerichtete Tumortherapie, sondern als prognostischer Marker erwiesen: Patienten ohne Nachweis einer KRAS-Mutation zeigten in mehreren Studien ein signifikant besseres Überleben [3, 32]. Deshalb kann der KRAS-Wildtyp-Status eines Patienten als prognostisch günstig angesehen werden.
SMAD4
SMAD4 ist ein Protein, das bei der Weitergabe der Signale des TGFβ-Signaltransduktionswegs eine wichtige Rolle spielt und in PDAC häufig mutiert oder deletiert ist. Verlust der SMAD4-Expression wurde mit vermehrtem Auftreten von Fernmetastasen, Lymphgefäßinvasion und Lymphknotenmetastasen assoziiert [15]. Darüber hinaus waren Patienten mit intakter SMAD4-Expression länger krankheitsfrei und wiesen ein besseres Gesamtüberleben auf [28, 34]. Interessanterweise zeigte eine größere Studie an resezierten PDAC, dass Patienten mit Verlust der SMAD4-Expression wesentlich besser auf adjuvante Chemotherapie ansprachen als Patienten mit erhaltener SMAD4-Expression [1]. Somit könnte SMAD4 auch als prädiktiver Marker adjuvanter Chemotherapien eine Rolle spielen.
Prädiktive Biomarker
hENT1
Das Transmembranprotein human equilibrative nucleoside transporter 1 (hENT1) ist entscheidend für die Aufnahme des Standard-Chemotherapeutikums Gemcitabin in Pankreaskarzinom-Zellen. Zahlreiche retrospektive translationale Studien konnten zeigen, dass mit Gemcitabin therapierte Patienten mit hoher hENT1-Expression gegenüber Patienten mit niedriger hENT1-Expression einen deutlichen Überlebensvorteil aufwiesen, während sich kein Unterschied in den mit 5-FU behandelten Gruppen ergab [11]. Um das Ansprechen auf Chemotherapie von Patienten mit niedriger hENT1-Expression zu verbessern, wurde deshalb
CO-101, ein modifiziertes Gemcitabin-Derivat, entwickelt, das hENT1-unabhängig in die Zelle aufgenommen wird. Trotz vielversprechender präklinischer Ergebnisse ergab sich in der prospektiven LEAP-Studie an Patienten mit metastasiertem PDAC unabhängig vom hENT1-Expressionsstatus kein Vorteil von CO-101 gegenüber Gemcitabin. Interessanterweise konnte in der Studie auch kein Überlebensvorteil hoher hENT1-Expression unter Gemcitabin-Therapie festgestellt werden. hENT1-Expression ist daher möglicherweise nur in der adjuvanten Situation ein Biomarker für die Effizienz einer Gemcitabin-Therapie.
SPARC
PDAC weisen häufig ein ausgeprägtes desmoplastisches Stroma auf, das als potenzielle Barriere für Chemotherapeutika und somit als therapeutisches Ziel angesehen wird. Die Expression des Proteins SPARC (auch bekannt als Osteonektin-1) wird häufig im desmoplastischen Stroma von PDAC nachgewiesen und korreliert mit schlechtem Überleben von PDAC-Patienten [33]. SPARC ist darüber hinaus der Rezeptor für an Nanopartikel-Albumin gebundenes Paclitaxel (nab-Paclitaxel), das entwickelt wurde, um die Verträglichkeit dieses Chemotherapeutikums zu verbessern. Im Einklang mit präklinischen Daten profitierten Patienten mit hoher stromaler SPARC-Expression deutlich besser von einer nab-Paclitaxel/Gemcitabin-Kombinationstherapie als Patienten mit niedriger SPARC-Expression im Tumorstroma [37]. Ob sich diese vielversprechenden Ergebnisse in größeren Studien validieren lassen, muss in Zukunft noch gezeigt werden.
Literatur
1. Bachet JB et al. Contribution of CXCR4 and SMAD4 in predicting disease progression pattern and benefit from adjuvant chemotherapy in resected pancreatic adenocarcinoma. Ann Oncol 2012; 23: 2327-35.
2. Biankin AV et al. Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes. Nature 2012; 491: 399-405.
3. Boeck S et al. EGFR pathway biomarkers in erlotinib-treated patients with advanced pancreatic cancer: translational results from the randomised, crossover phase 3 trial AIO-PK0104. Br J Cancer 2012; 108: 469-76.
4. Bosman FT et al. WHO classification of tumours of the digestive system. World Health Organization 2010.
5. Cameron JL et al. One thousand consecutive pancreaticoduodenectomies. Ann Surg 2006; 244: 10-5.
6. Crippa S et al. Mucinous cystic neoplasm of the pancreas is not an aggressive entity: Lessons from 163 resected patients. Ann Surg 2008; 247: 571-9.
7. Duff E, Clarke A. Smad4 (DPC4) - a potent tumour suppressor? Br J Cancer 1998; 78: 1615-9.
8. Esposito I et al. Most pancreatic cancer resections are R1 resections. Ann Surg Oncol 2008; 15: 1651-60.
9. Fletcher CD. Diagnostic Histopathology of Tumors: Expert Consult-Online. Elsevier Health Sciences 2013.
10. Gnerlich JL et al. Microscopic margins and patterns of treatment failure in resected pancreatic adenocarcinoma. Arch Surg 2012; 147: 753-60.
11. Greenhalf W et al. Pancreatic cancer hENT1 expression and survival from gemcitabine in patients from the ESPAC-3 Trial. J Natl Cancer Inst 2013; 106: djt347.
12. Hahn SA et al. DPC4, a candidate tumor suppressor gene at human chromosome 18q21.1. Science 1996; 271: 350-353.
13. Hartwig W et al. Pancreatic cancer surgery in the new millennium: Better prediction of outcome. Ann Surg 2011; 254: 311-9.
14. Hruban RH et al. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol 2004; 28: 977-87.
15. Iacobuzio-Donahue CA et al. DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer. J Clin Oncol 2009; 27: 1806-13.
16. Jamieson NB et al. Positive mobilization margins alone do not influence survival following pancreatico-duodenectomy for pancreatic ductal adenocarcinoma. Ann Surg 2010; 251: 1003-10.
17. Jones S et al. Core signaling pathways in human pancreatic cancers revealed by global genomic analyses. Science 2008; 321: 1801-6.
18. Kaatsch P et al. Robert Koch-Institut; Gesellschaft der epidemiologischen Krebsregister in Deutschland eV, Hrsg. Krebs in Deutschland 2007/2008. Berlin: Robert Koch-Institut: 2012. Beiträge zur Gesundheitsberichterstattung des Bundes). Verfügbar unter: www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsB/KID2012. pdf.
19. Katz MH et al. Standardization of surgical and pathologic variables is needed in multicenter trials of adjuvant therapy for pancreatic cancer: Results from the ACOSOG Z5031 trial. Ann Surg Oncol 2011; 18: 337-44.
20. Kimbrough CW et al. Tumor-positive resection margins reflect an aggressive tumor biology in pancreatic cancer. J Surg Oncol 2013; 107: 602-7.
21. Kleeff J et al. Surgery for recurrent pancreatic ductal adenocarcinoma. Ann Surg 2007; 245: 566-72.
22. Koh YX et al. Systematic review and meta-analysis comparing the surgical outcomes of invasive intraductal papillary mucinous neoplasms and conventional pancreatic ductal adenocarcinoma. Ann Surg Oncol 2014; 21: 2782-800.
23. Konstantinidis IT et al. Pancreatic ductal adenocarcinoma: Is there a survival difference for R1 resections versus locally advanced unresectable tumors? What is a "true" R0 resection? Ann Surg 2013; 257: 731-6.
24. Luttges J et al. Rare ductal adenocarcinoma of the pancreas in patients younger than age 40 years. Cancer 2004; 100: 173-82.
25. Menon KV et al. Impact of margin status on survival following pancreatoduodenectomy for cancer: The Leeds Pathology Protocol (LEEPP). HPB (Oxford) 2009; 11: 18-24.
26. Munding J et al. [Update of the S3 guidelines for pancreatic cancer : What is new for pathologists?]. Pathologe 2014; 35: 509-20.
27. Niederhuber JE et al. The National Cancer Data Base report on pancreatic cancer. Cancer 1995; 76: 1671-7.
28. Oshima M et al. Immunohistochemically detected expression of 3 major genes (CDKN2A/p16, TP53, and SMAD4/DPC4) strongly predicts survival in patients with resectable pancreatic cancer. Ann Surg 2013; 258: 336-46.
29. Schlitter AM, Esposito I. Definition of microscopic tumor clearance (r0) in pancreatic cancer resections. Cancers (Basel) 2010; 2: 2001-10.
30. Schmidt T et al. Chirurgie des Pankreaskarzinoms-Qualitätssicherung. Viszeralchirurgie 2007; 42: 89-93.
31. Seufferlein T et al. S3-guideline exocrine pancreatic cancer. Zeitschrift für Gastroenterologie 2013; 51: 1395-440.
32. Sinn BV et al. KRAS mutations in codon 12 or 13 are associated with worse prognosis in pancreatic ductal adenocarcinoma. Pancreas 2014; 43: 578-83.
33. Sinn M et al. SPARC expression in resected pancreatic cancer patients treated with gemcitabine: Results from the CONKO-001 study. Ann Oncol 2014; 25: 1025-32.
34. Tascilar M et al. The SMAD4 protein and prognosis of pancreatic ductal adenocarcinoma. Clin Cancer Res 2001; 7: 4115-21.
35. Verbeke CS. Resection margins and R1 rates in pancreatic cancer--are we there yet? Histopathology 2008; 52: 787-96.
36. Verbeke CS. Resection margins in pancreatic cancer. Surg Clin North Am 2013; 93: 647-62.
37. Von Hoff D et al. SPARC correlation with response to gemcitabine (G) plus nab-paclitaxel (nab-P) in patients with advanced metastatic pancreatic cancer: A phase I/II study. J Clin Oncol 2009; 27(15S) (ASCO 2009, Abstract #4525).
38. Yamada S et al. Pancreatic cancer with distant metastases: A contraindication for radical surgery? Hepatogastroenterology 2009; 56: 881-5.

Steffen Ormanns
Prof. Dr. med. Thomas Kirchner
Dr. med. Dr. med. univ. Jens Neumann
Pathologisches Institut der Universität München
Thalkirchner Straße 36
80337 München
+49 89 2180 73632
+49 89 2180 73727
Korrespondierender Autor:
steffen.ormanns[at]med.uni-muenchen[dot]de
Prof. Dr. med. Irene Esposito
Institut für Allgemeine Pathologie und
Pathologische Anatomie
Technische Universität München
Ismaninger Straße 22
81675 München
Prof. Dr. med. Jens T. Siveke
II. Medizinische Klinik und Poliklinik
Klinikum rechts der Isar
Technische Universität München
Ismaninger Straße 22
81675 München

