Chirurgische Therapie des Pankreaskarzinoms – ein Update
Alexander Gluth, Axel Kleespies, Jens Werner, Werner Hartwig
Das Pankreaskarzinom ist eine der aggressivsten Tumorerkrankungen weltweit. In den USA und Europa stellt es trotz großer Fortschritte in der Krebstherapie eine der fünf häufigsten Krebstodesursachen dar. Die 5-Jahres-Überlebensraten reichen beim Pankreaskarzinom insgesamt gerade an 5% heran. Einzige mögliche Heilungsoption ist die Chirurgie, eingebettet in ein multimodales Konzept. Bei Patienten, bei denen ein operatives Vorgehen möglich ist, verfünffacht sich die 5-Jahres-Überlebensrate auf mehr als 20% [38, 39]. Die Pankreaschirurgie ist gleichzeitig an spezialisierten Zentren deutlich sicherer geworden [21]. So sind 5-Jahres-Überlebensraten von über 50% durch vollständige Tumorentfernung, gepaart mit günstiger Tumorbiologie, in bestimmten Patientengruppen möglich [24, 33, 36].
Kriterien einer vergleichsweise günstigen Prognose sind unter anderem: die Diagnose des Tumors in einem frühen Stadium mit zeitnaher Vorstellung zur Operation, Verringerung der perioperativen Sterblichkeit durch Minimierung chirurgischer Komplikationen und adäquates Komplikationsmanagement, Reduktion der Wahrscheinlichkeit eines Lokalrezidivs bzw. von Fernmetastasen durch vollständige Tumorresektion zusammen mit einer angepassten neoadjuvanten bzw. adjuvanten Therapie [27]. Alle diagnostisch-therapeutischen Maßnahmen sollten sich folglich an den oben genannten Kriterien ausrichten.
Diagnostik
Einer der wichtigsten Faktoren für das Langzeitüberleben ist die Tumorgröße. Hochwertige bildgebende Verfahren sind deshalb unabdingbar, um kleine Tumoren möglichst früh zu entdecken. Für die Beurteilung der Resektabilität und des Stagings ist aktuell die Computertomografie in Dünnschichttechnik mit biphasischem Kontrastmittel und verbesserter Bildverarbeitung der Goldstandard [12]. Die Magnetresonanztomografie (MRT) mit Magnetresonanz-Cholangiopankreatikografie (MRCP) liefert keine zusätzlichen Informationen über die Resektabilität, sie kann allerdings helfen, zystische Pankreastumoren zu differenzieren. Die Endosonografie kann andere bildgebende Verfahren ergänzen. Kleine Tumoren lassen sich mit ihrer Hilfe gut identifizieren. Gleichzeitig ist die endosonografisch gesteuerte Gewebegewinnung im Sinne einer Feinnadelbiopsie die beste Methode der histologischen Sicherung, zum Beispiel vor palliativer Chemotherapie [12, 46]. Die Routinebiopsie vor chirurgischer Resektion ist allerdings nicht empfehlenswert, da ein sicherer Malignitätsausschluss nicht möglich ist [25]. Des Weiteren gibt es keine Empfehlung zur routinemäßigen endoskopischen retrograden Cholangiopankreatikografie (ERCP) oder 18F-Fluor-Desoxyglucose-Positronenemissionstomografie (18F-FDG-PET, [12, 46]).
Präoperative Gallengangs-Drainage
Die präoperative Gallengangs-Drainage im Sinn einer Stent-Platzierung in den Gallengang bei Patienten mit resektablem Pankreaskopfkarzinom und Ikterus scheint die Resektion negativ zu beeinflussen. Eine randomisierte Multicenter-Studie aus den Niederlanden ergab mehr perioperative Komplikationen bei Patienten mit präoperativer Gallengangs-Drainage bei einem Bilirubin-Wert < 15 mg/dl im Vergleich zu Patienten mit sofortiger Operation [49]. Ein Cochrane-Review zu diesem Thema zeigte ebenfalls keinen Vorteil für Patienten, aber deutlich erhöhte Krankenhauskosten [15]. Somit sollte die präoperative Gallengangs-Drainage Patienten mit geplanter neoadjuvanter Therapie oder sehr hohen Bilirubin-Werten und damit zusammenhängender Gerinnungsstörung vorbehalten bleiben [27].
Frühstadien, Vorläuferläsionen
In Anlehnung an die Adenom-Karzinom-Sequenz beim Kolonkarzinom zeigte sich, dass intraduktale papilläre muzinöse Neoplasien (IPMNs) und muzinöse zystische Neoplasien (MCNs) Vorläuferläsionen eines Pankreaskarzinoms sind. Heute führt man vermehrt bildgebendes Screening durch und entdeckt dadurch zystische Tumoren häufiger in einem frühen Stadium. Dadurch gelingt es, durch chirurgische Resektion Frühstadien eines Pankreaskarzinoms oder sogar Vorläuferläsionen kurativ zu entfernen, bevor diese zu bösartigen Tumoren entarten. Patienten, bei denen dieses möglich ist, haben exzellente Überlebensraten im Vergleich zu jenen mit fortgeschrittenem Pankreaskarzinom [51].
IPMNs können im Hauptgang (Ductus pancreaticus) ebenso wie in den Nebengängen des Pankreas entstehen und werden dann Haupt- (main-duct-type) oder Nebengang-IPMN (branch-duct-type) genannt. Wegen ihrer hohen Entartungstendenz ist die Hauptgang-IPMN eine prinzipielle Operationsindikation. Bei der Seitengang-IPMN wird die chirurgische Entfernung kontrovers diskutiert, was zu einer Revision der Leitlinien (Sendai-Kriterien) geführt hat [45]. Eine aktuelle Analyse von 287 resezierten IPMNs hat maligne Entartungen selbst bei kleinen Seitengang-IPMNs ohne Risikokriterien (nach den Sendai-Kriterien von 2006) gezeigt [17]. Selbst an High-volume-Zentren erfolgte in bis zu 30% der Fälle eine falsche präoperative Einschätzung bei zufällig diagnostizierten zystischen Neoplasien [14, 41]. Es ist daher umso wichtiger, Patienten mit IPMNs an erfahrenen Zentren interdisziplinär zu evaluieren. Nur so kann gewährleistet werden, dass die Entscheidung zwischen erneuter Kontrolle mittels Bildgebung oder aber chirurgischer Entfernung im Sinne des Patienten adäquat getroffen wird.
Wichtig dabei ist, dass ein gutartiges Seitengang-IPMN nicht durch zu lange Beobachtung die Möglichkeit zur Entartung in ein duktales Adenokarzinom erhält [48]. Bereits in der Vergangenheit hat eine US-Datenbankanalyse (1995-2004) gezeigt, dass 38% der Patienten mit Pankreaskarzinom-Frühstadien trotz fehlender Kontraindikationen für eine Operation nicht reseziert wurden [3]. Ihre 5-Jahres-Überlebensrate dieser Patienten betrug nur 2,9%, Patienten, die im gleichen Zeitraum operiert wurden, hatten eine fast zehnfach höhere Rate. Die negative Einstellung gegenüber einer potenziell kurativen Operation war wesentlich geringer an großen erfahrenen Zentren wie an Universitätskliniken oder nationalen Krebs-Zentren, als an kleineren Kliniken. Dieses Ergebnis unterstreicht die Wichtigkeit einer frühzeitigen Überweisung von Pankreaskarzinom-Patienten an spezialisierte Zentren.
Definition Resektabilität und „grenzwertig mögliche Resektion“
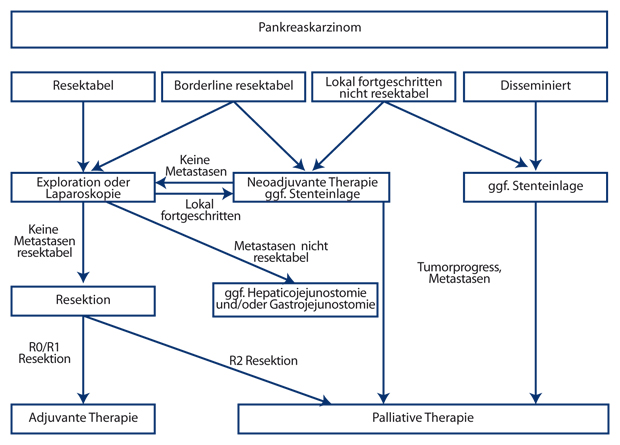
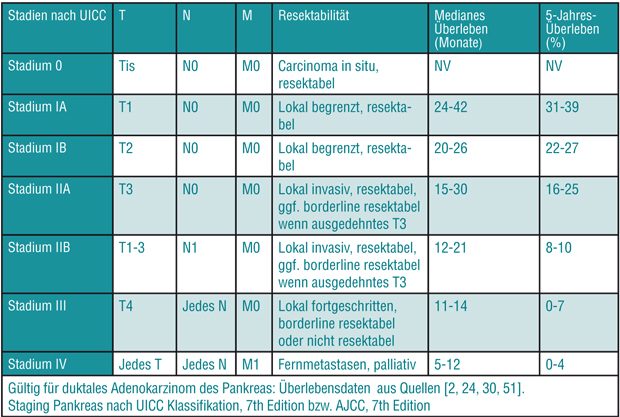
Pankreaschirurgen sind sich darüber einig, dass Tumoren des Pankreas, die lokal begrenzt sind und die arteriellen Hauptgefäße und Pfortader nicht infiltrieren, resektabel sind, falls es keinen Anhalt für Fernmetastasen gibt (Stadium I und II in Tab. 1, [12, 46]). Des Weiteren gilt das Tumorleiden als systemisch und somit chirurgisch inkurabel, sobald Fernmetastasen vorliegen, die primär mittels Chemotherapie behandelt werden sollten (Abb. 1 modifiziert aus [27]). Neben diesen klaren Indikationen bzw. Kontraindikationen für eine Operation gibt es Tumoren, die nicht klar in die eine oder andere Kategorie fallen. Zum Beispiel werden Tumoren mit Verdacht auf eine Infiltration in den Truncus coeliacus, die Arteria hepatica oder die Arteria mesenterica superior (Stadium III bzw. T4) in den meisten Fällen als irresektabel angesehen [12, 46]. In hochspezialisierten Zentren ist durch erweiterte Resektionen mit Entfernung und ggf. Ersatz der beteiligten Gefäße mit und ohne multimodale Vorbehandlung eine chirurgische Therapie in Einzelfällen möglich [20].
Daraus entstanden mehrere Definitionen der grenzwertig möglichen Resektion (borderline resectability), die in Form von Expertenrichtlinien verabschiedet wurden (Abb. 2, [9]). Aufgrund größerer chirurgischer Erfahrung sehen immer weniger Pankreaschirurgen die Gefäßbeteiligung als absolute Kontraindikation zur Resektion an. Insbesondere die Beteiligung von Pfortader und Vena mesenterica superior werden in der S3-Leitlinie von 2013 [43] nicht mehr als Kontraindikation gewertet. Die Einschätzung der Resektabilität erfolgt laut Expertenrichtlinie nicht ausschließlich nach bildmorphologischen (CT- oder MRT-) Befunden, sondern hängt vielmehr von der Erfahrung des Chirurgen bzw. des Zentrums mit Gefäßresektionen ab [12]. Da das fortgeschrittene Pankreaskarzinom Domäne der multimodalen Therapie ist, ist in jedem Einzelfall die Abwägung zwischen primärer Resektion und neoadjuvanter bzw. perioperativer Therapieoption zu treffen.

Standardresektionen
Die Pankreatoduodenektomie, die sogenannte Whipple’sche Operation, stellt die Standardresektion bei Pankreaskopf-Tumoren dar. Hauptsächlich stehen drei Resektions-Varianten, die sich vor allen Dingen durch die Resektion des Magenausgangs unterscheiden, zur Verfügung. Bei der klassischen Operation nach Kausch-Whipple werden der Pankreaskopf, das Duodenum, zwei Drittel des Magens inklusive Pylorus und die Gallenblase reseziert. Falls onkologisch vertretbar, kann der gesamte Magen inklusive Pylorus i. S. der „Pylorus-erhaltenden Whipple‘schen Operation“ erhalten werden. In randomisierten Studien konnte jedoch kein wesentlicher Unterschied zwischen diesen beiden Resektionsformen gefunden werden. Die dritte und neueste Variante ist die „Pylorus-resezierende Whipple-Operation“, bei der nur der Pylorus entfernt wird. Vorteil dieser Resektionstechnik ist, dass das Auftreten einer postoperativen Magenentleerungsstörung (delayed gastric emptying (DGE)) reduziert werden kann [32].
Bei Prozessen im Pankreasschwanz ist die Pankreas-Linksresektion die Methode der Wahl. Durch die anatomische Nähe des Pankreasschwanzes zur Milz kann eine Milzentfernung (Splenektomie) erforderlich sein. Dies ist bei malignen Raumforderungen aufgrund der notwendigen radikalen Lymphadenektomie im Milzhilus notwendig. Bei benignen Prozessen sollte der Milzerhalt angestrebt werden.
Lymphadenektomie bei der chirurgischen Resektion
Beim Pankreaskarzinom ist die Lymphknotenbeteiligung – sowohl die absolute als auch die relative Anzahl beteiligter Lymphknoten (lymph node ratio/LNR) – ein starker Prognosefaktor [44]. Deshalb wurde in der Vergangenheit versucht, durch ausgedehnte Entfernung von Lymphknoten (Lymphadenektomie) über die standardmäßigen Lymphknotenstationen hinaus das Überleben nach Pankreaskopf-Resektion zu verbessern. Allerdings zeigte sich kein Überlebensvorteil, sondern lediglich eine Zunahme postoperativer Komplikationen [29]. Als Therapie der Wahl sollte daher die „Standard-Lymphadenektomie“ und nicht die „Erweiterte Lymphadenektomie“ gelten [47].
Gefäß- und erweiterte Pankreasresektion
Durch die besondere Lage des Pankreas im Bauchraum wachsen Pankreaskopf- und Korpus-Tumoren in unmittelbarer Nähe zu den Hauptgefäßen der Baucheingeweide. Lokal fortgeschrittene Tumoren infiltrieren deshalb oftmals Pfortader, Arteria mesenterica superior oder Truncus coeliacus. Nach der TNM-Klassifikation ist die Infiltration des Karzinoms in Venen ein T3-Stadium, wohingegen die Infiltration der A. mesenterica superior oder des Truncus coeliacus ein T4-Stadium definiert. T4-Tumoren gelten aufgrund der schlechten Prognose und außerordentlich anspruchsvollen Resektionsbedingungen in der Regel als nicht resektabel. Trotz dieser schwierigen Voraussetzungen haben Studien ergeben, dass Patienten, bei denen nach Einzelfallentscheidung diese Arterien in Zusammenhang mit erweiterten Pankreasresektionen entfernt wurden, ein besseres Langzeitüberleben hatten als Patienten ohne Resektion [37]. Allerdings wird dieses Ergebnis mit hoher perioperativer Morbidität und Mortalität erkauft und sollte deshalb nur in Einzelfällen nach interdisziplinärer Entscheidung durchgeführt werden. Im Gegensatz zur arteriellen Resektion ist die venöse Resektion (Pfortader oder Vena mesenterica superior) an spezialisierten Zentren mit vergleichbarer Morbidität und Mortalität wie eine Pankreasresektion ohne Gefäßresektion durchführbar [13, 52]. Für einen Pankreaschirurgen sind fundierte gefäßchirurgische Kenntnisse und Techniken daher unabdingbar, um fortgeschrittene Tumoren zu behandeln.
Neben der Infiltration von Gefäßen, welche ein Kriterium der erweiterten Pankreasresektion ist, kann das Pankreaskarzinom auch andere benachbarte Strukturen wie zum Beispiel Dickdarm, Magen, Milz, Leber oder Nebenniere infiltrieren. Daraus entstand die Technik der erweiterten Pankreasresektion [26], die an spezialisierten Zentren mit guten Langzeitergebnissen durchführbar ist, allerdings mit erhöhter perioperativer Morbidität [13, 27]. Daher ist die postoperative Überwachung dieser Patienten durch geschultes Personal von besonderer Wichtigkeit, um Komplikationen frühzeitig zu bemerken und suffizient zu therapieren.
Totale Pankreatektomie
Eine weitere Therapieoption insbesondere bei lokal fortgeschrittenen Pankreaskarzinomen oder bei ausgedehnten oder multiplen Vorläuferläsionen (z. B. IPMNs) stellt die totale Pankreatektomie dar. Die Lebensqualität nach Pankreatektomie mit der dadurch hervorgerufenen lebenslangen Insulin-Pflichtigkeit ist vergleichbar mit der von Patienten mit Diabetes mellitus aufgrund anderer Ursachen [5]. Die perioperative Mortalität hat sich im Lauf der Zeit drastisch reduziert [40], und das Langzeitüberleben beim Adenokarzinom des Pankreas scheint gegenüber der Pankreaskopf-Resektion mit positivem Absetzungsrand besser zu sein [42]. Die 5-Jahres-Überlebensraten nach totaler Pankreatektomie sind vergleichbar mit der nach Pankreaskopf-Resektion [40]. Zusammengefasst sollte, wenn indiziert, sowohl bei IPMNs mit diffuser Gangbeteiligung, als auch beim Pankreaskarzinom die totale Pankreatektomie als Therapieoption berücksichtigt werden, ohne Angst vor dem pankreopriven Diabetes mellitus[23].
Laparoskopische Pankreasresektion
In mehreren monozentrischen Studien konnte gezeigt werden, dass die laparoskopische Pankreasschwanz-Resektion eine gut durchführbare, sichere Operationsmethode ist, die im Vergleich zur offenen Operation durch eine kürzere Krankenhausverweildauer und eine niedrigere chirurgische Morbidität gekennzeichnet ist [50]. Es gibt allerdings bisher keine randomisierten Studien, welche beide Techniken vergleichen, und der wissenschaftliche Evidenzgrad ist somit gering (Evidenzgrad III–IV). Alle Studien zu diesem Thema sind retrospektiv und beinhalten vorwiegend benigne oder grenzwertig maligne Tumoren. Insgesamt gibt es nur wenig Erfahrung und Langzeitergebnisse mit der minimal-invasiven Operation bei malignen Pankreas-Raumforderungen, und dann vorwiegend zu neuroendokrinen Tumoren der Bauchspeicheldrüse [34]. Teilweise wurden auch Patienten, bei denen intraoperativ zur offenen Operation konvertiert werden musste, aus der Analyse der Ergebnisse ausgeschlossen. Trotz der dürftigen Datenlage wird die laparoskopische Pankreas-Linksresektion zunehmend auch bei Pankreaskarzinom-Patienten angewendet. Noch spärlicher sind die Daten zur laparoskopischen Pankreaskopf-Resektion. Derzeit ist unklar, welche Rolle die laparoskopische Pankreaschirurgie beim Pankreaskarzinom in Zukunft spielen wird. Aktuell scheint sie nur in ausgewählten Fällen sinnvoll.
Komplikationsmanagement
In der Pankreaschirurgie liegt die chirurgische Morbidität in großen Zentren bei circa 40%. Erfolgreiche Pankreaschirurgie ist somit nur mit erfolgreichem Komplikationsmanagement möglich. Ein deutlicher Fortschritt liegt in der Behandlung der Pankreasfistel und intraabdomineller Abszesse mittels Ableitung über eine interventionell (z. B. CT-gesteuert) platzierte Drainage. Die Möglichkeit der endoskopischen Aufdehnung postoperativ verschwollener Magen-Anastomosen, die Stent-Platzierung über eine Undichtigkeit der Gallengangs-Anastomose und die angiografisch-endovaskuläre Beherrschung postoperativer Blutungen sind weitere Beispiele für den Fortschritt im Komplikationsmanagement nach Pankreasresektionen. Es hat sich gezeigt, dass das Vorhandensein einer Abteilung für interventionelle Radiologie die perioperative Sterblichkeit der Pankreaschirurgie deutlich senkt [31]. Der Unterschied zwischen Kliniken mit hoher und Kliniken mit niedriger Sterblichkeit in der Pankreaschirurgie hängt somit maßgeblich vom Komplikationsmanagement ab [19].
Blutung und Fistel nach Pankreasresektion
Die späte postoperative intraabdominelle Blutung nach Pankreaseingriffen ist eine der am schwierigsten zu bewältigenden Komplikationen. Sie wird meistens durch eine Pankreasfistel mit nachfolgender Gefäßarrosion verursacht. Der mitunter massiven abdominellen Hämorrhagie geht z. T. eine selbstlimitierende Indikatorblutung („sentinel bleeding“) voran, der unbedingt Beachtung geschenkt werden muss. Die Diagnostik und Therapie der Wahl ist die frühzeitige angiografische Detektion der Blutungsquelle mit dem Versuch einer Coil- bzw. Stent-Versorgung des blutenden Gefäßes. Die chirurgische Therapie der Arrosionsblutung nach Pankreaseingriff sollte nur bei interventionell nicht beherrschbarer Blutung bzw. nicht vorhandener Möglichkeit der Intervention durchgeführt werden.
Die postoperative Pankreasfistel ist für eine Vielzahl weiterer Komplikationen nach pankreaschirurgischen Eingriffen, sowohl nach Linksresektion als auch Pankreaskopf-Resektion, verantwortlich. Eine Pankreasfistel bzw. Flüssigkeitsansammlung kann ebenfalls suffizient mittels interventioneller Drainage therapiert werden. Bei Patienten mit Pankreasfistel kann durch interventionelle Drainagen die Reoperations- und Restpankreatektomie-Rate signifikant gesenkt werden, welche mit einer hohen Letalität verbunden sind [10].
Somatostatin-Analoga zur Fistelprävention
In den letzten Jahren wurde kontrovers über die perioperative Gabe synthetischer Somatostatin-Analoga diskutiert. Diese sollten durch ihre relative Inhibition der Pankreasenzym-Sekretion die Fistelrate und die damit verknüpfte Morbidität und Mortalität senken [18, 22]. Eine jüngste randomisierte Doppelblind-Studie aus dem Memorial Sloan-Kettering Cancer Center in New York konnte zuletzt eine signifikante Reduktion klinisch relevanter Fisteln nach Pankreas-Linksresektion und Pankreaskopf-Resektion durch das lang wirksame Pasireotid zeigen [1]. Im Vergleich zu dem hierzulande häufig verwendeten Octreotid hat Pasireotid sowohl eine längere Halbwertszeit (elf vs. zwei Stunden) als auch ein anderes Bindungsmuster.
Prognosefaktoren
Es gibt eine Vielzahl von Prognosefaktoren, die das Überleben bzw. das onkologische Ergebnis bei resektablem Pankreaskarzinom beeinflussen. Zu ihnen zählen unter anderem der Tumormarker CA 19-9 (Carbohydrate-Antigen 19-9), die Lymphknotenbeteiligung, sog. Mikroinvasions-Kriterien wie Perineuralscheiden- und Lymphgefäßeinbruch sowie Tumorgröße und -differenzierung. Die beiden Letztgenannten, die lymphatische Metastasierung (pN0) und die chirurgische Resektion des Tumors im Gesunden (R0-Resektion) gehören zu den wichtigsten Prognosefaktoren.
Der Vergleich zwischen Chemotherapie und chirurgischer Resektion beim resektablen Pankreaskarzinom ist aufgrund ethischer Bedenken heute schwierig. In einer Studie zum lokal fortgeschrittenen Pankreaskarzinom konnte jedoch ein deutlicher Vorteil für die chirurgische Resektion gegenüber der alleinigen Chemotherapie gezeigt werden, weshalb diese Studie aus ethischen Gründen frühzeitig abgebrochen wurde [28]. Die Beurteilung des Resektionsstatus (R0 versus R1) hat sich im Laufe der letzten Jahre geändert. Anfangs konnte kein wirklicher Unterschied im Überleben zwischen Patienten mit Resektion im Gesunden (R0) und dem mikroskopischen Vorhandensein von Tumor am Absetzungsrand (R1) gezeigt werden [11]. Definiert man allerdings die R0-Resektion als das Fehlen von Tumorzellen innerhalb eines Randsaumes von einem Millimeter zum Absetzungsrand in einem 3-dimensional aufgearbeiteten Resektionspräparat, so zeigt sich ein deutlicher Überlebensvorteil der R0- gegenüber der R1-Resektion [24, 33]. Eines der Hauptziele multimodaler Therapiekonzepte ist es daher, eine Resektion des Pankreaskarzinoms im Gesunden zu ermöglichen.
Zusammenhang zwischen Anzahl behandelter Patienten und Ergebnissen
Sowohl das chirurgische als auch das onkologische Ergebnis nach Pankreaseingriffen hängt maßgeblich von der Anzahl der in einer Klinik behandelten Patienten mit Pankreaserkrankungen ab. Die Pankreaschirurgie ist risikobehaftet, besonders dann, wenn sie selten durchgeführt wird [6]. Die Sterblichkeitsraten nach Pankreaseingriffen variieren zwischen 3,8% in spezialisierten Zentren mit vielen pankreaschirurgischen Eingriffen (High-volume-Zentrum) und 16,3% an Kliniken mit sehr wenigen Pankreaseingriffen. Zusätzlich haben Patienten, die in einem High-volume-Zentrum behandelt wurden, ein deutlich besseres Langzeitüberleben [8, 21].
Es gibt verschiedene Faktoren, die den Zusammenhang zwischen Anzahl der behandelten Patienten und postoperativen Ergebnissen in der Pankreaschirurgie beeinflussen. Zum einen ist die Pankreasresektion ein hoch komplexer, technisch anspruchsvoller Eingriff, bei dem die Lernkurve des Operateurs eine bedeutende Rolle in Bezug auf Komplikationsrate und Sterblichkeit spielt [7]. Zum anderen wird das frühzeitige Erkennen typischer postoperativer Komplikationen bei Chirurgen und Pflegepersonal durch die ständige Auseinandersetzung mit Patienten nach Pankreaseingriffen geschult. Das wiederum hat einen positiven Effekt auf das bereits erwähnte Komplikationsmanagement [19]. Auch für das postoperative onkologische Therapieregime hat sich gezeigt, dass an Pankreaszentren häufiger multimodale Therapiekonzepte angeboten werden und hierdurch ein verbessertes Langzeitüberleben für die Patienten möglich wird [4].
Sowohl in den Niederlanden als auch in den USA konnten durch Zentralisierung der Pankreaschirurgie in einzelnen großen Kliniken erhöhte Resektionsraten mit deutlich geringerer Sterblichkeit erzielt werden [16, 35]. Diese Ergebnisse zeigen, wie wichtig interdisziplinäre spezialisierte Zentren im Zusammenhang mit erfolgreicher Pankreaschirurgie und Nachbehandlung sind.
Literatur
1. Allen PJ et al. Pasireotide for postoperative pancreatic fistula. N Engl J Med 2014; 370: 2014-22.
2. Bilimoria KY et al. Validation of the 6th edition AJCC Pancreatic Cancer Staging System: Report from the National Cancer Database. Cancer 2007; 110: 738-44.
3. Bilimoria KY et al. National failure to operate on early stage pancreatic cancer. Ann Surg 2007; 246: 173-80.
4. Bilimoria KY et al. Multimodality therapy for pancreatic cancer in the U.S.: Utilization, outcomes, and the effect of hospital volume. Cancer 2007; 110: 1227-34.
5. Billings BJ et al. Quality-of-life after total pancreatectomy: Is it really that bad on long-term follow-up? J Gastrointest Surg 2005; 9: 1059-66.
6. Birkmeyer JD et al. Hospital volume and surgical mortality in the United States. N Engl J Med 2002; 346: 1128-37.
7. Birkmeyer JD et al. Surgeon volume and operative mortality in the United States. N Engl J Med 2003; 349: 2117-27.
8. Birkmeyer JD et al. Hospital volume and late survival after cancer surgery. Ann Surg 2007; 245: 777-83.
9. Bockhorn M et al. Borderline resectable pancreatic cancer: A consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2014; 155: 977-88.
10. Büchler MW et al. Changes in morbidity after pancreatic resection: Toward the end of completion pancreatectomy. Arch Surg 2003; 138: 1310-4.
11. Butturini G et al. Influence of resection margins and treatment on survival in patients with pancreatic cancer: Meta-analysis of randomized controlled trials. Arch Surg 2008; 143: 75-83.
12. Callery MP et al. Pretreatment assessment of resectable and borderline resectable pancreatic cancer: Expert consensus statement. Ann Surg Oncol 2009; 16: 1727-33.
13. Chua T,C Saxena A. Extended pancreaticoduodenectomy with vascular resection for pancreatic cancer: A systematic review. J Gastrointest Surg 2010; 14: 1442-52.
14. Correa-Gallego C et al. Incidental pancreatic cysts: Do we really know what we are watching? Pancreatology 2010; 10: 144-50.
15. Fang Y et al. Pre-operative biliary drainage for obstructive jaundice. Cochrane Database Syst Rev 2012; 9: CD005444.
16. Finks JF et al. Trends in hospital volume and operative mortality for high-risk surgery. N Engl J Med 2011; 364: 2128-37.
17. Fritz S et al. Small (Sendai negative) branch-duct IPMNs: Not harmless. Ann Surg 2012; 256: 313-20.
18. Gans SL et al. Systematic review and meta-analysis of somatostatin analogues for the treatment of pancreatic fistula. Br J Surg 2012; 99: 754-760.
19. Ghaferi AA et al. Variation in hospital mortality associated with inpatient surgery. N Engl J Med 2009; 361: 1368-75.
20. Gillen S et al. Preoperative/neoadjuvant therapy in pancreatic cancer: A systematic review and meta-analysis of response and resection percentages. PLoS Med 2010; 7: e1000267.
21. Gooiker GA et al. Systematic review and meta-analysis of the volume-outcome relationship in pancreatic surgery. Br J Surg 2011; 98: 485-94.
22. Gurusamy KS et al. Somatostatin analogues for pancreatic surgery. Cochrane Database Syst Rev 2012; 6: CD008370.
23. Hartwig W et al. Total pancreatectomy for primary pancreatic neoplasms: Renaissance of an unpopular operation. Ann Surg 2014, Jun 27 [Epub ahead of print].
24. Hartwig W et al. Pancreatic cancer surgery in the new millennium: better prediction of outcome. Ann Surg 2011; 254: 311-9.
25. Hartwig W et al. Preoperative tissue diagnosis for tumours of the pancreas. Br J Surg 2009; 96: 5-20.
26. Hartwig W et al. Extended pancreatectomy in pancreatic ductal adenocarcinoma: Definition and consensus of the International Study Group for Pancreatic Surgery (ISGPS). Surgery 2014; 156: 1-14.
27. Hartwig W et al. Improvement of surgical results for pancreatic cancer. Lancet Oncol 2013; 14: e476-e485.
28. Imamura M et al. A randomized multicenter trial comparing resection and radiochemotherapy for resectable locally invasive pancreatic cancer. Surgery 2004; 136: 1003-11.
29. Iqbal N et al. A comparison of pancreaticoduodenectomy with extended pancreaticoduodenectomy: A meta-analysis of 1909 patients. Eur J Surg Oncol 2009; 35: 79-86.
30. Isaji S et al. Classification of pancreatic cancer: Comparison of Japanese and UICC classifications. Pancreas 2004; 28: 231-4.
31. Joseph B et al. Relationship between hospital volume, system clinical resources, and mortality in pancreatic resection. J Am Coll Surg 2009; 208: 520-7.
32. Kawai M et al. Pylorus ring resection reduces delayed gastric emptying in patients undergoing pancreatoduodenectomy: A prospective, randomized, controlled trial of pylorus-resecting versus pylorus-preserving pancreatoduodenectomy. Ann Surg 2011; 253: 495-501.
33. Konstantinidis IT et al. Pancreatic ductal adenocarcinoma: Is there a survival difference for R1 resections versus locally advanced unresectable tumors? What is a "true" R0 resection? Ann Surg 2013; 257: 731-6.
34. Kooby DA et al. A multicenter analysis of distal pancreatectomy for adenocarcinoma: Is laparoscopic resection appropriate? J Am Coll Surg 2010; 210: 779-85, 786-7.
35. Lemmens VE et al. Improving outcome for patients with pancreatic cancer through centralization. Br J Surg 2011; 98: 1455-62.
36. Mayo SC et al. Conditional survival in patients with pancreatic ductal adenocarcinoma resected with curative intent. Cancer 2012; 118: 2674-81.
37. Mollberg N et al. Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis. Ann Surg 2011; 254: 882-93.
38. Neoptolemos JP et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. J Am Med Ass 2010; 304: 1073-81.
39. Oettle H et al. Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: The CONKO-001 randomized trial. J Am Med Ass 2013; 310: 1473-81.
40. Reddy S et al. Total pancreatectomy for pancreatic adenocarcinoma: Evaluation of morbidity and long-term survival. Ann Surg 2009; 250: 282-7.
41. Salvia R et al. Pancreatic resections for cystic neoplasms: From the surgeon's presumption to the pathologist's reality. Surgery 2012; 152 (Suppl 1): S135-S142.
42. Schmidt CM et al. Total pancreatectomy (R0 resection) improves survival over subtotal pancreatectomy in isolated neck margin positive pancreatic adenocarcinoma. Surgery 2007; 142: 572-8.
43. Seufferlein T et al. S3-Leitlinie zum exokrinen Pankreaskarzinom. Z Gastroenterol 2013; 51: 1395-440.
44. Slidell MB et al. Impact of total lymph node count and lymph node ratio on staging and survival after pancreatectomy for pancreatic adenocarcinoma: A large, population-based analysis. Ann Surg Oncol 2008; 15: 165-74.
45. Tanaka M et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 2012; 12: 183-97.
46. Tempero MA et al. Pancreatic Adenocarcinoma, version 2.2012: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw 2012; 10: 703-13.
47. Tol JA et al. Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma: A consensus statement by the International Study Group on Pancreatic Surgery (ISGPS). Surgery 2014; 156: 591-600.
48. Uehara H et al. Development of ductal carcinoma of the pancreas during follow-up of branch duct intraductal papillary mucinous neoplasm of the pancreas. Gut 2008; 57: 1561-5.
49. van der Gaag NA et al. Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med 2010; 362: 129-37.
50. Venkat R et al. Laparoscopic distal pancreatectomy is associated with significantly less overall morbidity compared to the open technique: A systematic review and meta-analysis. Ann Surg 2012; 255: 1048-59.
51. Wasif N et al. Invasive intraductal papillary mucinous neoplasm versus sporadic pancreatic adenocarcinoma: A stage-matched comparison of outcomes. Cancer 2010; 116: 3369-77.
52. Zhou Y et al. Pancreatectomy combined with superior mesenteric vein-portal vein resection for pancreatic cancer: A meta-analysis. World J Surg 2012; 36: 884-91.

Prof. Dr. med. Werner Hartwig
Leitender Oberarzt, Leiter des
Pankreaszentrums München
Klinik für Allgemeine, Viszeral-,
Transplantations-, Gefäß- und Thoraxchirurgie
Ludwig-Maximilians-Universität München
Marchioninistr. 15
81377 München

