Die dramatische Zunahme von chronisch-entzündlichen Erkrankungen wie z. B. Asthma, Allergien, Psoriasis und chronischen Entzündungen des Darmes ist eine der größten Herausforderung der Medizin in der westlichen Gesellschaft. Gleichzeitig beobachten wir eine wachsende Zahl an adipösen Patienten – bedingt durch Fehlernährung mit erhöhter Aufnahme von Kohlenhydraten und Fett. Zusätzlich sind Infektionen mit z. B. Würmern größtenteils verschwunden. Gerade diese beiden Komponenten – Ernährung und erhöhte Hygiene – stehen im Verdacht, chronische Entzündungen zu begünstigen; daher ist die Erforschung dieses komplexen Wechselspiels notwendig, um die zugrunde liegenden Mechanismen zu verstehen und neue Therapiemöglichkeiten für die Klinik zu entwickeln. Hier diskutieren wir einen Teil der jüngsten Literatur, welche sich damit befasst, wie Ernährung Immunantworten beeinflusst, und wie bestimmte Nahrungsbestandteile Effekte auf Immunzellen ausüben.
Schlüsselwörter: Immunmetabolismus, ketogene Diät, intermittierendes Fasten, Fettleibigkeit, chronische Entzündungsreaktionen
Fettleibigkeit – ein entzündlicher Zustand
Eine der gravierendsten Veränderungen des letzten Jahrhunderts in der westlichen Gesellschaft war die Umstellung der Ernährungsgewohnheiten. So stieg in den 70er- und 80er-Jahren die Abhängigkeit von verarbeiteten Lebensmitteln, gesüßten Getränken und unterwegs eingenommenen Mahlzeiten massiv an [1]. Dabei entwickelte sich Fettleibigkeit zu einem rasant ansteigenden Problem in den Industrieländern – begünstigt durch steigende Urbanisierung, mangelnde Bewegung und günstig hergestelltes Pflanzenöl, welches gerade in mittleren und einkommensschwachen Verhältnissen zu einer großen Energiezufuhr in Fettform führte [2, 3]. Aktuelle Zahlen gehen davon aus, dass 2008 weltweit ca. 1,5 Milliarden Menschen übergewichtig oder fettleibig waren und bis 2030 die Zahl auf 2,16 übergewichtige und 1,12 Milliarden fettleibige Menschen ansteigen wird [1, 4]. Gleichzeitig mit diesem massiven Anstieg geht auch die erhöhte Zahl von Patienten mit Adipositas-assoziierten Erkrankungen wie z. B. Diabetes oder dem metabolischen Syndrom, aber auch mit einer Anfälligkeit für Infektionskrankheiten einher [5]. Ein gemeinsames Merkmal hierbei ist eine niedriggradige Entzündung mit einer chronisch erhöhten Konzentration von proinflammatorischen Zytokinen, welche zu veränderten Leukozytenzahlen im Blut und in Geweben sowie zu zellabhängigen Immunreaktionen führt. Dies verdeutlicht die Verbindung zwischen lokalen Entzündungsreaktionen im Fettgewebe und Immunsystem im Allgemeinen [6].
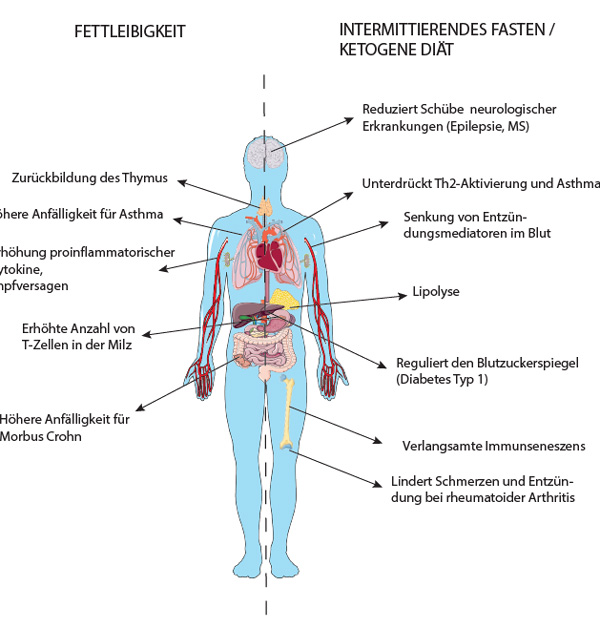
In den letzten 15 Jahren hat sich die Forschung auf diese Beobachtungen fokussiert und die Effekte auf das Immunsystem untersucht [7]. So zeigen Mäuse, welche mit einer „high fat diet“ gefüttert wurden, dass der Thymus schneller zurückgebildet wurde, die Zahl apoptotischer T-Zellen stieg, die Diversität des T-Zell-Rezeptor-Repertoires (TZR) zurückging und gleichzeitig die Anzahl von Effektor-T-Zellen in der Milz zunahm, während sie in den Lymphknoten abnahm (Abb. 1) [8–10]. Dieses beschleunigte Altern des Immunsystems könnte somit zu häufigeren Infektionen oder Krebserkrankungen führen. Zusätzlich veränderte sich auch die Qualität der Immunreaktionen, sodass im Fettgewebe klassische entzündungsfördernde Makrophagen zunahmen, während alternativ-aktivierte Makrophagen, die eher mit Reparaturfunktionen in Verbindung gebracht werden, verschwanden [11–13]. Insgesamt waren mehr Typ-1-T-Helferzellen (Th1), gekennzeichnet durch Expression des Transkriptionsfaktors T-bet und des entzündungsfördernden Leitzytokins Interferon-γ, im Fettgewebe vorhanden, bei gleichzeitigem Verlust von regulatorischen T-Zellen [14, 15]. Ähnliche enorme Veränderungen wurden in adipösen Patienten beobachtet. So war z. B. die Balance zwischen peripheren CD4+- und CD8+-T-Zellen in Richtung der CD4+-Zellen verschoben, und diese Zellen differenzierten präferentiell in Th1-Zellen im Fettgewebe [16, 17]. In PBMC (mononukleäre Zellen des peripheren Blutes wie Lymphozyten und Monozyten) hingegen wurde eine konstante Aktivierung von NF-κB beobachtet, die in der verstärkten Expression von proinflammatorischen Genen wie z. B. Interleukin-(IL)-6, Tumornekrosefaktor-α (TNF-α), MIF und MMP-9 resultierte [18]. Diese Veränderungen wiederum führen zu einer großen Anzahl von gravierenden Nebeneffekten: Die Gefahr von Impfversagen z. B. gegen Tetanus, Hepatitis B oder Influenza steigt an, während auch die Anfälligkeit für Infektionen und chronische entzündliche Erkrankungen wie z. B. Asthma, Morbus Crohn und Colitis ulcerosa wächst (Abb. 1) [19–26]. Bemerkenswerterweise lassen sich einige der beobachteten Effekte wie die Expression von entzündungsfördernden Genen oder die Imbalance zwischen CD4+- und CD8+-T-Zellen durch Gewichtsreduktion umkehren, jedoch bleibt der Organismus dauerhaft umprogrammiert, wie epigenetische Daten beweisen [27–29]. So wurde im Mausmodell gezeigt, dass auch nach Ernährungsumstellung von einer ungesunden „westlichen Diät“ hin zu einer ausgewogenen Nahrung das Potential von myeloiden Zellen und ihren Vorläufern, Entzündungsreaktionen auszulösen, erhöht blieb [29].
Um dem wachsenden Problem der ernährungsabhängigen und entzündlichen Erkrankungen in der westlichen Gesellschaft entgegenzutreten, ist es jedoch von grundlegender Bedeutung zu verstehen, welche Stoffwechselwege und Nahrungsbestandteile das Immunsystem und seine Funktionen steuern, um neue Therapiemöglichkeiten entwickeln zu können.