T-Zellen spielen eine wichtige Rolle bei der Pathogenabwehr, Kontrolle von Tumoren, aber auch Aufrechterhaltung der Gewebshomöostase und damit bei der Balance aus entzündlichen und anti-entzündlichen Prozessen. Dies wird durch ein Zusammenspiel unterschiedlicher T-Zellarten wie konventionellen CD4+-T-Helferzellarten und CD8+-zytotoxischen T-Zellen als auch Foxp3+-regulatorischen T-Zellen garantiert. Konventionelle CD4+- und CD8+-T-Zellen verändern ihren Aktivierungszustand nach Antigenkontakt von ruhenden, naiven T-Zellen zu sich schnell teilenden Effektor-T-Zellen. Aus diesen entstehen wiederum ruhende Gedächtnis-T-Zellen. Besonders Effektor-T-Zellen sind durch die Produktion von Zytokinen und Effektormolekülen gekennzeichnet. Diese Unterschiede in der Funktion und dem Aktivierungszustand von T-Zellen sind begleitet von einer fein abgestimmten Umstellung des zellulären Metabolismus mit einem Wechsel von vornehmlich katabolem zu anabolem Stoffwechselprozess. Veränderungen in Anzahl und Form der Mitochondrien sind mit dieser Umstellung des Stoffwechsels verbunden.
Schlüsselwörter: naive, regulatorische, Gedächtnis- und Effektor-T-Zellen, Metabolismus, Mitochondrienmorphologie
Einleitung
T-Zellen als Bestandteil des erworbenen Immunsystems treiben antigen-spezifische Abwehrmechanismen zur Beseitigung von extra- und intrazellulären Pathogenen und malignen Körperzellen an. Sie sind aber auch an der Aufrechterhaltung der Gewebshomöostase und der Inhibition autoreaktiver Immunantworten beteiligt.
Diese sehr unterschiedlichen Funktionen werden durch ein Zusammenspiel an unterschiedlichen T-Zellarten gewährleistet. So orchestrieren die verschiedenen CD4+-T-Helferzellarten wie Th1-, Th2-, Th17- oder follikuläre T-Helfer (Tfh)-Zellen die zelluläre und humorale Abwehr gegen intra- und extrazelluläre Erreger [1–4]. CD8+-zytotoxische T-Zellen sind für die Eliminierung Virus-infizierter oder maligner körpereigener Zellen zuständig.
Th1-Zellen koordinieren über die Produktion von IL-2, IFNg und TNF die Aktivierung von CD8+-T-Zellen, NK-Zellen und Makrophagen, und damit die Abwehr intrazellulärer Pathogene. Th2-Zellen sind durch die Produktion von IL-4, IL-5 und IL-13 gekennzeichnet und spielen eine Rolle sowohl bei der Abwehr von Parasiten als auch bei der Entstehung von Allergien. Th17-Zellen sezernieren unter anderem IL-17A und IL-22, regulieren die Abwehr gegenüber extrazellulären Bakterien und Pilzen. Ihnen wird aber auch eine pathologische Bedeutung für die Entstehung von Autoimmunerkrankungen zugesprochen. Tfh-Zellen sezernieren IL-21 und kontrollieren die Aktivierung und Antikörperproduktion von B-Zellen in den Follikeln der sekundären lymphatischen Organe.
Die Aktivierung der konventionellen T-Zellarten wird durch CD4+CD25highFoxp3+-regulatorische T-Zellen (Tregs) kontrolliert, die dadurch überschießende Immunreaktionen, aber auch die Entstehung von Autoimmunreaktionen verhindern [5]. Bei konventionellen T-Zellen unterscheidet man zwischen nicht-aktivierten naiven T-Zellen, aktivierten Effektor-T-Zellen und daraus entstehenden ruhenden Gedächtnis-T-Zellen [6]. Charakteristisch für Effektor-Zellen im Gegensatz zu Tregs ist die massive Produktion von inflammatorischen Zytokinen wie IFNg, TNF, IL-4 oder IL-17A und Effektormolekülen wie Perforin und Granzyme B. In den letzten Jahren wurde klar, dass diese unterschiedlichen Differenzierungs- und Funktionszustände eng mit Veränderungen im zellulären Metabolismus verknüpft sind [3, 4, 7, 8].
Grundsätzlich wird zwischen katabolen und anabolen metabolischen Prozessen unterschieden [3, 7]. Der Katabolismus umfasst den schrittweisen Abbau von Substraten zur Gewinnung des Energieträgers Adenosintriphosphat (ATP) und der Reduktionsäquivalente Nicotinamidadenindinukleotid (NADH/H+) und reduziertem Flavin-Adenin-Dinukleotid (FADH2). Demgegenüber umfasst der Anabolismus energie- und reduktionsäquivalente konsumierende Aufbauprozesse zur Biosynthese von DNA, Lipiden und Proteinen. Zu den katabolen Prozessen zählen die Glykolyse, der Citrat-Zyklus (TCA), die Fettsäureoxidation (β-Oxidation oder FAO) sowie die Glutaminolyse [3, 7].
Während der Glykolyse wird Glukose unter Gewinnung von ATP und NADH/H+ entweder zu Laktat, das von der Zelle ausgeschieden wird, oder zu Pyruvat, das in den TCA einfließt, abgebaut [3, 7]. Der TCA läuft im Mitochondrium ab und dient der weiteren Gewinnung von NADH/H+ und FADH2. Die Reduktionsäquivalente fungieren als Elektronendonoren für die Atmungskettenkomplexe und ermöglichen die Synthese von ATP durch oxidative Phosphorylierung (OXPHOS) am Komplex V [3, 7]. Neben Pyruvat kann der TCA auch durch Produkte des Fettsäure- und Aminosäurestoffwechsels durch FAO oder Glutaminolyse gespeist werden [3]. Die Bereitstellung von Aminosäuren für den TCA erfolgt dabei primär durch die Verstoffwechselung von Glutamin zu α-Ketoglutarat [3, 7].
Die Glykolyse und der TCA dienen jedoch nicht allein dem Gewinn von ATP und Reduktionsäquivalenten. Intermediate beider Stoffwechselwege werden auch für anabole Prozesse zur Synthese von Zellmaterial und Effektormolekülen genutzt [3, 7].
Folglich steht die Glykolyse im Zentrum der Regulation von katabolem zu anabolem Stoffwechsel, und T-Zellen durchlaufen analog in ihrer Differenzierung von naiv zu Effektor- und Gedächtniszellen multiple, substantielle Veränderungen ihres Metabolismus.
Metabolische Veränderungen nach Aktivierung und Effektor-T-Zelldifferenzierung
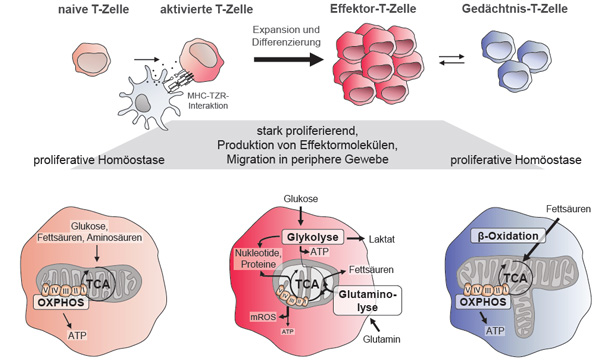
Naive, nicht-aktivierte CD4+- und CD8+-T-Zellen zirkulieren zwischen Blut und sekundären lymphatischen Organen. Sie befinden sich in einem ruhenden Zustand (Abb. 1, linke Seite). Sie sind nur durch eine geringfügige Zellteilungsrate gekennzeichnet. Alle aufgenommenen Nährstoffe werden somit nur zur Homöostase und dem Zellerhalt, aber nicht zur Neusynthese von Proteinen oder Lipiden verwendet. Zur optimalen ATP-Gewinnung verwenden naive T-Zellen oxidative Phosphorylierung, gespeist sowohl durch eine auf niedrigem Niveau ablaufende Glykolyse als auch FAO [3, 4, 7].
Nach Antigen-spezifischer Aktivierung über den T-Zellrezeptor und ko-stimulatorische Moleküle, z. B. CD28, durchlaufen CD4+- und CD8+-T-Zellen Veränderungen in ihrer Funktion. Die Zellen beginnen sich zu vermehren, und die Produktion von Zytokinen, z. B. IL-2, IFNg, IL-17A, von Th1-/Th17-Zellen und IFNg, TNF bzw. Effektormolekülen wie Perforin im Fall der CD8+-zytotoxischen T-Zellen wird initiiert (Abb. 1, Mitte). Um diesen Anforderungen gerecht zu werden, verändern die T-Zellen ihren Stoffwechsel. Neben den katabolen Prozessen werden jetzt auch verstärkt anabole Prozesse wie PPP und FAS aktiviert [3, 4, 7, 8]. Dazu wird auch der Durchsatz der Glykolyse über die vermehrte Expression von Glukosetransportern, z. B. GLUT1 und zentralen Enzymen wie die Hexokinase 1 (HK1) und Lactatdehydrogenase A (LDH-A), erhöht. Diese Umstellung ist essentiell für die Aktivierung der Effektor-T-Zellen, da eine Gabe des nicht verstoffwechselbaren Glukoseanalogons 2-Desoxyglukose (2-DG) deren Bildung reduziert. Neben der Glykolyse wird auch die Verstoffwechselung von Glutamin durch die Induktion des Transporters und abbauender Enzyme (Glutaminasen) angeregt [9]. Der erhöhte Durchsatz der Glykolyse und die Induktion der Glutaminolyse wird über kostimulatorische Signale, z. B. CD28 und die PI3K-Akt-mTOR-Signalkaskade, kontrolliert. Diese Signalkaskade bewirkt die Aktivierung und Transkription der beiden zentralen Transkriptionsfaktoren HIF1a und c-Myc.
In der Tat spielt die Expression und Balance aus ko-aktivierenden und ko-inhibitorischen Signalen eine entscheidende Rolle für die Umstellung der Stoffwechselprozesse sowohl für T-Helferzellen als auch zytotoxische T-Zellen. Während CTLA-4 die Umstellung auf Glykolyse inhibiert, verstärkt PD-1 zusätzlich die FAO in T-Helferzellen [10]. In zytotoxischen T-Zellen kann sich die erhöhte Expression von sogenannten „exhaustion“- oder Checkpoint-Rezeptoren wie z. B. 2B4 negativ auf die Umstellung auf Glykolyse und die Zellteilung auswirken [11].
Obwohl sowohl CD4+- als auch CD8+-T-Zellen während der Effektor-T-Zelldifferenzierung auf anabole Stoffwechselprozesse umstellen, sind Unterschiede im Ausmaß und dem relativen Anteil einzelner Stoffwechselwege zwischen den beiden T-Zellarten feststellbar [12]. Im Vergleich zu CD8+- scheinen CD4+-Effektor-T-Zellen noch durch eine höhere OXPHOS-Aktivität gekennzeichnet sein. In der Tat können CD8+-T-Zellen sauerstoffarme, hypoxische Bedingungen besser tolerieren. Die höhere Glykolyserate und Verstoffwechselung von Glutamin unterstützt die besonders hohe Teilungsrate und Effektormolekülproduktion der CD8+-T-Zellen auch in hypoxischen Umgebungen wie Tumoren.
Zudem ist für CD8+-T-Zellen die FAS während der Effektorphase im Vorfeld der Gedächtnis-T-Zelldifferenzierung und Induktion ihrer Langlebigkeit besonders wichtig ([8]; siehe auch Kapitel zum Stoffwechsel in Gedächtnis-T-Zellen).
Nach der Umstellung der Stoffwechselprozesse gewinnen CD4+- und CD8+-Effektor-T-Zellen ihr ATP vornehmlich über Glykolyse und nicht über OXPHOS. Unterstützt durch morphologische Veränderungen der Mitochondrien (siehe Kapitel weiter unten) sinkt die Effektivität des Elektronentransports an der Atmungskette und es kann dort kein ATP gebildet werden [8]. Stattdessen werden die Elektronen zur Produktion von mitochondrialen Sauerstoffradikalen (mROS) verwendet [13]. Die gebildeten mROS tragen zur Verstärkung der T-Zellaktivierung über die Aktivierung von z. B. NFAT bei [14].
Neben ihrer Funktion als Bausteine der synthetisierten Makromoleküle tragen TCA- und FAS-Intermediate (z. B. alpha-Ketoglutarat, Acetyl-CoA) auch zur Regulation der Effektor-T-Zelldifferenzierung wie epigenetischen Veränderungen bei [15].