MicroRNAs spielen eine Schlüsselrolle bei der Kontrolle wichtiger zellulärer Funktionen. Sie zeichnen sich durch hohe Stabilität aus und können z. B. durch quantitative PCR oder Next Generation Sequencing leicht im Blut oder anderen Bioflüssigkeiten nachgewiesen werden. Aufgrund ihrer Gewebespezifität und ihrer Bedeutung als Regulatoren der Thrombozytenfunktion ergeben sich vielversprechende Ansätze für die Verwendung als Biomarker in der Kardiologie
Schlüsselwörter: miRNA, Hämostase, Mikropartikel, Thrombose, koronare Gefäßerkrankung, Herzinfarkt
MicroRNAs (miRNAs) wurden erstmals 1993 im Fadenwurm Caenorhabditis elegans beschrieben [1]. Ihre Aufgabe ist die Regulation der Genexpression – beim Menschen steht die Expression von mindestens 70% der protein-kodierenden Gene unter ihrer Kontrolle. Als Teil eines Proteinkomplexes (RISC) beschleunigen miRNAs den Abbau von Messenger-RNA (mRNA) und hemmen deren Übersetzung (Translation) in Proteine. Dieser Mechanismus gleicht jenem der Small Interfering RNAs (siRNAs), welche zur Hemmung von spezifischen Genen auch therapeutisch eingesetzt werden. Im Gegensatz zu siRNAs können einzelne miRNAs jedoch hunderte von unterschiedlichen mRNAs binden und regulieren. Dies ermöglicht miRNAs die Steuerung von Genexpressionsmustern statt einzelner Zielgene, und somit die Kontrolle wichtiger zellulärer Funktionen. Sie beeinflussen auf diese Weise auch die Entstehung verschiedener Krankheiten [2].
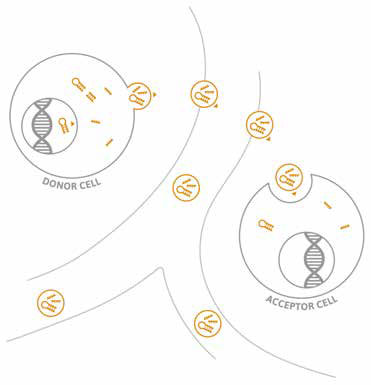
Die Transkription von miRNAs ist zum Teil zelltyp- sowie gewebespezifisch und eng mit benachbarten Genen organisiert. Zellen geben einen Teil der intrazellulär gebildeten miRNAs in Form von extrazellulären Vesikeln (Mikrovesikeln, Exosomen) [3, 4] sowie an Proteinkomplexe (z. B. HDL) [5] gebunden in ihre Umgebung ab. Dies ermöglicht die Detektion von miRNA im Blut und in anderen Körperflüssigkeiten.
Aus analytischer Sicht ist hervorzuheben, dass miRNAs durch die Verpackung in Vesikeln, die Bindung an Lipoproteine sowie die geringe Kettenlänge von nur 22 Nukleotiden vor dem Angriff endogener RNAsen gut geschützt sind (Abb. 1). In humanen Plasmaproben sind sie zudem weitaus resistenter gegenüber Temperaturschwankungen oder mehrmaligen Einfrier-Auftau-Zyklen als viele analytisch genutzte Proteine [6].