
Weiterführende Diagnostik
In einigen Fällen ist eine erweiterte Differenzierung von Lymphozytensubpopulationen notwendig. Diese Untersuchungen sind in der Regel spezialisierten immunologischen Laboratorien vorbehalten. Über viele Jahre gab es keine standardisierte Vorgehensweise in der Immunphänotypisierung von peripheren Blutzellen, was zu einer zum Teil verwirrenden Nomenklatur führte. Eine kürzlich veröffentlichte Studie bietet einen praktischen und umfassenden Ansatz für die Immunphänotypisierung der Subpopulationen und erleichtert die Zuordnung von Veränderungen zu primären oder sekundären Ursachen[7].
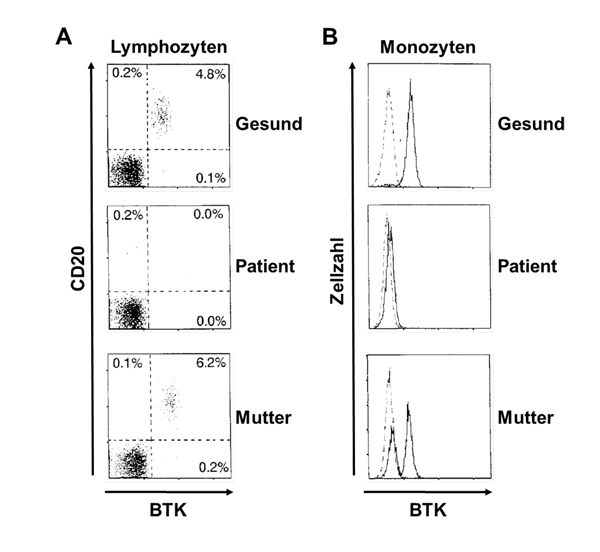
Die Durchflusszytometrie erlaubt nicht nur die Charakterisierung von Zelloberflächenmarkern, sondern auch die Untersuchung der Expression intrazellulärer Moleküle (Abb. 3). Ein Beispiel dafür ist die Bestimmung der intrazellulären Bruton-Tyrosinkinase-(BTK)-Expression bei X-chromosomaler Agammaglobulinämie (XLA, Abb. 4). Unter den lymphatischen Zellen sind CD20-positive B-Zellen die einzigen, die BTK exprimieren. Unter den nicht-lymphatischen Zellen wird BTK darüber hinaus von Monozyten exprimiert. XLA-Patienten weisen aufgrund einer fehlenden BTK-Expression oder eines funktionellen BTK-Defekts einen Entwicklungsarrest der B-Zellen auf und haben sehr wenige bis keine B-Zellen (siehe Abb. 4 A: Patient). Da die B-Zellen einer Messung der BTK-Expression somit nicht zugänglich sind, dient der Nachweis der fehlenden BTK-Expression in Monozyten der Sicherung einer XLA-Diagnose (siehe Abb. 4 B: Patient). Zusätzlich kann der Nachweis einer Mosaik-BTK-Expression in mütterlichen Monozyten den Überträgerstatus einer XLA durch die Mutter belegen (siehe Abb. 4 B: Mutter). Es gibt allerdings BTK-Mutationen, die ohne Expressionsverlust einhergehen und allein die Funktion beeinträchtigen. Das Fehlen der B-Lymphozyten im peripheren Blut kann neben einer XLA auch bei seltenen anderen Gendefekten auftreten, zum Beispiel bei Mutationen im Gen für die μ-schwere-Kette oder in den Genen für Igα/Igβ des B-Zell-Rezeptors.
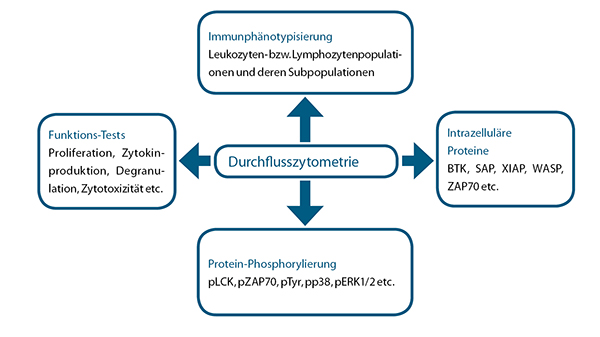
Erweiterte immunologische und funktionelle Tests
Über die phänotypische Charakterisierung hinaus gibt es eine stetig wachsende Zahl an funktionellen, durchflusszytometrischen Tests für das angeborene und erworbene Immunsystem. Ein Beispiel für einen Funktionstest des angeborenen Immunsystems ist die Bestimmung der Aktivität der NADPH-Oxidasen bei Defekten des Phagozytensystems, zum Beispiel bei einer septischen Granulomatose. Für eine Funktionsstörung des erworbenen Immunsystems spricht beispielsweise die unzureichende Induktion von Aktivierungsmarkern bei intrinsischen Signalwegstörungen.
Ausgehend von den Ergebnissen der Basis- und der weiterführenden immunologischen Diagnostik können molekulargenetische Untersuchungen schlussendlich den Verdacht auf einen primären Immundefekt bestätigen.
Molekulargenetische Diagnostik
Durch die Anwendung und stetige Weiterentwicklung neuer Sequenziertechnologien wie dem Next Generation Sequencing hat sich die Zahl der neuidentifizierten Gendefekte innerhalb weniger Jahre nahezu verdoppelt. Die genaue Kenntnis des genetischen Defektes liefert Grundlagen für die Entwicklung einer spezifischen Behandlung und ermöglicht die genetische Beratung des Patienten und Familienangehöriger. Risikopersonen können auf Anlageträgerschaft untersucht werden, um Patienten mit lebensbedrohlichen Immundefekten präsymptomatisch identifizieren und frühzeitig intervenieren zu können.
Die Auswahl der geeignetsten Kandidatengene kann schwierig sein, denn ähnliche klinische Erscheinungsbilder können durch mehr als einen Genotyp verursacht werden, so etwa bei den angeborenen Neutropenien oder den schweren kombinierten Immundefekten. Andererseits kann derselbe Gendefekt zu variablen Phänotypen führen, abhängig zum Beispiel vom Typ der Mutation, von epigenetischen Modifikationen, weiteren „Modifier“-Genen oder Umwelteinflüssen.
Das Next Generation Sequencing bietet hier deutliche Vorteile gegenüber der herkömmlichen Sanger-Sequenzierung: Durch die enorme Menge an Daten, die in jedem Sequenzierlauf erzeugt werden, können in relativ kurzer Zeit kostengünstig hunderte Gene oder sogar ganze Exome gleichzeitig von mehreren Patienten analysiert werden. So findet man dann möglicherweise auch bei unspezifischem Erscheinungsbild oder atypischen Symptomen ohne die bisherige Einengung auf bestimmte Verdachtsgene zeitnah eine Ursache.
Fazit
Die Zusammenschau verdeutlicht, dass die komplexe Diagnostik primärer Immundefekterkrankungen ein enges Zusammenspiel der behandelnden Ärzte mit dem immunologischen und genetischen Labor erfordert, um die Gesamtheit der Befunde richtig zu interpretieren und den Patienten letztlich bestmöglich zu behandeln.

