Die neuen Hoffnungsträger der Krebsdiagnostik
Extrazelluläre Vesikel
Alle Zellen unseres Körpers, insbesondere auch Krebszellen, schütten beachtliche Mengen winziger Partikel aus, deren molekulare Signaturen diagnostischen Nutzen versprechen.
Vor allem weil man Blutzellen standardmäßig durch niedertourige Zentrifugation vom Serum bzw. Plasma abtrennt, reduziert sich die Welt der Blutuntersuchung seit über hundert Jahren im Wesentlichen auf diese zwei Sphären – und alles, was sich gewissermaßen zwischen Himmel und Erde befindet, war bis vor Kurzem nur für Spezialisten von Interesse (zum Beispiel in der Lipoprotein- oder Thrombozytendiagnostik).
Durch differenzielle Zentrifugation mit bis zu 100.000 x g kann man aber aus der scheinbar homogenen Serumfraktion ein breites Spektrum submikroskopisch kleiner Partikel gewinnen, die bei entsprechend hoher optischer Auflösung durchaus an den obigen Funkenregen eines Silvesterfeuerwerks erinnern.
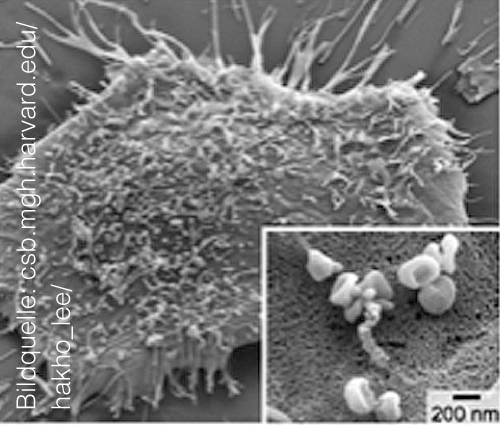
Die rasterelektronenoptische Aufnahme unten zeigt, woher diese Partikel stammen: Alle Zellen unseres Körpers – und ganz besonders Krebszellen – schütten winzige Vesikel aus, deren Inhalt von anderen Zellen wieder aufgenommen und verwertet werden kann. Eine nicht-stimulierte Zelle produziert einige hundert solcher extrazellulärer Vesikel (EVs) pro Tag, sodass bei geschätzten 100 Billionen Körperzellen stets eine ungeheure Menge „Feinstaub“ unterwegs ist. Im Blut entspricht die Partikelkonzentration in etwa derjenigen der Erythrozyten (> 106/µl)[1].
Auch wenn die in der Literatur angegebenen Absolutzahlen methodenbedingt stark schwanken, so besteht doch Konsens darüber, dass die „Staubwolke“ bei Krebspatienten erheblich dichter wird und sich in ihrer molekularen Zusammensetzung ändert[2]. Diese Beobachtung macht EVs zu attraktiven Objekten der onkologischen Forschung und möglicherweise auch zu Kandidaten für künftige diagnostische und therapeutische Anwendungen.
Im Vergleich zu zirkulierenden Tumorzellen (CTC) weckt vor allem ihre millionenfach höhere Konzentration im Blut Hoffnungen auf eine relativ problemlose Analytik, zumal EVs auch gut eingefroren, gelagert und transportiert werden können. Allerdings sind noch zahlreiche Grundsatzfragen zu klären, ehe an einen Routineeinsatz zu denken ist.
Einteilung und Entstehung
Man unterscheidet drei Kategorien extrazellulärer Vesikel (siehe Tabelle unten): Die Exosomen haben nur etwa 0,1 µm Durchmesser, gefolgt von den bis zu 1 µm großen Mikrovesikeln. Noch größer sind die apoptotischen Körperchen (apoptotic bodies), die im Rahmen des programmierten Zelltods durch Abschnürung ganzer Zellteile freigesetzt werden. Mikrovesikel entstehen durch Ausstülpung der äußeren Zellmembran, Exosomen durch Einstülpung sogenannter Endosomen, die zum endosomalen Membransystem im Zellinnern gehören – ebenso wie etwa die Lysosomen (intrazelluläre Verdauung) oder das endoplasmatische Retikulum (Membranbiosynthese). Diese Endosomen können durch Membraneinstülpungen „Bläschen im Bläschen“ bilden. Dabei entstehen multivesicular bodies (MVB), die mit der äußeren Zellmembran fusionieren und ihren Inhalt als Exosomen in den Extrazellulärraum ausschütten.

Einteilung der extrazellulären Vesikel (EV) nach Entstehung, Größe und Inhalt [1].
Vesikel als Vehikel
Mikrovesikel und Exosomen transportieren im Rahmen des interzellulären Materialtransports molekulare Informationen von den Sender- zu den Empfängerzellen. Erwähnenswert sind vor allem drei Molekülgruppen: messenger-RNA (mRNA), die den genetischen Code für ein neu zu bildendes Protein enthält, mikro-RNA (miRNA), die die Übersetzung (Translation) von mRNA reguliert, sowie Proteine mit vielfältigen Funktionen wie etwa Adressierung der Zielzelle (Oberflächenmarker), Vermittlung der Zell-zu-Zell-Interaktion (Integrine, Selektine) oder Regulation entzündlicher Prozesse (Zytokine).
Dieser Molekülmix aus Proteinen und RNA führte in den letzten zehn Jahren zu einer inzwischen recht gut belegten Hypothese darüber, welche Art von Botschaften zwischen den Zellen übermittelt wird: Die Vesikel dienen offenbar als „Vehikel“ für Informationen über den aktuellen Zustand der Genexpression. Der ist nämlich keineswegs konstant, sondern ändert sich zum Beispiel, wenn die Zelle ausdifferenziert, wenn sie durch Entzündung gestresst ist, oder natürlich auch bei maligner Entartung. Offenbar hat die Senderzelle – vermenschlicht ausgedrückt – eine Art Mitteilungsbedürfnis über ihren Genexpressionszustand und ein Interesse, den Zustand der Empfängerzelle in ihrem Sinne zu beeinflussen.
Bereits 2006 gelang in der Zellkultur der Nachweis, dass embryonale Stammzellen Vesikel ausschütten, die in adulten Zellen embryonale Gene (zum Beispiel Oct-4) reaktivieren können[3]. Dieser Effekt basiert auf der Übertragung der entsprechenden mRNA aus den Vesikeln in die Zielzellen – ähnlich der Infektion einer Zelle mit einem RNA-Virus.
2008 zeigten Arbeitsgruppen aus den USA und Kanada, dass auch menschliche Hirntumoren Expressionsinformationen auf andere Zellen übertragen: Glioblastome geben dabei EVs sowohl in ihre Umgebung, als auch – durch die Bluthirnschranke hindurch – ins Blut ab und können so in ihren Zielzellen spezifische Tumorproteine wie etwa den onkogenen Wachstumsrezeptor EGFRvIII exprimieren[1, 2]. Dadurch werden so komplexe Vorgänge wie die maligne Entartung gesunder Zellen oder die Bildung neuer Blutgefäße (Neoangiogenese) durch Endothelzellen angeregt[1].
Die Rolle der mikro-RNAs
Neben den relativ großen mRNA-Molekülen werden in die Exosomen auch kurze miRNAs verpackt, die ein organ- bzw. tumorspezifisches Muster aufweisen. Sie hemmen die Genexpression, indem sie die Translation bremsen und den Abbau von mRNA beschleunigen. Ein entscheidender Schritt dabei ist die Bindung der miRNAs an komplementäre Sequenzen der zu hemmenden mRNAs.
Man kennt inzwischen mehrere tausend verschiedene miRNAs, deren Muster den jeweiligen Expressionszustand einer Zelle zu reflektieren scheint. So fand man in Blutvesikeln von Patienten mit nicht-kleinzelligen Lungenkarzinomen (NSCLC) vor allem die miRNAs miR-1, -25, -30d, -223, -486 und -499, beim diffusen großzelligen Lymphom (DLBCL) dagegen miR-21, -155 und -210[2]. Derartige „Signaturen“ sind inzwischen für viele weitere Tumoren (Mamma, Prostata, Darm, Ovar usw.) beschrieben, sodass man eines Tages möglicherweise aus dem miRNA-Muster auf den Zustand des Primärtumors schließen kann.
Auch die in den Vesikeln enthaltenen Proteine weisen tumorspezifische Muster auf, die man diagnostisch nutzen könnte. Die oben genannten Glioblastomzellen versenden zum Beispiel neben EGFRvIII auch das für diesen Tumor charakteristische Onkogen Isocitratdehydrogenase 1 (IDH1), und EVs im Blut von Magenkrebspatienten enthalten interessanterweise den Wachstumsrezeptor HER2/neu, der Hinweise auf die Therapierbarkeit mit Trastuzumab gibt.
Der Vollständigkeit halber sei erwähnt, dass sich die „informative Fracht“ der Vesikel nicht auf RNA und Proteine beschränkt; auch Lipide und lipophile Entzündungsmediatoren (z. B. Prostaglandine) werden auf diesem Wege transportiert. Und schließlich ist festzuhalten, dass wohl jede Form von zellulärem Stress, ob körperliche Anstrengung, Hypoxie, Hyperglykämie oder Infektion, zur Ausschüttung von Exosomen mit entsprechenden Reaktionen in anderen Zellen führen.
Analytische Verfahren
Die erste Publikation über EVs stammt aus dem Jahr 1956. Damals entdeckte der Harvardforscher Don Fawcett mithilfe des Elektronenmikroskops im Zytoplasma von Tumorzellen multivesikuläre Strukturen, die ganz offensichtlich den MVBs entsprachen und Exosomen durch Fusion mit der Plasmamembran auszuschütten schienen. Da er die Funktion dieser Vesikel nicht deuten konnte, schenkte die Welt seinen Beobachtungen keine große Aufmerksamkeit.
Jahrzehntelang umfasste das methodische Arsenal der Vesikelforscher fast nur Elektronenmikroskope und Ultrazentrifugen; deshalb kam man über eher deskriptive Ergebnisse nicht hinaus. Erst die Kombination vielfältiger Reinigungs- und Partikelzählverfahren* mit molekularbiologischen Nachweistechniken von der PCR bis zum Next Generation Sequencing führte zu den hier geschilderten Erkenntnissen über die Herkunft und Funktion dieser submikroskopischen Informationsträger[1, 4].
Die Methodenvielfalt darf allerdings nicht über die enormen analytischen Probleme hinwegtäuschen, die noch zu lösen sind. Sie betreffen zum einen die Nachweisempfindlichkeit (Exosomen sind beispielsweise deutlich kleiner als die Wellenlänge des sichtbaren Lichts), zum anderen störende Verunreinigungen, Luftblasen oder Makromolekülkomplexe (Lipoproteine weisen zum Beispiel Durchmesser von 10 bis 1.000 nm auf).
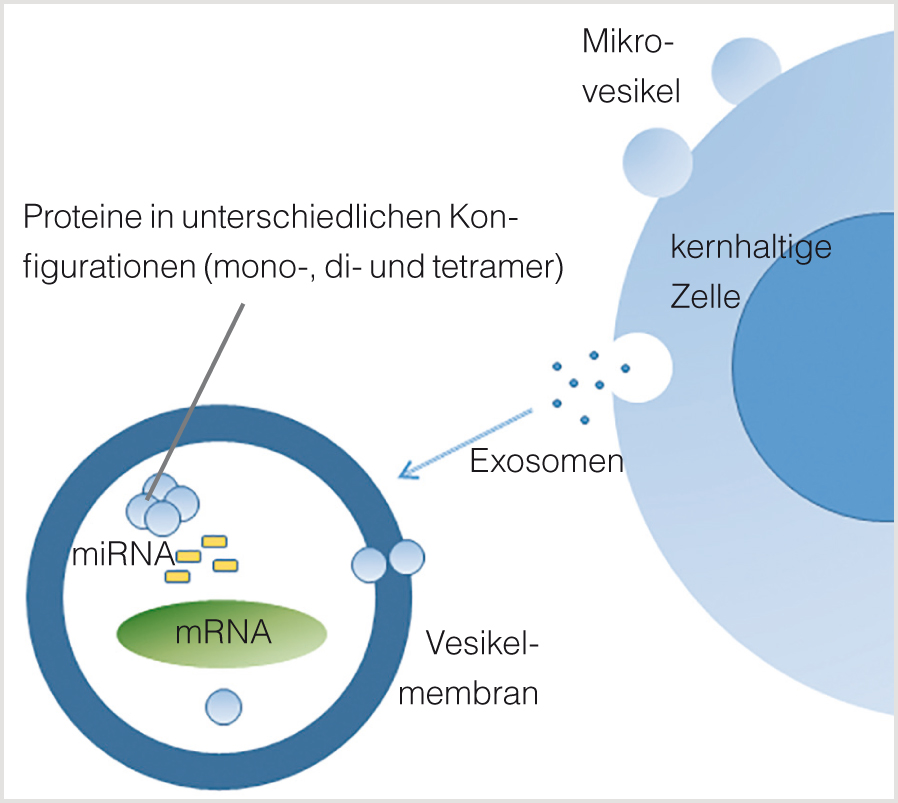
Die nebenstehende Abbildung verdeutlicht die analytische Herausforderung bildlich. Im Vergleich zu kernhaltigen Zellen beträgt der Durchmesser von Exosomen nur etwa ein Hundertstel, ihre Oberfläche nur noch ein Zehntausendstel und ihr Volumen ein Millionstel. Man muss es folglich schaffen, zehn bis maximal hundert Proteinmoleküle auf ihrer winzigen Oberfläche oder ein bis maximal zehn mRNA-Moleküle in einem halben Nanoliter Vesikelvolumen nachzuweisen. So sind zum Beispiel zytometrische Signale, die von der Exosomenoberfläche ausgehen, um den Faktor 10.000 schwächer als bei Zellen. Erschwerend kommt die millionenfach höhere Anzahl an ganz ähnlichen Protein-, RNA- und Lipidmolekülen in den umgebenden Zellen und Flüssigkeiten hinzu. Eine Hauptaufgabe der Vesikelforschung besteht deshalb vorerst noch darin, die Methodik zu verbessern und zu standardisieren.
Die Herausforderung
Ohne Zweifel steckt in den extrazellulären Vesikeln auch für die medizinische Diagnostik ein enormes Potenzial, doch gilt es auch hier, zunächst die Hausaufgaben zu machen. So müssen die von den Forschern vorgeschlagenen Methoden nach üblichen Kriterien wie Richtigkeit und Präzision bewertet, Referenzwerte für verschiedene Körperflüssigkeiten ermittelt und Algorithmen für die multivariate Auswertung erarbeitet werden. In der Musteranalyse kleinster Signale aus einzelnen Vesikeln liegt wohl die größte Chance – und die größte Herausforderung.
gh
*Zum Beispiel Dichtegradientenzentrifugation, Ultrafiltration, Immunoadsorption, PEG-Fällung oder Mikrofluidik-Chips für die Reinigung, sowie Durchflusszytometrie, µNMR, Nanoparticle Tracking Analysis (NTA) oder Scanning Ion Occlusion Sensing (SIOS) für die Zählung und Größenbestimmung.

