Besser als die Natur?
Fortschritte in der Hämophiliebehandlung
Dank sicherer Faktorenkonzentrate ist die Lebenserwartung von Hämophiliepatienten heute fast so hoch wie die von Gesunden. Aktuelle Bestrebungen zielen darauf ab, die Verträglichkeit und praktische Durchführung der Substitutionstherapie zu verbessern.
Die angeborenen Hämophilien A und B sind seltene, X-chromosomal rezessiv vererbte Gendefekte der Gerinnungsfaktoren FVIII bzw. FIX. Da Frauen zwei X-Chromosomen besitzen, sind fast ausschließlich männliche Patienten betroffen. Die Inzidenz liegt bei 1:5.000 (Hämophilie A) bzw. 1:20.000 (Hämophilie B). Daneben gibt es auch erworbene Hämophilien, die meist durch Auto- oder Alloantikörper gegen FVIII, seltener FIX bedingt sind.
Selbst kleinste Gefäßverletzungen können bei diesen Patienten zu Blutungen führen, beispielsweise in mechanisch belasteten Gelenken (Arthropathie). Auch großflächige Hämatome sowie Einblutungen in innere Organe und Nachblutungen nach operativen Eingriffen sind typisch. Durch die im Vergleich zu früher wesentlich besseren Behandlungsmöglichkeiten ist die Lebenserwartung allerdings kaum geringer als in der Normalbevölkerung, sodass zunehmend auch ältere Patienten zur Behandlung kommen.
Diagnosestellung
Hämophilie wird meist über eine Verlängerung von Gerinnungstests, insbesondere der aPTT, entdeckt und durch Folgetests verifiziert. In spezialisierten Zentren gehört bei Neufällen eine Gensequenzierung oft zum Standard, da viele Patienten charakteristische Mutationen zeigen. Von einer schweren Hämophilie spricht man bei Faktorenspiegeln von weniger als 1% (0,01 IU/dl), aber dies ist nicht das einzige Kriterium für den klinischen Schweregrad. So kommt es zum Beispiel bei der Hämophilie A auch auf die Konzentration des von-Willebrand-Faktors (VWF) an.
Um das Zusammenspiel aller beteiligten Komponenten des Gerinnungssystems besser beurteilen zu können, empfehlen sich neben der Bestimmung der Restaktivität mit Gerinnungstests oder den in mancher Hinsicht spezifischeren chromogenen Verfahren auch Thrombingenerierungstests, zum Beispiel CAT (kalibrierte automatisierte Thrombinografie) oder Thrombelastometrie. Durch solche Globaltests lässt sich die Therapie an die individuellen Bedürfnisse des Patienten besser anpassen als über Faktorenbestimmungen. Eine VWF-Bestimmung dient dazu, die Hämophilie A vom VWF-Mangel abzugrenzen. Inhibitorentiter haben sich als unerlässlich für die Verlaufskontrolle erwiesen.
Therapie
Die Hämophilie kann heute dank sicherer Faktorenkonzentrate gut behandelt werden. Für einige Hämophilie-A-Patienten sowie bei manchen Formen des VWF-Mangels kommt eine kostengünstigere Therapie mit dem Vasopressin-Analogon Desmopressin infrage, welches VWF aus Speicherorganellen der Gefäßwand freisetzt.
Die wichtigste, weil zielgerichtete Therapie einer Hämophilie besteht darin, den fehlenden Faktor prophylaktisch so zu substituieren, dass Spiegel über 1% erzielt werden. Standard sind mehrere intravenöse Infusionen pro Woche, deren Häufigkeit individuell angepasst werden muss, da von Patient zu Patient ausgeprägte Unterschiede in der Pharmakokinetik bestehen. Bei der Therapie akuter Blutungsereignisse oder bei Operationen sind sehr hohe Dosierungen erforderlich.
Ab den 1960er-Jahren wurden Faktorenkonzentrate aus Plasma immer höher aufgereinigt und mit dem Aufkommen biotechnologischer Verfahren zunehmend durch weitgehend naturidentische Präparate abgelöst. Bei Faktor VIII gibt es bereits mehrere Generationen, auch Varianten ohne bzw. mit stark verkürzter B-Domäne. Die rekombinante Herstellung in Zellkulturen garantiert nicht nur höchste Reinheit des verabreichten Proteins; auch eine Infektion mit Viren wie HIV, HBV oder HCV – das Hauptproblem früherer Produktgenerationen aus Plasma – wird durch kontrollierte Bedingungen und zusätzliche Inaktivierungsverfahren praktisch ausgeschlossen. Auch Hämophilieprodukte aus Plasma gelten heute dank Virusinaktivierung als sicher.
Das Problem der Inhibitoren
Eine wichtige Komplikation bei der Hämophilie-Therapie besteht in der Bildung von neutralisierenden Antikörpern, sogenannten „Inhibitoren“, die das Blutungsrisiko stark erhöhen. Sie können bei Hämophilie A bis zu 30% und häufiger auftreten; bei Hämophilie B sind sie sehr viel seltener. Die betroffenen Patienten erhalten in der akuten Situation hohe Dosen des fehlenden Faktors, dazu manchmal auch aktivierte Gerinnungsfaktoren, die den Inhibitor umgehen können (z. B. FVIIa).
Zur Elimination des Inhibitors kombiniert man die Gabe von Konzentraten mit sehr hoch dosierten Immunsuppressiva, die nach einiger Zeit häufig zu einer Immuntoleranz führen. Da diese Kombinationstherapie extrem hohe Kosten verursacht, ist die Vermeidung von Inhibitoren bei Neuentwicklungen oberstes Ziel aller Konzentrathersteller.
Innovative Präparate
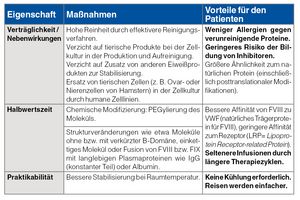
Eine ausgezeichnete Blutstillung sowohl bei der Prophylaxe als auch in akuten Situationen ist schon seit vielen Jahren gewährleistet, aber neuere Entwicklungen (siehe Tabelle unten) zielen nun auf verbesserte Praktikabilität für den Patienten und eine weitere Steigerung der Qualität ab, zum Beispiel auf eine verlängerte Verweildauer im Blut, eine Senkung der Rate an Inhibitoren und Vermeidung allergischer Reaktionen.
Des Weiteren ist durch Verlängerung der Halbwertszeit bei Hämophilie B oft nur noch eine Injektion pro Woche erforderlich, und auch bei Hämophilie A sind Steigerungen der Halbwertszeit auf das 1,5- bis 2-Fache möglich.
Einen ganz anderen Ansatz verfolgt die Entwicklung von monoklonalen Antikörpern, die durch Bindung an FX und FIXa eine ähnliche Funktion wie FVIIIa ausüben und so die Hämostase normalisieren. Dieser Ansatz verspricht aufgrund der subkutanen Gabe und langer Halbwertszeit (nur noch eine Injektion pro Woche) Vorteile.
Die Entwicklung von Antagonisten der wichtigen Proteaseinhibitoren TFPI (Tissue Factor Pathway Inhibitor) oder Antithrombin über RNA-Interferenz oder monoklonale Antikörper kann die Thrombinbildung ebenfalls verbessern und so die Folgen einer Hämophilie indirekt kompensieren. Für Inhibitorpatienten sind verschiedene Präparate in Vorbereitung, meist auf Basis von FVIIa.
Noch weiter entfernt am Horizont stehen Techniken mit adulten Leber-Mesenchym-Stammzellen und die seit vielen Jahren propagierte Entwicklung einer somatischen Gentherapie zur Heilung der Hämophilie. Bis es so weit ist, dürften allerdings noch Jahre, wenn nicht Jahrzehnte vergehen.
Dr. Hans-Jürgen Kolde
Mitglied der Redaktion