Negative Krankheitsassoziation
DFS70-Autoantikörper
Der Nachweis antinukleärer Antikörper dient der serologischen Diagnostik autoimmuner Systemerkrankungen. Mit den DFS70-Antikörpern wurde erstmals eine ANA-Spezifität beschrieben, die mit diesen Erkrankungen negativ assoziiert ist.
Die Bestimmung antinukleärer Antikörper (ANA) ist seit Jahrzehnten der diagnostische Standard bei Verdacht auf eine autoimmune Systemerkrankung[1], beispielsweise auf systemischen Lupus erythematodes (SLE), systemische Sklerose (SSc), Sjögren-Syndrom (SjS), autoimmune Myositis (AIM) und verschiedene Mischkollagenosen (Beispiel Dermatomyositis im Bild oben). Entscheidendes Charakteristikum dieser sog. Kollagenosen sind erhöhte ANA-Titer und typische fluoreszenzoptische ANA-Muster. Gegen welche Antigene die Autoantikörper gerichtet sind, bestimmt man je nach diagnostischer Fragestellung mit spezifischen Immunoassays.
Die Klassifikation der ANA-Muster wird in den Routinelaboren unterschiedlich gehandhabt; meist differenziert man homogene, granuläre, nukleoläre und centromere Muster (siehe Tabelle). Untersuchungen der letzten Jahre haben allerdings gezeigt, dass das sogenannte homogene Muster in mindestens zwei Muster mit unterschiedlicher diagnostischer Relevanz differenziert werden sollte: in das klassische mit dsDNA-Antikörpern assoziierte homogene Muster sowie in das dicht-feingranuläre (dense fine speckled, DFS) mit den im Folgenden näher beschriebenen DFS70-Antikörpern assoziierte Muster[2, 3].
DFS-Muster und ANA-Spezifität
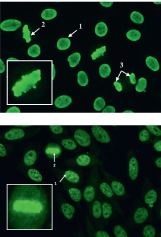
DFS-Muster werden in der Routinediagnostik recht häufig gefunden. Wie die Abbildung rechts zeigt, sind sie durch eine unregelmäßig verteilte, feingranuläre Fluoreszenz der Zellkerne der Interphase sowie des Metaphase-Chromatins charakterisiert. Das nukleäre Zielantigen wurde entsprechend der Reaktivität des Autoantikörpers mit einem 70 kD-Protein im Westernblot als DFS70-Antigen bezeichnet[4].
Dieses Protein wurde von drei unabhängigen Forschergruppen charakterisiert, zum einen als Transkriptionskoaktivator p75, zum anderen als Wachstumsfaktor für Linsenepithelzellen. Daher stammt auch das Synonym LEDGF (lens epithelium–derived growth factor), das jedoch unzutreffend ist, da das DFS70-Antigen in zahlreichen Geweben vorkommt und keine spezifische Bedeutung für die Entwicklung des Linsenepithels hat. Die korrekte Bezeichnung des Proteins lautet PSIP1 (PC4 and SFRS1 interacting protein 1), doch die historisch gewachsene Bezeichnung DFS70 ist für die Routinediagnostik weiterhin gebräuchlich.
Klinische Relevanz
Die Pathophysiologie der DFS70-Antikörper ist trotz zahlreicher Studien weitgehend ungeklärt. Frühe Untersuchungen zeigten eine Assoziation mit interstitieller Zystitis, atopischer Dermatitis und verschiedenen anderen inflammatorischen Erkrankungen sowie mit dem Prostata-Karzinom. Es ist deshalb nicht auszuschließen, dass verschiedene Populationen von DFS70-Antikörpern mit unterschiedlicher pathogenetischer und klinischer Relevanz existieren. Die hohe Prävalenz von DFS70-Antikörpern bei ANA-positiven gesunden Personen spricht dafür, dass bei diesen wie auch bei einem Teil der ANA-positiven Patienten mit unterschiedlichen Erkrankungen die DFS70-Antikörper eher als Paraphänomen (zum Beispiel als Reaktion auf verstärkte Stress-induzierte LEDGF-Expression) anzusehen sind. Vergleichbare Studien an gesunden Personen zeigen eine Prävalenz zwischen 5 und 11%; damit sind DFS70-Antikörper die am häufigsten nachweisbaren ANA-Spezifitäten bei nicht erkrankten Personen[5, 6].
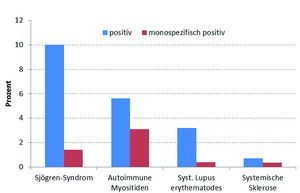
Eine wachsende Anzahl von Studien zeigte in den letzten Jahren sogar eine negative Assoziation der DFS70-Antikörper mit Kollagenosen, insbesondere wenn der Antikörper nicht in Begleitung von erkrankungsspezifischen ANA vorliegt. Die nachfolgende Abbildung stammt aus einer Metaanalyse, die Studien mit über tausend Kollagenose-Patienten umfasst[5] und eine DFS70-Antikörper-Prävalenz von 3,8% ergibt. Analysiert man nur die DFS70-Antikörper, welche bei Abwesenheit von Kollagenose-spezifischen ANA-positiv gemessen wurden, liegt die Nachweisfrequenz bei nur 1%, bei SLE-Patienten sogar nur bei 0,4%. Da in den vorliegenden Studien noch nicht alle Myositis-spezifischen Antikörper bestimmt wurden (z. B. Mi-2), sollte der Anteil monospezifisch nachweisbarer DFS70-Antikörper bei Myositispatienten und damit auch in der Kollagenose-Gesamtpopulation sogar deutlich darunter liegen.
Die Bedeutung der DFS70-Antikörper als Ausschlusskriterium einer Kollagenose wird auch durch Verlaufsuntersuchungen DFS70-Antikörper-positiver gesunder Personen bekräftigt, welche im Beobachtungszeitraum von 4 Jahren keine Kollagenose entwickelten[3]. Darüber hinaus werden im Rahmen von Routineuntersuchungen nur sehr selten DFS70-Antikörper bei Kollagenose-Patienten gefunden.
Diagnostik
Das feingranuläre und das DFS-Muster sind die häufigsten im Routine-Screening an HEp-2-Zellen nachweisbaren ANA-Muster. Während feingranuläre Muster vorwiegend niedrigtitrig vorliegen, sind Antikörper, die DFS-Muster anzeigen, unabhängig vom klinischen Hintergrund auch häufig in mittleren und höheren Titern zu finden. Die Angaben zur Assoziation dieses Musters mit den DFS70-Antikörpern schwanken von 11% bis über 90%[2]. Aufgrund der negativen Assoziation von DFS70-Antikörpern mit Kollagenosen ist zu empfehlen, dass im Rahmen der ANA-Diagnostik alle dsDNA-Antikörper-negativen Proben mit Chromatin-Färbung in der Immunfluoreszenz auf DFS70-Antikörper untersucht werden.
Die Ergebnisse bisheriger Studien zur klinischen Assoziation von DFS70-Antikörpern haben langfristig auch einen möglichen Einfluss auf die Klassifikationskriterien für den SLE, welche als ein Kriterium einen positiven ANA-Befund enthalten. Basierend auf der existierenden Datenlage wäre es sinnvoll, ANA mit DFS-Muster bei Nachweis von DFS70-Antikörpern als Kriterium auszuschließen. Die Testung von DFS70-Antikörpern hat zudem mögliche gesundheitsökonomische Auswirkungen, da mithilfe dieser Antikörper unnötige Überweisungen und Folgeuntersuchungen von asymptomatischen ANA-positiven Patienten vermieden werden können.
Wertvolle neue Biomarker
Mit den Erkenntnissen zur Relevanz von DFS-Mustern und DFS70-Antikörpern eröffnen sich neue Möglichkeiten zur Optimierung der serologischen Stufendiagnostik bei Kollagenose-Verdacht. ANA werden zwar als zuverlässige Screening-Parameter für Kollagenosen angesehen und gelten sogar als Klassifikationskriterium für den SLE, können aber auch zu Fehldiagnosen und bei unklarer oder nicht passender klinischer Symptomatik zu unnötiger Besorgnis bei Arzt und Patienten führen. DFS70-Antikörper sind daher wertvolle neue Biomarker zur besseren Interpretation positiver ANA bei Negativität für Kollagenose-assoziierte Autoantikörper und sollten in modifizierte Testalgorithmen zur Vermeidung unnötiger Überweisungen und Folgeuntersuchungen von ANA-positiven Personen integriert werden.

Priv.-Doz. Dr. med. Karsten Conrad
Medizinische Fakultät der TU Dresden
Institut für Immunologie
Vorgeschmack auf Dresden (Gastkommentar)