Von Genen und Allergenen
Epigenetische Regulationsmechanismen bei allergischen Erkrankungen
Bei allergischen Reaktionen wirken genetische Veranlagung und Umweltfaktoren zusammen. Dabei spielen epigenetische DNA- und Histonmodifikationen eine entscheidende Rolle.
Theoretisch besitzt jede Zelle unseres Körpers das gleiche Genom. Dennoch funktionieren Blutzellen völlig anders als Leberzellen, Lymphozyten anders als Monozyten usw. Der Unterschied resultiert aus dem Zusammenspiel von Genetik und Umwelt, und das biochemische Bindeglied zwischen diesen beiden Welten stellen sogenannte epigenetische Prozesse dar: Sie steuern die Ablesung der Gene im Zellkern (Transkription) und damit deren „Aktivität“ in jeder Zelle.
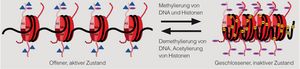
Die Abbildung zeigt typische chemische Reaktionen, die zum Beispiel durch Pollen, Mikroben oder Nahrungsmittel getriggert werden können und auf diese Weise bestimmte Gene für die Ablesung öffnen und wieder verschließen. So unterdrückt eine Methylierung der K9-Region im Histon H3 von Lymphozyten Gene, die für die Entstehung entzündungsfördernder T-Helferzellen wichtig sind. Eine Demethylierung im Gen FOXP3 fördert dagegen die Bildung regulatorischer T-Zellen (Tregs) und dämpft dadurch die Immunantwort.
Die Untersuchung der Wirkungsmechanismen steht noch am Anfang. Kürzlich überprüften wir bei der Maus in einem Asthmamodell den Einfluss einer Sensibilisierung mit Ovalbumin auf CD4-positive Helferzellen[1]. Wir fanden u. a. eine gesteigerte Methylierung des Interferon-γ-Promoters, die zu verminderter Bildung des entsprechenden Zytokins führte. Durch einen Inhibitor (5-aza-2‘-deoxycytidin) ließ sich sowohl die Hypermethylierung als auch die Entwicklung der experimentellen Allergie verhindern. Damit war die epigenetische Natur dieses Effekts – sprich eine Änderung des Phänotyps durch Beeinflussung der DNA-Konformation (siehe Abbildung) ohne Einfluss auf die Basensequenz – bewiesen.
Ähnlich deutliche, wenn auch weniger leicht interpretierbare Ergebnisse wurden bei Mäusen und Patienten mit Hausstauballergie gefunden: Hier führte die Exposition zur Hypermethylierung verschiedener Gene in CD19-positiven B-Zellen, unter anderem im TGF-β-Signalweg, der auf TH1-Helferzellen entzündungshemmend wirkt, oder im CYP26A1-Gen, das für den enzymatischen Abbau von Steroiden und Medikamenten verantwortlich ist.
Frühkindliche Exposition
Im Zentrum der Allergieforschung steht der Effekt, den Mikroorganismen auf das Immunsystem ausüben. So weisen Kinder, die von Geburt an – zum Beispiel in der Landwirtschaft – mit einem breiten mikrobiellen Spektrum konfrontiert sind, später weniger Allergien auf. Bei ihnen findet sich schon im Nabelschnurblut eine verbesserte Abwehrbereitschaft, erkennbar an einem höheren Methylierungsgrad im FOXP3-Gen von T-Zellen. Auch andere in der Immunantwort involvierte Gene (STAT6, ORMDL1, CD14) wiesen epigenetische Aktivierungen auf.
Zu den Kandidaten, die für die postulierte Schutzwirkung verantwortlich sind, gehören gramnegative Bakterien und deren Zellwandbestandteil LPS. Pränatale Exposition senkt auf epigenetischem Weg die Expression bestimmter Zytokine (IFNG, IL-5, IL-13) und Immunglobuline (IgG1, IgE) und vermindert so auch die Allergiebereitschaft. Ähnliche Effekte wurden auch für diätetische Methylgruppenlieferanten wie etwa Folsäure beschrieben.