Die entzündete Psyche
Depression und Immunsystem
Depressionen lösen – entgegengesetzt zur bisherigen Lehrmeinung – bei manchen Menschen übersteigerte Immunreaktionen aus. Umgekehrt kann die Immunabwehr zu depressivem Verhalten führen. Aus der Wechselwirkung zwischen Psyche und Immunsystem ergeben sich pathophysiologische Erkenntnisse, die möglicherweise auch therapeutisch nutzbar sind.
Den „Winterblues“ kennt wohl fast jeder von uns – und irgendwie erscheint es auch natürlich, dass sich die Stimmung eintrübt, wenn die Tage trüber werden. Von einer Winterdepression sollte man aber erst sprechen, wenn der Betroffene in seiner Leistungsfähigkeit deutlich eingeschränkt, also zum Beispiel nicht mehr arbeitsfähig ist, und wenn dieser Zustand mehrere Winter hintereinander auftritt.
Es gibt viele, von der Symptomatik her unterschiedliche Spielarten der Depression. So kann die Winterdepression von anderen Formen durch Schlafbedürfnis statt Schlaflosigkeit und Heißhunger auf Süßes statt Appetitlosigkeit unterschieden werden (siehe link rechts). Doch in Reinform tritt diese Störung nur selten auf. Überlappungen findet man zum Beispiel mit der Dysthymie (griechisch: schweres Gemüt) oder Zyklothymie (Wechsel von depressiven und eher manischen Episoden). Deshalb forderte Prof. F. Holsboer, München, in einer Trillium-Titelgeschichte von 2010, sich zur Differenzierung nicht nur auf die Symptomatik zu verlassen, sondern zusätzlich biochemische Marker heranzuziehen, um die verschiedenen Formen individueller therapieren zu können.
Stress als Abwehrreaktion
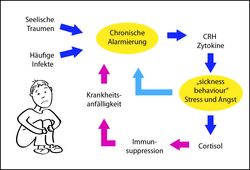
Die wohl wichtigste pathogenetische Erkenntnis der letzten Jahre betrifft die Rolle der sogenannten Stresshormon-Achse (Hypothalamus, Hypophyse, Nebennieren). Stark vereinfacht kann man sagen: Jeder Mensch hat eine individuelle Stressschwelle, die ihn daran hindert, sich selbst zu überfordern. Das ist für das Überleben unserer Spezies durchaus sinnvoll, denn wir brauchen sowohl draufgängerische „Eroberertypen“ mit hoher als auch harmoniebedürftige „Siedlertypen“ mit vergleichsweise niedriger Stressschwelle. Sinkt aber diese Schwelle – aus welchen Gründen auch immer – in einen pathologisch niedrigen Bereich ab, sodass selbst alltägliche Belastungen zur Qual werden, dann kommt es zur klassischen Depression. Übersteigt dagegen die äußere Belastung eine an sich normale Schwelle dauerhaft, so sprechen wir eher von einem Burnout. Die Symptome wie zum Beispiel Angstgefühle, Traurigkeit und Antriebslosigkeit können trotz unterschiedlicher Ursachen identisch sein.
Während man bei der isolierten Winterdepression eine äußere Ursache, nämlich den Lichtmangel, identifizieren konnte, sind die Pathomechanismen der übrigen Depressionsformen vielfältig. Offenbar wirken genetische Veranlagung, traumatische Kindheit, hormonelle Imbalancen und Stress auf komplexe Weise zusammen.
Kindheitserlebnisse
Sigmund Freud ging davon aus, dass belastende Ereignisse in der Kindheit die Basis für spätere emotionale Probleme bilden. Neurobiologische Studien bestätigen diese These: Im heranreifenden Körper von Kleinkindern entstehen psychophysische Schaltkreise, die später im Leben schwer zu verändern sind. Eine glückliche Kindheit erzeugt in der Regel zufriedene Erwachsene, während traumatische Erfahrungen im Vorschulalter das Risiko erhöhen, lebenslang mit Schwermut und Melancholie zu kämpfen.
Ende des 20. Jahrhunderts wurde die bis dahin vorwiegend psychologisch geführte Diskussion durch die experimentelle Hospitalismusforschung um einen überraschenden physiologischen Aspekt bereichert: Nach Daten, die Coe und Mitautoren 1988 erstmals publizierten, führte bei Tieren eine Trennung von der Mutter zu einer Art Entzündungsreaktion mit lange andauerndem Anstieg der Makrophagen-Aktivität. Diese Fresszellen gehören zum sogenannten innaten (angeborenen) Immunsystem und sind eigentlich für die Bekämpfung von Krankheitskeimen und die Beseitigung traumatisch geschädigter Zellen zuständig. Dass auch seelische Traumen die Immunabwehr auf den Plan rufen können, war neu.
Sickness Behaviour
Heute wissen wir um die engen und physiologisch sinnvollen Verknüpfungen zwischen Immunsystem und Psyche. Eine „aufgedrehte Abwehr“ produziert Botenstoffe, die als proinflammatorische (entzündungsfördernde) Zytokine einerseits die Zellen des Immunsystems aktivieren, andererseits aber den Gesamtorganismus deaktivieren. Er wird in einen typisch kranken Zustand von Schlappheit und sozialem Rückzug versetzt, den man als sickness behaviour bezeichnet. Er hindert uns – ähnlich wie die hormonelle Stressschwelle – daran, uns physisch und psychisch zu überfordern. Das ist bei Infektionskrankheiten sinnvoll, denn im Bett – ohne Stress – kann unser Immunsystem eingedrungene Keime besser bekämpfen. Zum Problem wird dieser von Mutter Natur klug eingerichtete Mechanismus erst, wenn die Immunabwehr ständig hochgefahren bleibt, obwohl gar keine antigenen Feinde im Körper sind.
Welche der vielen Botenstoffe nun wirklich an der Entstehung von depressivem Verhalten beteiligt sind, ist umstritten. Dowlati und Kollegen publizierten 2010 die Ergebnisse einer Meta-Analyse mit insgesamt 400 depressiven Patienten und ebenso vielen Kontrollpersonen. Eine signifikante Erhöhung konnte bei den psychisch Kranken für den Tumornekrose-Faktor (TNF-α) und für Interleukin-6 (IL-6) nachgewiesen werden. Dagegen zeigten die 24 referierten Studien uneinheitliche Ergebnisse für IL-2, IL-4, IL-8, Il-10 und Interferon-γ.
Es gibt noch ein weiteres Argument, das die Zytokin-These unterstützt: Eine gefürchtete Nebenwirkung der Krebstherapie mit Zytokinen (insbesondere Interferon-α) ist die Entwicklung schwerer depressiver Symptome. Sie werden darauf zurückgeführt, dass Zytokine die Spiegel des „Glückshormons“ Serotonin im Gehirn senken und so indirekt die angstlösende Wirkung von γ-Aminobuttersäure vermindern.
(Ent-)zündende Experimente
Die Zellwand von Bakterien enthält toxische Lipopolysacharide (LPS), die man isolieren und injizieren kann, um eine Abwehrreaktion auszulösen, obwohl sich keine Erreger im Körper befinden. N. Shanks stellte in den 1990er-Jahren fest, dass die Stresshormon-Achse in einen dauerhaften Alarmzustand versetzt wurde, wenn man Versuchstieren LPS zu einem frühen Zeitpunkt der Entwicklung verabreichte. Die Tiere erwarben eine lebenslange Prädisposition für häufige Entzündungen und zeigten dementsprechend ausgeprägtes sickness behaviour. Interessanterweise neigten sie auch zu verstärkter Ausschüttung von Corticotropin Releasing Hormone (CRH), das im Gehirn Angstgefühle auslöst und in den Nebennieren über ACTH die Ausschüttung von Cortisol steigert.
Eine Bestätigung erfuhren diese frühen Experimente zwanzig Jahre später durch M. B. Hennessy, der 2010 in Tierversuchen zeigte, dass kurz nach der Geburt verabreichte Lipopolysacharide eine vermehrte Zytokinausschüttung auslösten und im adulten Alter zu übertriebenem Erschrecken, verminderter Neugier und reduzierter Mobilität führten.
Beim Menschen lassen sich keine derartigen Bestätigungsexperimente durchführen, aber immerhin ergab eine Längsschnittstudie von A. Danese et al., dass mütterliche Zurückweisung, Kindesmisshandlung und -missbrauch in der Vorgeschichte noch 30 Jahre später im Blut der Betroffenen nachgewiesen werden konnten; bei ihnen waren die Spiegel proinflammatorischer Biomarker chronisch erhöht. Etwa zeitgleich setzten T. W. Pace et al. depressive Männer mit traumatischen Kindheitserlebnissen im Laborversuch psychosozialem Stress aus; im Vergleich zu einer psychisch gesunden Kontrollgruppe zeigten diese Probanden sowohl verstärkte Angstreaktionen als auch übersteigerte Zytokinantworten im Blut.
Zytokine als Trigger
Was war zuerst da: die Henne oder das Ei? Die Antwort lieferte M. B. Hennessy 2011 durch Versuche an Meerschweinchen mit Hospitalismus-Syndrom. Eine Versuchsgruppe wurde vor der Isolierung von der Mutter mit LPS sensibilisiert, eine andere erhielt das entzündungshemmende IL-10. Die LPS-Gruppe zeigte erwartungsgemäß im späteren Leben überschießende Verhaltensstörungen, während die IL-10-Gruppe gegen die Isolation nahezu immun zu sein schien. In einem Kontrollexperiment wurde gesichert, dass eine LPS-Injektion ohne Isolation kaum Auswirkungen auf das Verhalten hatte.
Die Schlussfolgerung heißt also: Proinflammatorische Zytokine allein reichen nicht aus, um depressive Verhaltensstörungen auszulösen. Als „Henne“ in der Kausalkette muss man das psychische Trauma ansehen, aber eine frühkindliche Stimulierung des angeborenen Immunsystems durch LPS wirkt offenbar als Trigger oder Verstärker. Der Grund dürfte sein, dass beide Mechanismen letztlich dieselben Alarmmechanismen im Körper – insbesondere die hormonelle Stressachse – stimulieren.
Was wissen wir also?
1) Auf der Basis von psychischen Traumen bildet sich in der frühen Kindheit ein ständig alarmiertes Stresssystem mit überhöhten Spiegeln von CRH im Gehirn und von Cortisol in der Peripherie aus. Tierexperimentell kann diese Situation durch Trennung der Neugeborenen von der Mutter erzeugt werden; das menschliche Pendant dazu ist der Hospitalismus.
2) Physiologische CRH-Spiegel regeln die „Stressschwelle“ und schützen uns so vor (Selbst-)Überlastungen; bei chronisch erhöhten Werten führt CRH jedoch zu depressivem Verhalten und vermehrter Cortisolausschüttung.
3) Cortisol verbessert die Leistungskraft in Alarmsituationen, unterdrückt aber bei ständig zu hohen Werten die Immunreaktionen gegen Krankheitserreger und macht somit infektionsanfällig.
4) Bei Infektionen schüttet das Immunsystem vermehrt entzündungsfördernde Zytokine aus, die ein typisches Krankheitsverhalten, das sickness behaviour, hervorrufen; seine Symptome sind eigentlich ein Schutzmechanismus gegen Selbstüberforderung im Krankheitsfall – und erinnern ebenfalls an Depression.
4) Depressive Menschen haben höhere Konzentrationen entzündungsfördernder Zytokine im Blut als psychisch Gesunde; sie befinden sich offenbar in einem Zustand ständiger Alarmbereitschaft gegen (nicht vorhandene) Krankheitserreger.
Therapeutische Konsequenzen
Interessant ist vor allem der tierexperimentelle Befund, dass dieser Teufelskreis durch das entzündungshemmende Zytokin IL-10 unterbrochen werden kann. Daraus folgt zwangsläufig die Frage, ob depressive Patienten von einer antiphlogistischen Therapie profitieren könnten. Dafür gibt es in der Tat Anhaltspunkte.
Fehér et al. berichteten 2011, dass Antibiotika und antiinflammatorische Vitamine (u. a. Omega-3-Fettsäuren) bei chronischen Darmentzündungen depressive Symptome verringerten. Kicolt-Glaser et al. konnten 2011 in einer doppelblinden, placebokontrollierten Studie zeigen, dass die Gabe von Omega-3-Fettsäuren bei Medizinstudenten kurz vor dem Examen sowohl IL-6 und TNF-α senkte als auch das Angstgefühl verminderte.
In Tierversuchen erwiesen sich langfristig verabreichte Antiphlogistika wie etwa Indomethacin, MSH, IL-10 oder der Interleukin-Rezeptor-Antagonist IL-1R als wirksam gegen sickness behaviour: Das durch Isolation von der Mutter ausgelöste, krankheitstypische Rückzugsverhalten bildete sich unter diesen Substanzen sogar wieder zurück (Koo und Duman 2009).
Für publikumswirksame Schlagzeilen à la „Aspirin heilt Depressionen“ taugen diese Befunde mit Sicherheit nicht. Aber womöglich eignen sich Zytokinspiegel als Biomarker für eine Untergruppe von Patienten mit gehäuften Infekten in der Kindheit, die verstärkt zu depressivem Verhalten neigt und von Antiphlogistika profitiert. Es wäre den Versuch wert.

Prof. Dr. Erich Kasten
Medical School Hamburg
Mitglied des Fachbeirats