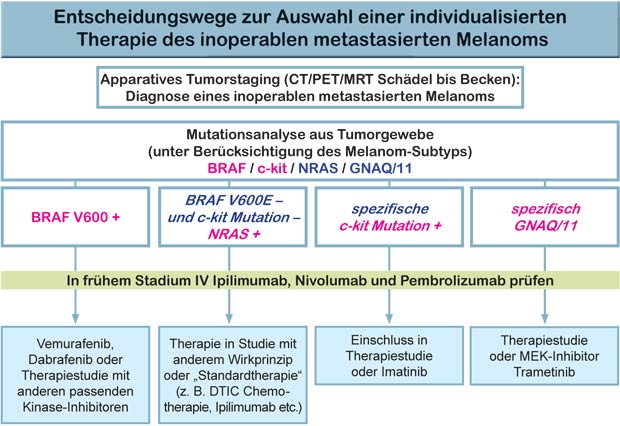
Wegweiser der Therapie
Genmutationen beim malignen Melanom
Neue Therapieschemata auf Basis von molekularpathologischen Mutationsanalysen ermöglichen eine individualisierte Behandlung des inoperablen metastasierten malignen Melanoms.
Das maligne Melanom ist wegen seiner hohen Metastasierungsneigung der bösartigste Hauttumor. Jährlich erkranken in Deutschland etwa 20.000 Patienten am invasiven Melanom, wobei die Häufigkeit mit zunehmendem Alter deutlich ansteigt.
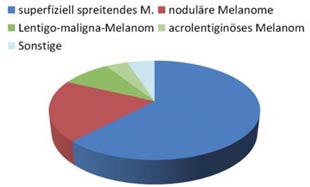
Die häufigsten Melanom-Typen sind in der Abbildung aufgeführt. Als wesentliche histopathologische Prognosekriterien gelten die Gesamttumordicke sowie die Anzahl der Mitosen pro Quadratmillimeter. Aktuell richtet sich das Interesse vor allem auf therapeutisch bedeutsame Genmutationen.
2002 entdeckten Davies et al. beim malignen Melanom Veränderungen des BRAF-Gens, die in der Folge auch bei anderen soliden Tumoren gefunden wurden. Mehr als die Hälfte aller metastasierten Melanome weist Mutationen in diesem Gen auf. Die häufigste wird als V600E bezeichnet (Aminosäure-Position 600, Substitution Valin zu Glutaminsäure), gefolgt von der V600K-Mutation (Position 600, Valin zu Lysin).Weitere seltene BRAF-Mutationen sind bekannt.
Bei jüngeren Patienten mit Melanomen in Sonnenexposition finden sich neben Mutationen von BRAF (50%) auch solche von NRAS und ERBB4 (jeweils 20%). Bei älteren Patienten mit Schleimhautmelanomen oder konjunktivalen Melanomen ohne Sonnenexposition, allerdings auch bei Hautmelanomen (zum Beispiel im sonnenexponierten Gesichtsbereich) kommen KIT-Mutationen mit einer Häufigkeit zwischen 1% und 10% vor. Das Uvea-Melanom wiederum weist in 40% der Fälle GNAQ-Mutationen auf.
Selektive Inhibitoren
Die S3-Leitlinie „Malignes Melanom“ beinhaltet Konsensus-basierte Empfehlungen (3.5.4.) für die Diagnostik und individualisierte Therapie: Auf Mutationen sollte ab dem Stadium IIIB getestet werden (c-kit nur beim acrolentiginösen Melanom und beim Schleimhautmelanom). Werden BRAF- und c-kit-Mutationen gefunden, so stehen spezifische Inhibitoren für BRAF und MEK zur Verfügung, die in Signaltransduktionswege der Differenzierung, Proliferation und Apoptose der Melanomzellen eingreifen (Abb. unten). Sie haben die Behandlung beim fortgeschrittenen Melanom geradezu revolutioniert.
Studienergebnisse
McArthur et al. konnten 2014 zeigen, dass die zielgerichtete Vemurafenib-Therapie das progressionsfreie Überleben bei fortgeschrittenen Melanomen mit BRAFV600E-Mutation gegenüber der seit 1975 verfügbaren Dacarbazin-Therapie von 1,6 Monaten auf 6,9 Monate verlängerte. Die objektiven Response-Raten stiegen von 11% auf 59%.
Das mediane Gesamtüberleben verbesserte sich allerdings nur von 10,0 auf 13,3 Monate, denn aufgrund von Resistenz-Entwicklungen finden sich nach 18 Monaten keine nennenswerten Unterschiede mehr: Die Überlebensraten lagen in beiden Therapiearmen unter 40% – häufig bedingt durch eine Reaktivierung des MAPK-Signalweges. Allerdings sind die Resistenzmechanismen von Patient zu Patient und sogar innerhalb eines Tumors äußerst heterogen.
Um dieser Entwicklung zu begegnen, wurden kombinierte BRAF- und MEK-Inhibitionen (Dabrafenib und Trametinib) bei Melanomen mit BRAF V600-Mutationen initiiert, die eine verbesserte antitumorale Aktivität gegenüber einer entsprechenden Monotherapie aufwiesen.
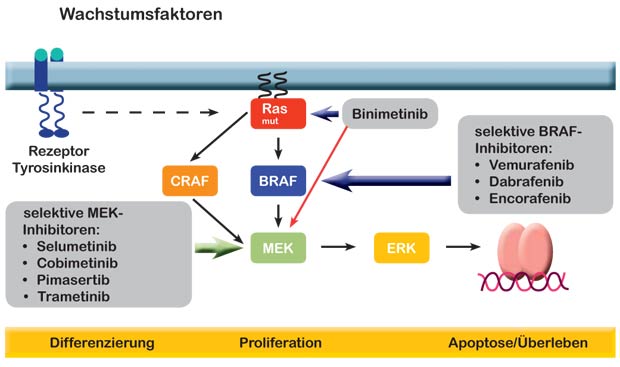
Wahrscheinlich sind Kombinationstherapien der zukünftige Therapiestandard. Als Alternative werden intermittierende Dosierungsschemata (on and off) diskutiert, da trotz Resistenzentwicklung nach einer Therapiepause durchaus der bestehende Signaltransduktionsweg wieder „freigeschaltet“ werden kann.
Auch bei NRAS-mutierten Melanomen könnte zukünftig mit Binimetinib ein Mittel für die zielgerichtete Therapie zur Verfügung stehen. Dazu untersucht die sogenannte NEMO-Studie bei Patienten mit lokal fortgeschrittenen und metastasierten Q61-NRAS-mutierten Melanomen die Therapiearme Binimetinib vs. DTIC (NRAS-mutant melanoma Phase 3, ohne Vorbehandlung oder nach Versagen der Immuntherapie).
Zusammengefasst ist zu sagen, dass die Therapieerfolge beim malignen Melanom ein Ergebnis systematischer Forschung sind, wobei die Suche nach den geeignetsten Kombinationstherapien gerade erst begonnen hat.

Prof. Dr. med. Christopher Poremba
Pathologie München-Nord & ZMOMP Düsseldorf
poremba[at]pathologie-muenchen[dot]de
Prof. Dr. med. Rudolf Stadler
Johannes Wesling Klinikum Minden

