Die Tumorentität Mammakarzinom zerfällt längst in eine ganze Reihe von biologisch teilweise sehr unterschiedliche Subgruppen, die auch ganz unterschiedlich therapiert werden. Zu nahezu allen häufigeren Formen – metastasiert versus früh, Hormonrezeptor-positiv, HER2-positiv, triple-negativ – gab es bei der Jahrestagung der American Society of Clinical Oncology im Juni in Chicago interessante neue Resultate.
Metastasierte Situation
Hormonrezeptor-positive Tumoren
Beim endokrin aktiven, d. h. beim Hormonrezeptor-positiven Mammakarzinom gab es in den letzten Jahren Fortschritte, insbesondere durch die Einführung von Inhibitoren der Cyclin-abhängigen Kinasen 4 und 6: Drei solche Substanzen sind mittlerweile zugelassen, und sie alle werden in Kombination mit endokrinen Therapien angewendet und haben zu einer Verlängerung des progressionsfreien Überlebens in einer ganz ähnlichen Größenordnung geführt.
CDK-Inhibition: Überlebensvorteil in der Prä-Menopause
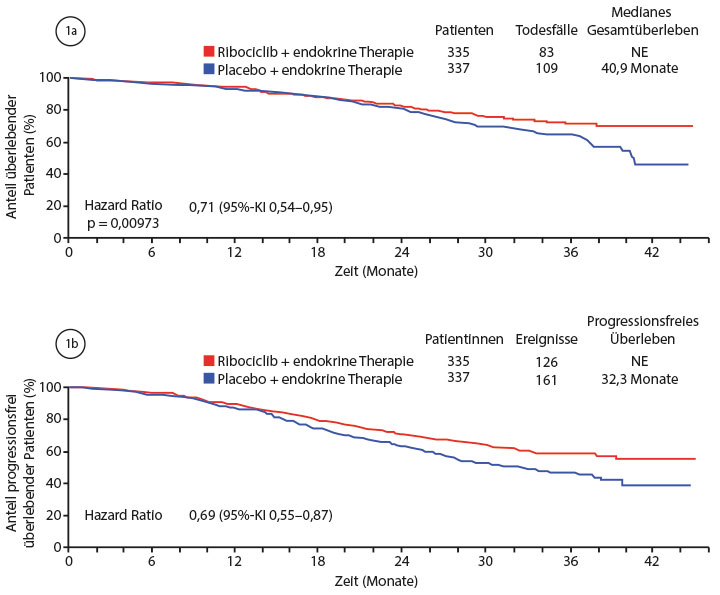
In der randomisierten Phase-III-Studie MONALEESA-7 war dieses Prinzip bei insgesamt 672 prämenopausalen Patientinnen untersucht worden, die eine endokrine Therapie mit Goserelin und entweder einem nicht-steroidalen Aromataseinhibitor oder Tamoxifen sowie zusätzlich randomisiert den CDK4/6-Inhibitor Ribociclib oder ein Placebo erhalten hatten. Bis auf eine eventuelle vorangegangene adjuvante Therapie waren die Patientinnen noch nicht wegen ihres fortgeschrittenen Tumors behandelt worden.
Die erste Interimsanalyse hatte bereits einen erheblichen Vorteil für die Zugabe des CDK4/6-Inhibitors beim progressionsfreien Überleben gezeigt, das sich gegenüber der alleinigen endokrinen Therapie von median 13,0 auf 23,8 Monate verlängerte (Hazard Ratio 0,55; p < 0,0001; [1]). In der zweiten Interimsanalyse, die Sara Hurvitz, Los Angeles, in Chicago vorstellte [2] und die zeitgleich publiziert wurde [3], war nun auch ein Unterschied beim Gesamtüberleben nachweisbar: Nach 42 Monaten Nachbeobachtungszeit waren im Ribociclib-Arm noch 70,2%, im Placeboarm lediglich 46,0% der Patientinnen am Leben – eine Reduktion des Mortalitätsrisikos um 29% (HR 0,71; p = 0,00973; Abb. 1a). Dieser Vorteil war in der Subpopulation der 495 Patientinnen, die einen Aromataseinhibitor bekommen hatten, vergleichbar (HR 0,70; 95%-KI 0,50–0,98). Rund 70% der Patientinnen in beiden Armen haben bisher eine anti-neoplastische Folgetherapie erhalten; bei der Zeit von der Randomisierung bis zu Progression unter der Zweitlinientherapie oder Tod schnitt der Verumarm ebenfalls günstiger ab (HR 0,69; 95%-Konfidenzintervall 0,55–0,87; Abb. 1b).