Wir erleben derzeit eine spannende Phase der Erweiterung von Therapieoptionen über nahezu alle Tumorentitäten. Auch bei den urologischen Tumoren werden, insbesondere durch Fortschritte der Immunonkologie, neue Therapieoptionen und -algorithmen diskutiert. Aber auch die etablierten Therapiestrategien entwickeln sich weiter und führen zu besser verträglichen Behandlungen sowie zu einer verbesserten Anwendung. Beim Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU) in San Francisco wurden viele wichtige Ergebnisse aus aktuellen klinischen Studien präsentiert.
Nierenzellkarzinom
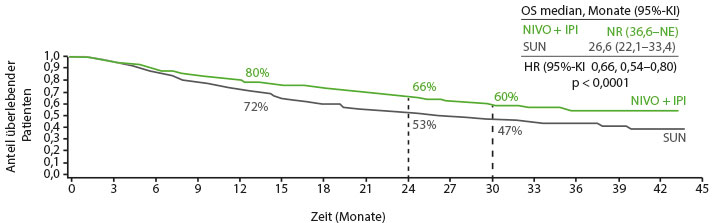
Immunonkologische Kombination ist TKI-Standard überlegen
Die Kombination der zwei Immuncheckpoint-Inhibitoren Nivolumab und Ipilimumab ist als Erstlinientherapie für Patienten mit fortgeschrittenem Nierenzellkarzinom (RCC) und mittlerem oder hohem Risiko zugelassen – auf der Basis einer Überlegenheit gegenüber Sunitinib bezüglich des Gesamtüberlebens (OS), die in der randomisierten Phase-III-Studie CheckMate-214 gezeigt werden konnte. Beim ASCO-GU wurde die erweiterte Wirksamkeits- und Sicherheitsanalyse für die 1.096 Patienten der ITT-Population mit einer verlängerten Nachbeobachtungszeit von median 32,4 Monaten präsentiert [1]. 847 der eingeschlossenen Patienten wiesen ein mittleres oder hohes Risiko auf. Bei ihnen fand sich eine konsistente Verbesserung der Wirksamkeit unter der Immunkombination gegenüber Sunitinib auch noch nach 30 Monaten: Unter der Immun-Kombinationstherapie waren noch 60%, unter Sunitinib nur 47% der Patienten am Leben (Hazard Ratio 0,66; p < 0,0001; Abb. 1), 28% versus 12% der Patienten lebten noch ohne Progress (HR 0,77; p = 0,0014), und die Ansprechraten auf die beiden Protokolle lagen bei 42% versus 29% (p = 0,0001) mit 11% versus 1% Komplettremissionen bei den Patienten mit mittlerem und hohem Risiko. Für die Subgruppe der Patienten mit geringem Risiko fanden sich für keine der genannten Zielgrößen signifikante Unterschiede. Mit der längeren Nachbeobachtungszeit wurden keine neuen Sicherheitssignale beobachtet. Therapie-assoziierte unerwünschte Ereignisse waren mit 94% vs. 97% ähnlich häufig, Therapie-assoziierte Nebenwirkungen vom Grad 3–4 traten unter der Immun-Kombination mit 47% vs. 64% seltener auf, und dann vorwiegend in den ersten beiden Monaten der Behandlung.