Der Inhibitor von PD-1 (Programmed Cell Death 1 Protein) Pembrolizumab ist seit Kurzem auch zur adjuvanten Therapie von Patienten mit malignem Melanom im Stadium III mit Lymphknotenbeteiligung nach vollständiger Resektion zugelassen. Die Rezidiv- und Sterberate der Patienten unter Pembrolizumab war in der Zulassungsstudie im Vergleich zur Placebo-Gruppe fast halbiert, weitgehend unabhängig von der PD-L1-Expression oder vom BRAF-Mutationsstatus.
Die Prognose von Melanom-Patienten mit erfolgreich reseziertem Primärtumor variiert in Abhängigkeit von Tumordicke, Ulzeration des Tumors und Befund in den regionären Lymphknoten erheblich. Sind bereits regionäre Lymphknoten – der häufigste Ort einer Erst-Metastasierung – befallen, sinkt die 10-Jahres-Überlebenswahrscheinlichkeit auf rund 15–25%, berichtete Professor Dr. Ralf Gutzmer von der Medizinischen Hochschule Hannover. Zur Verbesserung der Prognose sei eine Systemtherapie erforderlich.
Neue Immuncheckpoint-Inhibitoren und zielgerichtete Therapien haben bei solchen Hochrisiko-Patienten einen großen Fortschritt im adjuvanten Setting ermöglicht. Im Vergleich zu Interferon-alpha, dem langjährigen Standard bei Melanom-Patienten im Stadium II und III, seien die neuen Substanzen in der Rezidivprophylaxe nicht nur deutlich wirksamer, sondern auch verträglicher, betonte Gutzmer. In Studien konnte die Rezidivrate etwa halbiert werden; dagegen liegt die Risikoreduktion unter Interferon bei nur rund 10%, und das dosisabhängig auf Kosten von Nebenwirkungen wie Müdigkeit, Grippe-artigen Symptomen, Leberwert-Erhöhungen und Depressionen.
Die Daten aus der Zulassungsstudie KEYNOTE-054 zur adjuvanten Therapie mit Pembrolizumab (Keytruda®) bestätigen die Effizienz der neuen Substanzklasse: „Due Zahl der Rezidive wurde etwa halbiert“, berichtete Professor Dr. Christoffer Gebhardt vom Universitätsklinikum Hamburg-Eppendorf. Zudem war die Wirkung weitgehend unabhängig von BRAF-Mutationsstatus, PD-L1-Status oder Krankheitsstadium (IIIA-IIIC).
An der Zulassungsstudie nahmen 1.019 Erwachsene mit vollständig reseziertem Melanom teil (Stadium IIIA [> 1 mm Lymphknotenmetastase], IIIB oder IIIC), die meisten im Stadium IIIB [1]. Sie waren im Median 54 Jahre alt, über 80% waren PD-L1-positiv (> 1%) und mehr als 40% hatten eine BRAF-Mutation. Die Patienten wurden randomisiert bis zu einem Jahr bzw. bis zum Auftreten einer unzumutbaren Toxizität oder eines Rezidivs entweder mit Pembrolizumab 200 mg (n = 514) oder mit Placebo (n = 505) als intravenöse Infusion alle drei Wochen behandelt.
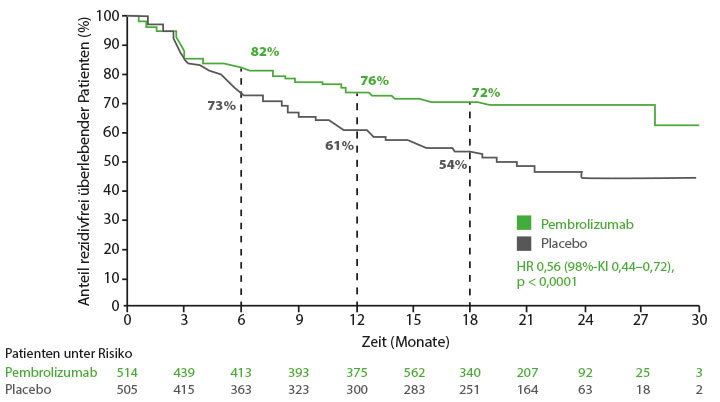
Das rezidivfreie Überleben (RFS, definiert als Zeit bis zum ersten Rezidiv oder Tod) war im Pembrolizumab-Arm signifikant verlängert, das Risiko für Rezidiv oder Tod um 44% gegenüber Placebo verringert (Hazard Ratio 0,56; 98%-Konfidenzintervall 0,44–0,72; p < 0,0001; Abb. 1). In der gesamten Intent-to-treat-Population betrug die RFS-Rate nach zwölf Monaten 76% im Pembrolizumab- und 61% im Placeboarm, nach 18 Monaten waren es 72% bzw. 54%. Das Risiko von Fernmetastasen als erstem Rezidiv wurde um 47% verringert, berichtete Gebhardt.
Bei Patienten mit PD-L1-positiven Tumoren (n = 853) wurde eine Senkung des Rezidiv- bzw. Sterberisikos um 46% (HR 0,54; 95%-KI 0,42–0,69) gegenüber Placebo erzielt. Die RFS-Rate nach sechs Monaten betrug 84% im Pembrolizumab- bzw. 75% im Placeboarm. Weitere Vergleiche von Patienten mit negativem PD-L1-, positivem oder negativem BRAF-Mutationsstatus und unterschiedlichen Krankheitsstadien ergaben ebenfalls geringe Unterschiede.