Die Europäische Kommission hat Olaparib (Lynparza®) als Monotherapie zur Behandlung von erwachsenen Patientinnen mit einem HER2-negativen, lokal fortgeschrittenen oder metastasierten Mammakarzinom mit BRCA1/2-Keimbahnmutation (gBRCA) zugelassen. Zuvor hatte das Committee for Medicinal Products for Human Use (CHMP) der EMA eine positive Empfehlung für die Zulassungserweiterung von Olaparib Filmtabletten zur Behandlung des fortgeschrittenen Mammakarzinoms abgegeben, die auf den Daten der Phase-III-Studie OlympiAD basiert [1, 2].
Der erste PARP-Inhibitor mit einer Indikation, die über das Ovarialkarzinom hinausgeht, bietet einer Gruppe von Patientinnen mit fortgeschrittenem Mammakarzinom eine neue Behandlungsoption [3] und hebt die Bestimmung des BRCA-Status zusätzlich zum Hormonrezeptor- und zum HER2-Expressionsstatus als weitere diagnostische Voraussetzung zur Behandlung dieser Krankheit hervor.
Risiko für Krankheitsprogression oder Tod signifikant reduziert
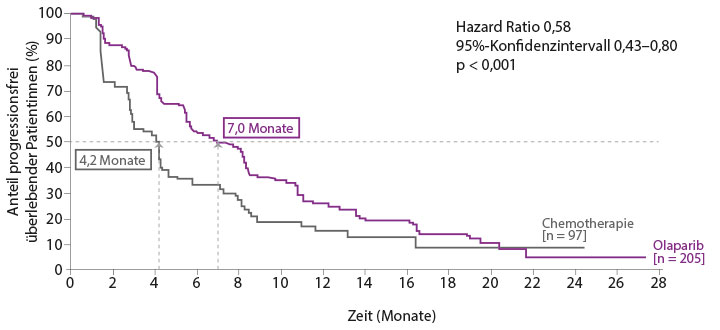
„Für Patientinnen mit metastasiertem Brustkrebs, die sich ja in einer palliativen Situation befinden, ist es von großer Bedeutung, so lang und so gut wie möglich mit der Erkrankung zu leben“, sagte Dr. Rachel Würstlein, München. Die Oberärztin der Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe am Klinikum der Ludwig-Maximilians-Universität stellte auf der Zulassungspressekonferenz in Berlin die Ergebnisse der randomisierten, offenen Phase-III-Studie OlympiAD vor, die die Wirksamkeit und Verträglichkeit von Olaparib-Filmtabletten im Vergleich zu einer von drei Chemotherapien nach Wahl des Prüfarztes (Capecitabin, Eribulin oder Vinorelbin) untersuchte. Danach reduzierte sich das Risiko für Krankheitsprogression oder Tod signifikant um 42% (Abb. 1):