Lokal fortgeschrittenes Rektumkarzinom: Aktuelle Aspekte und Entwicklungen in der perioperativen Therapie
Dieser Übersichtsartikel behandelt einige wichtige aktuell diskutierte Fragen, die derzeit in klinischen Studien zur Therapie des lokal fortgeschrittenen Rektumkarzinoms untersucht werden:
- Was ist die optimale perioperative Chemotherapie? Sollte in Analogie zum Kolonkarzinom Oxaliplatin eingesetzt werden? Kann Capecitabin 5-Fluorouracil (5-FU) ersetzen?
- Bei welchen Patienten kann man auf eine neoadjuvante Radiotherapie (RT) oder Radiochemotherapie (RChT) verzichten?
- Ist ein Zeitintervall von sechs Wochen zwischen Abschluss der präoperativen RChT und Operation zu kurz?
- Welchen Stellenwert hat die Induktions- oder Konsoliderungs-Chemotherapie, d. h. eine Chemotherapie vor oder nach der neoadjuvanten RChT?
- Bei welchen Patienten kann man im Falle einer klinischen Komplettremission (cCR) nach RChT auf die Chirurgie verzichten bzw. bei signifikanter Tumorverkleinerung durch lokale Exzision einen funktionellen Organerhalt erreichen?
Schlüsselwörter: lokal fortgeschrittenes Rektumkarzinom, perioperative (Radio-)Chemotherapie, Induktions-Chemotherapie, Konsolidierungs-Chemotherapie, Organerhalt, „Watchful waiting“
Rektumkarzinom: Status quo
Rektumkarzinome sind Adenokarzinome, deren Tumorunterrand 0–16 cm von der Anokutanlinie entfernt liegt. Beim prätherapeutischen Staging wird die Tumorlokalisation stets durch das starre Rektoskop festgelegt. Mit der qualitätsgesicherten MRT-Untersuchung wird zusätzlich die Ausbreitung des Tumors ins perirektale Fettgewebe und seine Beziehung zum zirkumferenziellen Resektionsrand (CRM) bestimmt. Die MRT wird damit in Zukunft beim lokal fortgeschrittenen Rektumkarzinom therapieentscheidend nicht nur in klinischen Studien, sondern auch in der Praxis werden.
Für den langfristigen Therapieerfolg (lokoregionäre Tumorkontrolle, Vermeidung eines Lokalrezidivs) ist die Operation unter Einhaltung standardisierter, onkologischer Radikalitätsprinzipien entscheidend. Oberstes Ziel und zugleich Voraussetzung für die effektive adjuvante Therapie ist eine R0-Resektion. Die qualitätskontrollierte totale mesorektale Exzision (TME) stellt den Standard in den unteren beiden Rektumdritteln (0–6 und > 6–12 cm ab Anokutanlinie) dar. Die laparoskopische ist der offenen Resektion nicht unterlegen. Für Karzinome im oberen Rektumdrittel wird der Stellenwert der TME im Vergleich zur kontrollierten partiellen mesorektalen Resektion in der GAST-05-Studie randomisiert überprüft.
Die Radiotherapie (RT), prä- oder postoperativ eingesetzt, reduziert signifikant die lokoregionäre Rezidivrate bei konventioneller wie bei TME-Resektion. Sie kann entweder als Kurzzeitbestrahlung über fünf Tage oder als Langzeit-Radiochemotherapie (RChT) erfolgen. In Deutschland wird traditionell eher die RChT bevorzugt, wenngleich eine Überlegenheit hinsichtlich harter Endpunkte (Lokalrezidivrate, krankheitsfreies Überleben (DFS), Gesamtüberleben (OS)) nicht in randomisierten Studien gezeigt wurde. Bei großen Tumoren mit dem Therapieziel Tumorschrumpfung, bei befallenem CRM und bei möglicherweise zu erhaltendem Sphinkter soll auf jeden Fall die RChT eingesetzt werden.
Sie sollte mit 5-FU oder – bevorzugt – mit Capecitabin durchgeführt werden. Nach der Resektion empfiehlt die S3-Leitlinie, unabhängig vom Ansprechen auf die neoadjuvante RChT die Chemotherapie adjuvant weiterzuführen, d. h. auch bei kompletter Remission. Wie noch auszuführen sein wird, ist dieser Punkt international und zunehmend auch national umstritten [1]. Der Benefit von Oxaliplatin in der perioperativen Therapie wurde in mehreren Studien untersucht, die Datenlage ist nicht eindeutig. Ein genereller Einsatz in der perioperativen RChT ist nicht gerechtfertigt. Für den Einsatz monoklonaler Antikörper besteht in der Therapie des lokal fortgeschrittenen Rektumkarzinoms keine Indikation.
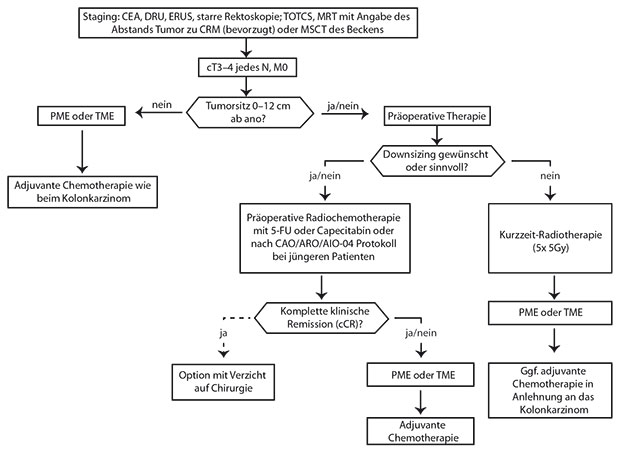
Im Folgenden sollen – chronologisch entsprechend ihrer Stellung im Behandlungsverlauf – einige der hier aufgeführten Aspekte behandelt werden. Mögliche Schlussfolgerungen aus den Ausführungen sind im folgenden Text grau hinterlegt. Ein Therapiealgorithmus für lokal fortgeschrittene Rektumkarzinome, basierend auf den unten zu beschreibenden Daten, wird in Abb. 1 vorgeschlagen.
Capecitabin statt 5-FU mit der Radiatio kombinieren? Oxaliplatin zusätzlich zur perioperativen Radiochemotherapie geben?
In der klinischen Praxis wird beim lokal fortgeschrittenen Rektumkarzinom zunächst eine neoadjuvante RChT durchgeführt und postoperativ durch die adjuvante Chemotherapie komplettiert. Akzeptiert man diesen derzeitigen Standard, so stellt sich die Frage, welche Chemotherapeutika wir prä- bzw. postoperativ, d. h. in der adjuvanten Situation einsetzen sollen.
In der Neoadjuvanz kann man nach Daten der 2015 publizierten NSABP-R04-Studie sowie einer jüngst veröffentlichten Metaanalyse auf das aufwendige infusionale 5-FU verzichten [2, 3]. In der NSABP-Studie wurde es in einem 2 x 2-
faktoriellen Design mit Capecitabin – jeweils mit oder ohne Oxaliplatin – verglichen. Der primäre Endpunkt „local failure rate“ war in allen Armen gleich [2]. In die Metaanalyse von Liu et al. [3] gingen Studien ein, in denen neoadjuvantes Capecitabin mit 5-FU plus Strahlentherapie verglichen wurde. Die Ergebnisse der neun analysierten Studien (n = 3.141) zeigen für Capecitabin signifikant bessere pCR-Raten (Odds Ratio 1,34; p = 0,003), besseres T-Downstaging (OR 1,58; p = 0,0007), besseres N-Downstaging (OR 2,06; p = 0,001) und weniger Fernmetastasen (OR 0,63; p = 0,007), aber eine höhere Rate an Hand-Fuß-Syndromen (OR 4,43; p = 0,004). Mit diesen Daten ist der Einsatz von Capecitabin anstelle von infusionalem 5-FU gut belegt.
Oxaliplatin präoperativ?
Fünf große randomisierte Studien untersuchten den Stellenwert von Oxaliplatin zusätzlich zu 5-FU oder Capecitabin in der perioperativen RChT. Eine italienische [4] und eine französische Studie [5] sowie die NSABP-R04-Studie [2, 6] haben Ergebnisse publiziert. Diese drei Studien stellten lediglich die Frage nach dem Nutzen von Oxaliplatin als Radiosensitizer zusätzlich zu Fluoropyrimidinen während der neoadjuvanten RChT und zeigten keinen Nutzen hinsichtlich früher Endpunkte (pCR-Rate, R0-Resektionen, Sphinkter-Erhalt), berichteten jedoch über deutlich erhöhte Akuttoxizitäten (Tab. 1). Die französische Studie hatte in der ersten Langzeitauswertung darüber hinaus keinen Vorteil für das DFS bzw. das OS gezeigt [5]. Die erste Schlussfolgerung, dass man Oxaliplatin nicht als „add-on“ zu einer Fluoropyrimidin-basierten RChT einsetzen sollte, wurde durch die beim ASCO-Kongress 2016 vorgestellten Langzeitresultate der italienischen und der französischen Studie wieder ins Schwanken gebracht [7, 8].
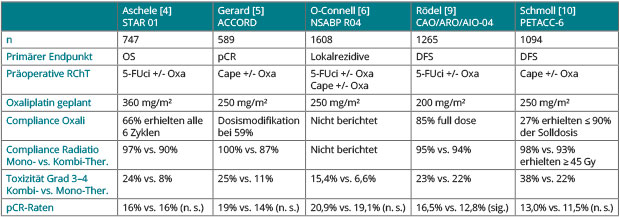
In der italienischen Studie (STAR; [7]) erhielten die Patienten 5-FU als Dauerinfusion (225 mg/m² und Tag) und 50,4 Gy Bestrahlung sowie im experimentellen Arm zusätzlich sechsmal wöchentlich 60 mg/m² Oxaliplatin. In den finalen Ergebnissen nach median 8,9 Jahren war beim Gesamtüberleben (HR 0,82; 95%-KI 0,64–1,05; p = 0,114; entsprechend einem absoluten Benefit von 3% nach fünf bzw. 5% nach acht Jahren), beim metastasenfreien Überleben (HR 0,86; p = 0,30) und bei der Lokalrezidivrate (HR 0,81; p = 0,39) der experimentelle Arm besser, wenngleich in keinem Fall Signifikanz erreicht wurde. Subgruppenanalysen liegen bislang nicht vor, und die Daten zur adjuvanten Therapie, die im Studienprotokoll nicht vorgeschrieben war, wurden gleichfalls nicht berichtet. Dennoch sind die Unterschiede angesichts der niedrigen Dosierung von Oxaliplatin sehr interessant.
Ein ähnliches Bild zeigen Langzeitdaten der französischen Studie ACCORD12/
PRODIGE2 [8]. Darin erhielten die insgesamt 584 Patienten im Standardarm Capecitabin + 45 Gy, im experimentellen Arm Capecitabin + Oxaliplatin wöchentlich (5 x 50 mg/m²) + 50,4 Gy, d. h. Radiatio und Chemotherapie wurden intensiviert. Das OS war im experimentellen Arm numerisch verbessert (HR 0,71; 95%-KI 0,50–1,01; p = 0,56), ebenso das DFS (HR 0,86; 95%-KI 0,66–1,11; p = 0,25). Auch in dieser Studie wurden keine Daten zur Adjuvanz berichtet, die gleichfalls nicht vorgeschrieben war. Die Langzeitdaten zur Lebensqualität waren indes zwischen den Armen vergleichbar.
Aus diesen Langzeitdaten lässt sich eine interessante Hypothese ableiten: Möglicherweise verbessert der frühzeitige Einsatz von Oxaliplatin die Langzeitergebnisse, nicht aber die frühen lokalen Endpunkte wie pCR-Rate, Sphinkter-Erhalt, Toxizität etc. Dies könnte ein Argument für Induktions- (Chemotherapie vor RChT) oder Konsolidierungstherapien (Chemotherapie nach RChT und vor Resektion) sein.
Oxaliplatin postoperativ?
Wie erwähnt wurde in zwei der fünf Studien Oxaliplatin auch postoperativ eingesetzt [9, 10]. Primäres Ziel war in beiden Studien eine Verbesserung des DFS um ca. 7% (CAO/ARO/AIO-04:
75% –> 82%; PETACC-6: 3-Jahres-DFS 65% –> 72%).
CAO/ARO/AIO-04 war eine randomisierte Phase-III-Studie, die an insgesamt 1.236 evaluierbaren Patienten die Zugabe von Oxaliplatin zu 5-FU in der neoadjuvanten RChT und in der adjuvanten Chemotherapie des lokal fortgeschrittenen Rektumkarzinoms untersuchte (cT3–4 oder cN+, 0–12 cm ab ano; [9]). In der experimentellen Gruppe bestand die neoadjuvante Therapie aus 50,4 Gy plus infusionalem 5-FU (250 mg/m² Tag 1–14 und 22–35) und Oxaliplatin (50 mg/m² Tag 1, 8, 22, und 29), gefolgt von Chirurgie und acht Zyklen FOLFOX6. Grad-3/4-Nebenwirkungen im Rahmen der Neoadjuvanz waren unter 5-FU/Oxaliplatin leicht vermehrt, die volle Dosis konnten 85% der Patienten im 5-FU/Oxaliplatin- und 79% im 5-FU-Arm erhalten. Die Intensität der Strahlentherapie war vergleichbar. Tief-anterior wurden in beiden Armen gleich viele Patienten reseziert (68% bzw. 67%) bei identischer chirurgischer Morbidität und Mortalität.
Eine komplette mesorektale Resektion war in beiden Armen mit etwa 75% gleich häufig, ebenso R0-Resektionen. Die pCR-Rate war im experimentellen Arm in einer nicht geplanten exploratorischen Analyse signifikant höher (17% vs. 13%; OR 1,40; p = 0,038). 78% der Patienten begannen die adjuvante Chemotherapie, etwa 80% in beiden Armen beendeten sie regelrecht. Die Spättoxizitäten waren nicht signifikant unterschiedlich. Das DFS – primärer Endpunkt – war signifikant verbessert (3-Jahres-Raten 75,9% vs. 71,2%; HR 0,79; 95%-KI 0,64–0,98; p = 0,03). In der explorativen Subgruppenanalyse zeigte sich ein geringerer Nutzen für Oxaliplatin bei über 70-Jährigen (HR 1,06). Keine Unterschiede fanden sich hinsichtlich der ypT-, ypN- sowie ypTNM-Stadien. Die 5-Jahres-Überlebensraten in beiden Armen waren nicht signifikant unterschiedlich (jeweils 78%).
In PETACC-6 wurden insgesamt 1.094 Patienten mit Tumoren ≤ 12 cm ab ano eingeschlossen (cT3/4 oder N+ anhand von Endosonografie oder MRT des Beckens; [10]). Die Patienten erhielten eine RChT mit 45 oder 50,4 Gy in 25–28 Fraktionen. Die begleitende Chemotherapie enthielt im Standardarm Capecitabin 1.650 mg/m² (in zwei Tagesdosen) an den Tagen der Bestrahlung, im experimentellen Arm zusätzlich Oxaliplatin (50 mg/m² pro Woche). Vier bis acht Wochen nach Ende der RChT erfolgte die TME. Die adjuvante Chemotherapie sah sechs Zyklen Capecitabin 2.000 mg/m² ± Oxaliplatin 130 mg/m² alle drei Wochen vor. Die Durchführbarkeit der neoadjuvanten Therapie war im Oxaliplatin-Arm schlechter: 96% der Patienten konnten ≥ 45 Gy erhalten (unter Capecitabin alleine 99%), 84% erhielten ≥ 80% der Capecitabin-Dosis (vs. 95% mit Capecitabin alleine). Die Rate an Grad-3/4-Nebenwirkungen war deutlich höher (38% vs. 15%), bei jeweils einem toxischen Todesfall. Vergleichbar waren TME-Rate (jeweils 89%) und R0-Resektionen (96% bzw. 97%). Es fand sich keine Verbesserung der pCR-Rate durch Oxaliplatin (14% vs. 12%).
Der primäre Endpunkt in PETACC-6 wurde verfehlt (3-Jahres-DFS Capecitabin 76,5%, Capecitabin + Oxaliplatin 75,4%; HR 1,04; p = 0,77). Frappierend war, dass die deutschen Patienten (etwa zwei Drittel der eingeschlossenen Patienten) sogar eine HR von 1,24 (95%-KI 0,93–1,65, p = 0,15) hatten und damit im Oxaliplatin-Arm deutlich schlechter liefen, während die nicht-deutschen Patienten mit einer HR von 0,68 grenzwertig signifikant besser abschnitten (95%-KI 0,45–1,01; p = 0,052). Die Ursache dafür ist derzeit noch unklar.
In der PETACC-6-Studie fanden sich somit keine Verbesserung von pCR- und R0-Resektionsraten, und wegen der erhöhten Toxizität während der neoadjuvanten RChT war die Compliance im experimentellen Arm schlechter. Die chirurgische Therapie war jedoch in beiden Armen vergleichbar. Etwa 77% der Patienten begannen die adjuvante Chemotherapie (weniger im Oxaliplatin-Arm, und nur 65% aller Patienten erhielten postoperativ auch tatsächlich Oxaliplatin), 69% beendeten die adjuvante Therapie regelrecht im Capecitabin Arm, 57% im Oxaliplatin-Arm. 3-Jahres-Lokalrezidiv- und Fernmetastasierungsraten waren in beiden Armen nicht signifikant unterschiedlich. In keiner Subgruppe ergab sich ein Benefit zugunsten des experimentellen Arms (Alter, Geschlecht, ECOG, cT- und cN-Stadium, ypT, ypN, ypTNM).
Zusammenfassend wird die neoadjuvante RChT am sinnvollsten mit Capecitabin durchgeführt. Eine Alternative ist die Gabe von infusionalem 5-FU plus vier Zyklen Oxaliplatin wie in der CAO/ARO/AIO-04-Studie. Die Langzeitdaten der italienischen und französischen Studie unterstützen dieses Vorgehen, wenngleich dort keine Signifikanz erreicht wurde und eine detaillierte Analyse v. a. der adjuvanten Therapie noch aussteht. Diese Beobachtung und die geschilderten Hypothesen zum frühzeitigen Einsatz von Oxaliplatin lassen weitere Studien zur Intensivierung der präoperativen Chemotherapie geboten erscheinen.
Mehr Chemotherapie neoadjuvant? Daten zur
Induktions-Chemotherapie
Die Lokalrezidivraten bei mittels MRT gut ausgewählten „low risk“-Patienten sind niedrig, sodass eine neoadjuvante Radiotherapie oder RChT für viele Patienten eine Überbehandlung darstellt. Dennoch haben auch diese Patienten ein signifikantes Risiko für eine Fernmetastasierung, das eine systemische Therapie notwendig macht. Außerdem ist eine postoperative Chemotherapie bei vielen Patienten nicht oder nur unvollständig möglich, sodass in jüngerer Zeit Konzepte zur neoadjuvanten Chemotherapie bzw. zu Induktions- oder Konsolidierungs-Chemotherapien untersucht wurden. Die Verlegung der Chemotherapie vor die Operation kann Compliance und möglicherweise Therapieeffektivität erhöhen. In einer spanischen randomisierten Phase-II-Studie war die Compliance im Arm mit Induktions-Chemotherapie mit 91% deutlich höher als im Standardarm (54%; p < 0,0001), ohne die chirurgischen Resultate zu beeinträchtigen [1]. Mehrere Studien, publiziert in den Jahren 2014–2016, sind vor diesem Hintergrund interessant.
• Die Langzeitdaten der spanischen Arbeitsgruppe aus der skizzierten randomisierten Phase-II-Studie nach median 69 Monaten wurden 2015 präsentiert [11]. Primäres Zielkriterium war die pCR-Rate, wobei die Studie nicht vergleichend angelegt war. Insgesamt sollten – inklusive 10% „drop-outs“ – 108 Patienten mit Rektumkarzinom (< 12 cm ab ano gelegen) rekrutiert werden, die mit MRT untersucht wurden und „high-risk“-Charakteristika aufweisen mussten (resektables T4-Stadium, T3 im unteren Drittel, CRM+, cT3N+). Im experimentellen Arm wurde eine Induktionschemotherapie (viermal CapeOx) vor der RChT (ebenfalls basierend auf CapeOx) gegeben, gefolgt von einer Operation. Im Standardarm wurden die vier Zyklen CapeOx nach RChT und Operation gegeben.
Eine R0-Resektion wurde bei 86% bzw 87% der Patienten erreicht, die pCR-Raten waren mit 13% bzw 14% nahezu identisch. Die Compliance und auch die Verträglichkeit war mit der Induktionstherapie klar besser. Es traten lediglich zwei Lokalrezidive auf, 24 Patienten entwickelten Fernmetastasen. DFS (64% vs. 62%) und OS (78% vs. 75%) unterschieden sich nicht zwischen den Armen. Insgesamt legen somit die Langzeitdaten nahe, dass eine Induktionstherapie nicht von Nachteil ist.
• Am Memorial Sloan Kettering Cancer Center erhielten insgesamt 32 Patienten monozentrisch eine alleinige neoadjuvante Chemotherapie [12]. Das Staging erfolgte mittels CT von Thorax bis Becken, starrer Rektoskopie, endorektalem Ultraschall (ERUS) und MRT des Beckens. Lediglich Patienten mit cT3-Tumor wurden eingeschlossen, zunächst unabhängig vom Nodalstatus. Ein T4-Tumor galt als Ausschlusskriterium, falls er die mesorektale Faszie erreichte, fixiert war oder nicht resektabel erschien. Bezüglich der Beschreibung des Nodalstatus wurde ein pragmatischer Ansatz gewählt: N- bei perirektalen Lymphknoten < 5 mm, N+ bei einem oder mehreren Lymphknoten > 5 mm. Tumoren mit vier oder mehr Lymphknoten > 2 cm im MRT wurden als „bulky disease“ gewertet und waren ein Ausschlusskriterium. Die Patienten erhielten sechs Zyklen mFOLFOX6, die ersten vier zusätzlich mit Bevacizumab. Bei klinischer Progression oder Intoleranz gegenüber mFOLFOX6 konnten sie eine RChT mit 5-FU erhalten. Die TME war drei bis sechs Wochen nach letzter Chemotherapie bzw. letzter Radiatio geplant. Ein Restaging mit ERUS, MRT und Proktoskopie zwei bis drei Wochen nach Ende der Therapie war vorgesehen, um über die Notwendigkeit einer RChT zu befinden.
Primärer Endpunkt war die R0-Resektionsrate, die bei 100% lag, wobei zwei Patienten die präoperative Chemotherapie wegen kardialer Probleme abbrechen mussten und bestrahlt wurden. Alle 30 Patienten, die die präoperative Chemotherapie erhalten hatten, wiesen eine Tumorregression auf. Die pCR-Rate lag bei 25%. Das 4-Jahres-Risiko für ein Lokalrezidiv betrug 0%, die 4-Jahres-DFS-Rate 92,0% (95%-KI 82,1–100%), die 4-Jahres-Überlebensrate 91,6% (95%-KI 84,0–100%). Zusammenfassend zeigt die Studie ein erhebliches Downstaging sowohl bezüglich pCR-Rate als auch Nodalstatus: Ein N+-Status wurde vor Therapie bei 23, pathohistologisch hinterher nur noch bei zehn Patienten diagnostiziert.
• In einer weiteren Studie wurde die neoadjuvante Therapie als Konsolidierung geprüft (nach RChT und vor Operation; [13]). In einem Phase-II-Design erhielten in vier sequenziell rekrutierten Kohorten mit lokal fortgeschrittenen Rektumkarzinomen der Stadien II und III insgesamt 259 Patienten zunächst eine neoadjuvante RChT (5-FU 225 mg/m² und Tag kontinuierlich infundiert während der konventionell fraktionierten Radiotherapie mit 45 Gy + 5,4 Gy Boost). Patienten in Gruppe 1 wurden mittels TME sechs bis acht Wochen nach Ende der RChT reseziert. Patienten in den Gruppen 2–4 erhielten drei bis fünf Wochen nach dem letzten FOLFOX-Zyklus und vor der TME zwei, vier oder sechs Zyklen mFOLFOX6. Primärer Endpunkt war die pCR-Rate.
In allen Armen erhielten etwa 80% der Patienten alle geplanten Zyklen. Die Toxizität der RChT war milde, aber die Häufigkeit von Nebenwirkungen (v. a. hämatologisch) unter Induktionschemotherapie nahm erwartungsgemäß mit der Dauer der Behandlung zu (Grad-3/4-Nebenwirkungen in Gruppe 2: 4% vs. Gruppe 4: 36%).
Die Behandlungsgruppen unterschieden sich weder bei der Rate an Sphinkter-Erhalt noch an R0-Resektionen, der Anzahl der gewonnenen/untersuchten Lymphknoten oder beim operativen Blutverlust. Lediglich der vom Chirurgen gradierte Fibrose-Score („Pelvic fibrosis“) erhöhte sich mit Dauer des Intervalls zwischen Radiatio und Operation, aber dies führte nicht zu vermehrten technischen Schwierigkeiten. Kein Patient starb peri- oder postoperativ, und auch die postoperative Morbidität Grad 3/4 nach der Dindo-Clavien-Skala war nicht signifikant unterschiedlich. Grad-3/4-Komplikationen korrelierten nicht mit der Zahl der Chemotherapiezyklen, wohl hingegen die pCR-Rate: Gruppe 1–4 18%, 25%, 30% bzw. 38% (p = 0,0036). Damit hatte Gruppe 4 eine signifikant höhere Chance auf eine pCR als Gruppe 1, auch in einer multivariaten Analyse (OR 3,49; p = 0,011).
• Die dreiarmige Phase-III-Studie FOWARC verglich bei 495 chinesischen Patienten (18–75 Jahre) mit lokal fortgeschrittenem Rektumkarzinom im klinischen Stadium II und III folgende drei Arme [14]: (i) fünf 2-wöchige Zyklen infusionales 5-FU plus Radiotherapie (46,0–50,4 Gy in 23–25 Fraktionen während Zyklen 2–4), gefolgt von Chirurgie und weiteren sieben Zyklen 5-FU; (ii) die gleiche Therapie plus Oxaliplatin (85 mg/m² an Tag 1 jedes Zyklus, d. h. mFOLFOX6); (iii) vier bis sechs Zyklen mFOLFOX6 gefolgt von Chirurgie und sechs bis acht Zyklen mFOLFOX6. Primärer Endpunkt war das 3-Jahres-DFS, sekundäre Endpunkte histopathologisches Ansprechen sowie Toxizität. Vorgesehen ist, eine Verbesserung im 3-Jahres-DFS von 60% auf 75% in jedem der beiden Oxaliplatin-Arme gegenüber dem 5-FU-Monotherapie-Arm zu detektieren.
Etwa ein Drittel der Patienten wiesen cT4-Tumoren auf, etwa drei Viertel hatten ein Stadium cIII. Bislang wurden sekundäre Endpunkte berichtet: Die R0-Resektionsrate lag in allen drei Armen bei ca. 90%; auch die Raten an Sphinkter-erhaltenden Operationen unterschieden sich numerisch kaum (zwischen 84% und 90%). Anastomoseninsuffizienzen und Infektionen nach Operation waren im FOLFOX-Monotherapie-Arm etwa halb so häufig wie in den RT-Armen. Die pCR-Rate betrug nach 5-FU-RT 14%, nach FOLFOX-RT 27,5% und nach FOLFOX alleine 6,6%. Die Ergebnisse für das Downstaging (definiert als ypStadium 0–1) betrugen nach 5-FU-RT 37,1%, nach FOLFOX-RT 56,4% und nach FOLFOX alleine 35,5%. Die Autoren folgern, dass eine FOLFOX-basierte RChT zwar höhere pCR-Raten, aber keine höheren Downstaging-Raten im Vergleich mit FOLFOX alleine bringt. Insbesondere die geringeren postoperativen Komplikationsraten sprächen für die alleinige neoadjuvante Chemotherapie.
Zusammenfassend zeigen die Studien zur neoadjuvanten Chemotherapie, dass eine MRT-basierte Auswahl von Patienten in künftigen Studien obligat ist und dass möglicherweise Patienten mit MRT-Hochrisiko von einer intensivierten präoperativen Chemotherapie – als Induktions- oder Konsolidierungstherapie – profitieren können.
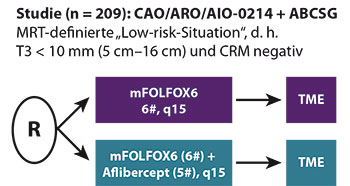
Die Langzeitdaten der MSKCC-Studie – kein Lokalrezidiv und exzellente DFS- und Überlebensraten – sind beeindruckend, auch wenn eine sehr kritische Auswahl an Patienten stattfand. Im Rahmen der PROSPECT-Studie wird in den USA das Konzept der alleinigen neoadjuvanten Chemotherapie in einer Phase-III-Studie mit der RChT verglichen (https://clinicaltrials.gov/ct2/show/NCT01515787). In einer randomisierten Phase-II-Studie der Deutschen Rektumgruppe (CAO/ARO/AIO-0214) wird bei Patienten mit T3-Tumoren mit geringerer Infiltration ins perirektale Fettgewebe (≤ 10 mm), nicht bedrohtem CRM und Tumorsitz im mittleren und oberen Drittel eine alleinige neoadjuvante Chemotherapie mit FOLFOX +/- Aflibercept untersucht (Abb. 2). Primärer Endpunkt ist die pCR-Rate. Komplementär dazu wird in der randomisierten Phase-II-Studie CAO/ARO/AIO-12-Studie für Patienten mit MRT-gestagtem höherem Risiko bzw. größerem Primarius zurzeit das spanische Konzept (Induktionstherapie gefolgt von RChT) mit dem von Garcia-Aguilar et al. publizierten Konzept (RChT, gefolgt von Induktionschemotherapie; [13]) verglichen. Primärer Endpunkt ist die pCR-Rate (Abb. 3).

Nach neoadjuvanter RChT: wie lange warten bis zur Operation?
Retrospektive Analysen deuten darauf hin, dass eine längere Wartezeit zwischen neoadjuvanter RChT und Operation ähnlich wie beim Analkarzinom die pCR-Raten erhöht und damit möglicherweise die Prognose verbessern kann. In zwei randomisierten Studien wurde diese Frage prospektiv untersucht.
• In der GRECCAR-Studie wurde eine sieben- mit einer elfwöchigen Warteperiode bis zur Operation verglichen [15]. 265 Patienten mit cT3/T4- oder cTxN+-Tumor des mittleren oder unteren Rektumdrittels erhielten eine RChT mit 5-FU oder Capecitabin sowie eine Strahlendosis von 45–50 Gy. Primärer Endpunkt war die pCR-Rate, definiert als ypT0N0-Resektat. Im Standardarm (sieben Wochen) wurde eine pCR-Rate von 12% zugrunde gelegt, im experimentellen Arm eine pCR-Rate von 26% erwartet. Die Tumoren waren mehrheitlich in einem cT3-Stadium (82%) und lagen im Mittel 3,3 cm an ano. Neun Patienten (3,4%) wurden nicht reseziert, bei zweien wurde lediglich das Narbengewebe der ehemals tumortragenden Region lokal exzidiert.
Insgesamt wurden 47 (18,6%) Resektate als ypT0 gewertet, wobei in vier Fällen (8,5%) noch befallene Lymphknoten gefunden wurden. Der primäre Endpunkt wurde verfehlt, es ergaben sich keine Unterschiede in der pCR-Rate (sieben Wochen: 15,0% vs. elf Wochen: 17,4%; p = 0,59). Etwa 83% der Patienten wurden laparoskopisch reseziert, die Konversionsraten unterschieden sich numerisch (15% vs. 10%) zuungunsten der 11-Wochen-Gruppe. Die Morbidität der Resektion war in der Langzeitgruppe signifikant erhöht (44,5% vs. 32%; p = 0,04). Zurückzuführen waren die Unterschiede in der Morbidität auf vermehrte medizinische Komplikationen (32,8% vs. 19,2%; p = 0,014). In der Langzeitgruppe war darüber hinaus die Qualität der TME-Resektate schlechter (komplettes Mesorektum 78,7% vs. 90%; p = 0,016), Größe der Tumoren sowie Anzahl der gewonnenen Lymphknoten waren vergleichbar, ebenso die Raten an R1- bzw. CRM+-Resektionen. Die Autoren schließen daraus, dass ein elfwöchiges Intervall die pCR-Rate nicht erhöht, hingegen höhere Morbidität und mehr Schwierigkeiten bei der Resektion zeitigt.
• Eine ähnliche Studie (sechs vs. zwölf Wochen Wartezeit), allerdings mit anderem Endpunkt (T-Downstaging im MRT), wurde in Großbritannien durchgeführt [16]: Die Rate sollte von 40% auf 60% erhöht werden. Insgesamt sollten 218 Patienten in die Studie rekrutiert werden. Wichtigste MRT-Einschlusskriterien waren: CRM < 1 mm, tiefliegender Tumor mit Einbeziehung der Zwischen-Sphinkter-Ebene, mrT3c oder größer (d. h. Infiltrationstiefe > 5 mm), mrEMVI-positiv. Im 12-Wochen-Arm wurde bei signifikant mehr Patienten ein Downstaging (58% vs. 43%; p = 0,019) und eine pCR erreicht (20% vs. 9%; p < 0,05). Signifikante Unterschiede fanden sich ebenfalls für EMVI-Positivität und ypN0. Hinsichtlich der chirurgischen Morbidität finden sich keine Gruppenunterschiede.
Die Ergebnisse sind auf den ersten Blick widersprüchlich, möglicherweise, weil aufgrund der Güte und langjährigen Erfahrung in der MRT-Diagnostik in Großbritannien ausgesprochene Hochrisiko-Patienten eingeschlossen wurden. Dies war in der französischen Studie wohl nicht mit dieser Stringenz der Fall, sodass die Aussage „Länger warten ist besser“ eventuell nur für diese Hochrisiko-Patienten gilt. Auf deutsche Verhältnisse angewandt, zeigt die britische Studie, dass wir unsere MRT-Qualität bzw. deren Dokumentation optimieren müssen.
Es bleiben natürlich Fragen: Warum waren in der französischen Studie im 11-Wochen-Arm nicht zumindest auch die pCR-Raten höher? Was wird andererseits an Langzeiteffekten in der britischen Studie übrigbleiben? Letztlich geht es ja nicht um MRT-Veränderungen und nicht einmal um höhere pCR-Raten, sondern um das Erreichen einer R0-Resektion und optimales langfristiges DFS und OS. An dieser Stelle helfen uns beide Studien (noch) nicht. Man kann aus ihnen daher zum einen vorsichtig ableiten, dass bei „Standardrisiko“ – gute Bildgebung vorausgesetzt – eine längere Wartezeit nicht sinnvoll ist, dagegen möglicherweise schon bei Patienten mit höherem Risiko für eine R1- oder CRM+-Resektion. Auf der anderen Seite stellt sich dann die Frage, wie die längere Wartezeit ausgefüllt wird: Hier ist sicher – wie beschrieben – eine Rolle für die Konsolidierungs-Chemotherapie zu sehen.
Neuere Daten zu „Watch-and-wait“-Konzepten
Analog den Entwicklungen beim Analkarzinom wird beim Rektumkarzinom, nicht zuletzt getriggert durch die Daten der brasilianischen Chirurgin Habr-Gamma, zunehmend erwogen, in Einzelfällen bei nachweisbarer klinischer Komplettremission (cCR) auf eine Operation zu verzichten. Bei unselektierten lokal fortgeschrittenen Tumoren dürfte die pCR-Rate mit konventioneller RChT zwischen 10% und 15% liegen. Einzelne Serien berichten jedoch über höhere Anteile, freilich abhängig von der Größe des Tumors. Nach den im vorigen Abschnitt beschriebenen Daten von Garcia-Aguilar ist sogar denkbar, dass durch neue Behandlungsalgorithmen die pCR-Rate weiter steigt [16]. Leider kann man auch mit sorgfältiger ERUS- und MRT-Untersuchung nicht definitiv beurteilen, ob eine cCR als Surrogat für eine tumorbiologisch komplette Remission zu werten ist.
• Die Ergebnisse einer sogenannten „Wait-and-see“-Politik wurden in ersten kleineren Serien auch in Europa nachvollzogen, insbesondere mit Daten aus Maastricht [17]: Dort wurde seit 2004 Patienten mit cCR nach RChT eine „Wait-and-see“-Strategie angeboten, verbunden mit einer ausführlichen Aufklärung über den eigentlichen Standard, die TME. Insgesamt erhielten in diesem Zeitraum 192 Patienten eine RChT, von denen 21 (median 65 Jahre, 67% männlich) bei Vorliegen einer cCR nicht reseziert, sondern engmaschig mithilfe qualitativ hochwertiger MRT-Untersuchungen mit Diffusionswichtung (DWI) überwacht wurden. Die Kriterien für cCR waren ausgefeilt und erforderten fünf Merkmale: (i) kein Residualtumor oder lediglich Fibrose im MRT/DWI, (ii) keine verdächtigen Lymphknoten im MRT, (iii) kein Residualtumor in der Endoskopie oder nur noch Narbe/Ulkus, (iv) negative Biopsien aus der ehemaligen Tumorregion, (v) kein palpabler Tumor, falls dieser initial digital-rektal tastbar war. Die Ergebnisse dieser Fallserie waren beeindruckend: Von den 21 Patienten war bei lediglich einem nach einem medianen Follow-up von 25 Monaten (± 19 Monate) ein Rezidiv diagnostiziert worden, das mittels transanaler Vollwandresektion behandelt werden konnte. Nach zwei Jahren liegt das kumulative DFS bei 89% (95%-KI 4–98%), das OS bei 100%. Damit entsprechen die Ergebnisse der „Wait-and-see“-Gruppe nahezu exakt denen einer Kontrollgruppe von 20 Patienten, die aus verschiedenen Gründen operiert worden waren und eine pCR zeigten. Daten zur Funktionalität und zum Wexner-Inkontinenz-Score favorisieren eindeutig die „Wait-and-see“-Gruppe.
2015 wurden zwei weitere in diesem Kontext wichtige Fallserien publiziert: In einer dänischen Serie erhielten 55 Patienten bei einem tiefliegenden Exstirpations-pflichtigen Rektumkarzinom eine hochdosierte RChT und wurden dann nur nachbeobachtet [18], und 79 Patienten in einer anderen Studie wurden nach RChT mittels „local excision“, einer weiteren Option des Organerhaltes beim Rektumkarzinom, behandelt [19].
• In die dänische Studie wurden 51 Patienten mit distalem, resektablem Rektumkarzinom (0–6 cm ab ano) im Stadium T2 oder T3N0–1 rekrutiert [18]. Das Staging war sehr dezidiert und umfasste MRT-, CT- und PET-Untersuchungen. Die Studie war ursprünglich nach einem „Simon-2-stage“-Design konzipiert worden. Im ersten Schritt sollte bei den ersten 30 Patienten eine Lokalrezidivrate ≤ 30% im ersten Jahr der Nachbeobachtung gezeigt werden. In einem zweiten Schritt sollten dann 100 Patienten eingeschlossen werden.
Die Patientenzahl ist relativ gering, da die Studie wegen schlechter Rekrutierung nach vier Jahren vorzeitig abgebrochen wurde. Die Patienten erhielten eine sehr intensive RChT: 60 Gy in 30 Fraktionen auf den Tumor, 50 Gy auf elektive Lymphknotenregionen, zusätzlich 5 Gy endorektale Brachytherapie und parallel dazu das orale Fluoropyrimidin Tegafur-Uracil (300 mg/m² täglich über sechs Wochen). Der Verlauf wurde alle zwei Wochen endoskopisch und bioptisch kontrolliert. Durch die intensive Therapie kamen 40 der 51 Patienten sechs Wochen nach Ende der Therapie in eine cCR und wurden weiter beobachtet. Eine adjuvante Chemotherapie erfolgte nicht. Den elf nicht in cCR gekommenen Patienten und den Patienten, die unter Beobachtung ein lokales oder systemisches Rezidiv entwickelten, wurden eine Standardresektion und eine adjuvante oder palliative Chemotherapie angeboten.
Nach einem Jahr war bei 15,5% der Beobachtungs-Patienten ein Lokalrezidiv diagnostiziert worden, nach zwei Jahren bei 25,9%. Die mediane Zeit bis zum Lokalrezidiv bzw. lokalen Progress lag bei 10,4 Monaten. In der gesamten Gruppe der 51 Patienten konnte bei 58% eine lokale Tumorkontrolle alleine durch RChT erreicht werden. Bei drei der elf Beobachtungs-Patienten wurden Fernmetastasen diagnostiziert. Alle Patienten mit Lokalrezidiv konnten kurativ R0-reseziert werden, und es traten – bei allerdings kurzer Beobachtungszeit – postoperativ keine Lokalrezidive auf. Aus Patientensicht war das funktionelle Behandlungsergebnis gut (in etwa 70% der Fälle gute Kontinenz nach ein und zwei Jahren). Hauptnebenwirkung waren persistierende rektale Blutungen bei 78% der Patienten, die allerdings nur bei etwa 10% ausgeprägt (Grad 3) waren.
• Die zweite hochrangig publizierte Studie zum Thema Organerhalt untersuchte in einem multizentrischen Phase-II-Design Patienten mit einem distalem, klinisch (mittels endorektalem Ultraschall oder MRT) als cT2N0 beurteiltem Rektumkarzinom [19]. Der Tumor durfte maximal 4 cm groß sein, sollte nicht mehr als 40% der Zirkumferenz des Rektums einnehmen und ≤ 8 cm ab ano liegen. Die neoadjuvante RChT bestand aus Capecitabin und Oxaliplatin, die Radiotherapie wurde konventionell fraktioniert (45 Gy + 9 Gy Boost). Im Anschluss daran war die lokale Exzision des Tumorbetts vorgesehen. Wegen Nebenwirkungen wurde die Capecitabin-Dosierung im Verlauf der Studie reduziert und der Boost auf 5,4 Gy limitiert. Primärer Endpunkt war das 3-Jahres-DFS in der Intention-to-treat-Population sowie für Patienten, die die RChT komplett erhalten hatten und einen ypT0–2 Tumor mit negativen Resektionsrändern aufwiesen.
Von den 79 Patienten hatten 23 (29%) gastrointestinale Nebenwirkungen vom Grad 3, zwölf (15%) Schmerzen vom Grad 3–4 und zwölf (15%) hämatologische Nebenwirkungen vom Grad 3–4 während der RChT. Zwei Patienten wurden nicht operiert, einer erhielt eine TME. Vier weitere Patienten hatten entweder ypT3-Tumoren (n = 3) oder einen positiven Absetzungsrand (n = 1), sodass die „Per-protocol“-(PP)Population 72 Patienten umfasste. Von den operierten Patienten hatten 38 (49%) entweder ypT0- oder ypTis-Karzinome, elf (14%) ypT1- und 24 (31%) ypT2-Tumoren. Nach median 56 Monaten Follow-up war das 3-Jahres-DFS in der ITT-Population 88,2% (95%-KI 81,3–95,8), in der PP-Gruppe 86,9% (95%-KI 79,3–95,3%). Das Gesamtüberleben nach drei Jahren lag bei 94,8% (ITT) bzw. 95,7% (PP). Insgesamt entwickelten acht Patienten ein Rezidiv (fünf Fernmetastasen, drei lokal). Vier davon konnten eine erfolgreiche Salvage-Operation erhalten. Zum Ende des Follow-up wiesen 72 der 79 Patienten (91%) einen Organerhalt auf, das Behandlungsprotokoll verursachte keine substanzielle Verschlechterung der ano-rektalen Funktion.
• 2016 wurde außerdem die sogenannte OnCoRe-Kohortenanalyse vorgestellt, mit 259 Rektumkarzinom-Patienten, die von Januar 2011 bis April 2013 eine präoperative RChT erhalten hatten (45 Gy mit 5-FU). 31 Patienten mit einer cCR wurde eine „Watch-and-wait“-Strategie angeboten, die übrigen nach Möglichkeit reseziert [20]. Des Weiteren wurden in die Analyse 98 Patienten aus einem Register dreier benachbarter regionaler Krebszentren eingeschlossen, die zwischen März 2005 und Januar 2015 eine cCR erreicht hatten und mit einer „Watch-and-wait“-Strategie weiterbetreut worden waren. Mittels „propensity score matching” (unter Berücksichtigung von T-Stadium, Alter und Allgemeinzustand) wurden die “Watch-and-wait“-Strategie und die Resektion miteiander verglichen. Primärer Endpunkt war das „Non-regrowth-DFS“, das ab dem Start der RChT bestimmt wurde, sekundäre Endpunkte waren OS und Kolostomie-freies Überleben.
Von 129 Patienten unter der „Watch-and-wait“-Strategie hatten nach median 33 Monaten 44 (34%) ein lokales Tumor-„Regrowth“ (3-Jahres Rate 38%). 36 von 41 Patienten (88%) mit nicht-metastatischem lokalem „Regrowth“ erhielten eine Salvage-Operation. In der gematchten Analyse (109 Patienten pro Behandlungsgruppe), ergaben sich keine Differenzen im 3-Jahres-„Non-regrowth-DFS” („Watch-and-wait“ 88% vs. 78% mit sofortiger Chirurgie; „time-varying“ p = 0,043). Es zeigten sich ebenfalls keine Unterschiede im 3-Jahres-Überleben („Watch-and-wait“ 96% vs. 87% mit sofortiger Chirurgie; „time-varying“ p = 0,024). Patienten in der „Watch-and-wait“-Kohorte hatten ein signifikant besseres Kolostomie-freies Überleben nach drei Jahren (74% vs. 47%; HR 0,445; p < 0,0001).
Die vorgestellten Studien zeigen gut, dass wir uns mit dem Thema Organerhalt beim Rektumkarzinom in Studien intensiver befassen müssen. Die Ergebnisse aus Maastricht belegen, dass in den Händen eines erfahrenen multidisziplinären Teams ein abwartendes Vorgehen nach cCR beim Rektumkarzinom möglich ist und zumindest beim kurz- und mittelfristigen Follow-up (mediane Nachbeobachtung 25 Monate) hervorragende Ergebnisse zeigt, die die brasilianischen Daten zu bestätigen scheinen [17]. Entscheidend ist indes die Patientenauswahl, die spezialisiertes radiologisches Know-how (MRT) erfordert, das sicher nicht flächendeckend vorhanden ist. Ein weiteres Problem neben der geringen Fallzahl ist die kurze Nachbeobachtungszeit. Wie erwähnt sind Zeiträume ≥ 5 Jahre zu fordern. Ein ähnliches Problem hat die Analyse aus Großbritannien [18], wenngleich hier der Versuch unternommen wurde, zumindest in Form eines „Matched-pairs“-Vergleichs eine Kontrollgruppe zu schaffen. Man darf bezweifeln, dass es jemals eine prospektive Studie zu diesem Thema geben wird. Beide Datensets zeigen indes, dass – gute Compliance vorausgesetzt – die abwartende Strategie gerechtfertigt und sicher ist.
Zusammenfassend zeigen alle beschriebenen Studien, dass der Organerhalt beim Rektumkarzinom ein sinnvolles und für viele Patienten erreichbares Konzept ist. Je kleiner die Tumoren sind, desto größer scheint die Chance auf eine cCR und damit auf einen Organerhalt zu sein. Aufgabe kommender Studien muss sein, herauszufinden, welche Tumoren und welche Patienten optimalerweise in solche Konzepte eingebracht werden können, wie die RChT aussehen sollte und wie die Surveillance gestaltet werden kann. Patienten sollten hierzu idealerweise in klinische Studien, zumindest jedoch in prospektive Register eingebracht werden. Allerdings ist bei der niedrigen Rezidivrate kleinerer Tumoren, die vor allem in solche Konzepte eingehen sollten, eine Non-inferiority-Studie nahezu unmöglich, da eine sehr große Patientenzahl benötigt würde. Diese Patienten müssten überdies – und das wäre sicher ein kritischer Punkt – bereit sein, sich zwischen Organerhalt und einer abdomino-perinealen Resektion randomisieren zu lassen.
Sollte man nach kurativer Resektion adjuvant behandeln? Und wenn ja, womit?
Das Vorgehen nach stattgehabter neoadjuvanter Therapie (sei es Radiotherapie mit 5 x 5 Gy oder RChT) mit anschließender TME wird international sehr kontrovers beurteilt [21]. Eine Cochrane Analyse hatte untersucht, inwieweit eine adjuvante Chemotherapie nach kurativer Resektion sinnvoll ist – allerdings v. a. auf dem Boden von Studien, in denen keine neoadjuvante Therapie durchgeführt worden war – und einen Überlebens-Benefit gezeigt [22]. Ein weiteres Argument pro adjuvante Therapie war die EORTC-22921-Studie, die in einem 2 x 2-faktoriellen Design auch den Einsatz von Bolus-5-FU adjuvant gegen die alleinige Nachbeobachtung geprüft und einen numerischen Nutzen beim DFS und beim OS gezeigt hatte [23]. Ein Langzeit-Update bestätigte den numerischen Benefit zum OS, ohne aber Signifikanz zu erreichen [24].
Diesen Daten gegenüber stehen die negativen Ergebnisse einer italienischen Studie, die ebenfalls den Einsatz der adjuvanten Chemotherapie geprüft hatte
(5-FU vs. Nachsorge) und 2014 endlich als Vollpublikation veröffentlicht worden war [25]. Des Weiteren wurde 2015 die gepoolte Analyse von zwei jeweils abgebrochenen holländischen Studien (PROCTOR und SCRIPT) veröffentlicht, die ebenfalls keinen statistisch fassbaren Benefit für eine adjuvante Chemotherapie im Vergleich zur alleinigen Nachsorge erbrachte [26]. Und eine ebenfalls 2015 publizierte Metaanalyse meint klar zeigen zu können, dass durch eine adjuvante Therapie keinerlei Benefit zu erwarten ist [27].
Im Folgenden soll aus Platzgründen nur auf die Metaanalyse eingegangen werden, die auf individuellen Patientendaten aus den drei oben kurz skizzierten Studien und einer kleineren abgebrochenen randomisierten britischen Studie (CHRONICLE) basiert [27]. Untersucht wurde der Stellenwert der adjuvanten Chemotherapie bei Patienten mit lokal fortgeschrittenem Rektumkarzinom und Zustand nach neoadjuvanter Radio- oder RChT. Eingangskriterium für die Metaanalyse war das Vorliegen eines ypII- oder ypIII-Stadiums. Für die Metaanalyse konnten Daten von 1.196 solchen Patienten ausgewertet werden, die R0-reseziert worden und deren Tumoren 0–15 cm ab ano lokalisiert gewesen waren. Primärer Endpunkt war das OS, sekundäre Endpunkte DFS und Fernmetastasen.
Die Metaanalyse lieferte negative Daten für eine adjuvante Chemotherapie hinsichtlich des primären Endpunkts OS (HR 0,97; p = 0,775). Eine adjuvante Chemotherapie verbesserte gleichfalls nicht das DFS (HR 0,91; p = 0,23) oder das Risiko für eine Fernmetastasierung (HR 0,94; p = 0,523). Die Subgruppe der 280 Patienten mit einem Tumorsitz 10–15 cm ab ano hatte nach adjuvanter Therapie ein verbessertes DFS (HR 0,59; p = 0,005) und seltener Fernmetastasen (HR 0,61; p = 0,025) als Patienten, die lediglich Nachsorge erhalten hatten. Die Autoren schlussfolgern: „ […] fluorouracil-based adjuvant chemotherapy has no benefit on overall survival, disease-free survival, and distant recurrences […]”.
Die Hauptkritikpunkte an der Metaanalyse sind wie folgt [28]:
1. Primäres Zielkriterium war das OS, nicht wie in allen modernen Studien zur adjuvanten Therapie DFS. Interessanterweise fällt das DFS numerisch auch klar zugunsten der adjuvant behandelten Gruppe aus. Das Dilemma des Endpunkts wird aber in der Arbeit nicht diskutiert.
2. Die Analyse schloss Patienten mit yp0- oder ypI-Stadium aus (die also angesprochen hatten, sofern sie eine RChT erhalten hatten). Die Schlussfolgerungen der Arbeit beziehen sich aber – vollends undifferenziert – generell auf alle neoadjuvant Behandelten. So wurden z. B. nur 538 der 1.011 Patienten der EORTC-Studie und nur 398 der 634 Patienten der italienischen Studie in die Analyse aufgenommen.
3. Die Patienten mit alleiniger neoadjuvanter Langzeit-Radiotherapie – die ja keinen Standard darstellt – wurden hingegen nicht ausgeschlossen. Interessanterweise ist die HR dieser Gruppe aber sehr schlecht (d. h. deutlich > 1) und verschlechtert somit die HR für DFS und Überleben insgesamt deutlich. Klammert man diese Patienten aus der Analyse aus, verbessert sich die HR für DFS in der Gesamtanalyse auf immerhin 0,85 (95%-KI 0,70–1,03), d. h. man würde damit ein nahezu signifikantes Ergebnis zugunsten der Adjuvanz erreichen.
4. Da für die Analyse individuelle Patientendaten vorlagen, ist es unverständlich, warum nicht zumindest eine exploratorische Analyse zum Thema „vollständige Durchführung der Chemotherapie“ und zum potenziellen Erfolg der Adjuvanz durchgeführt wurde, denn die Dosisintensität von 5-FU war in den zugrundeliegenden Studien sehr niedrig.
5. ist zu bemerken, dass das Gros der eingeschlossenen Patienten mit nach heutiger Wahrnehmung kaum wirksamen Therapien behandelt wurde (z. B. EORTC-Studie: vier Zyklen à fünf Tage à 350 mg/m² 5-FU).
Nach Publikation dieser Analyse sind keine weiteren Daten aus großen Studien mehr zu erwarten, sodass wir mit einem Dilemma leben müssen: Die adjuvante Chemotherapie konnte in allen Studien und Analysen nicht überzeugen, in denen Bolus-5-FU eingesetzt wurde, andererseits haben immerhin drei Studien gezeigt, dass die perioperative Intensivierung/Optimierung von Bolus-Schemata das DFS signifikant verbessern [9, 29, 30]. In einer Stellungnahme dazu hat sich daher die Arbeitsgruppe kolorektale Tumoren der AIO dafür ausgesprochen, nicht mehr Bolus-Schemata, sondern perioperativ optimierte Schemata zu nutzen (http://www.aio-portal.de/tl_files/aio/stellungnahmen/Statement_AIO_KRK_Leitgruppe_072014_Rektum_Ca.pdf).
In einer der drei erwähnten Studien konnte gezeigt werden, dass Capecitabin einer 5-FU-basierten perioperativen Therapie nicht nur „nicht-unterlegen“, sondern in sekundären Endpunkten wie z. B. dem DFS sogar überlegen war [29]. Die Überlegenheit von FOLFOX gegenüber Bolus-5-FU wurde – wie oben beschrieben – durch die CAO/ARO/AIO-04 Studie gezeigt [9]. Die dritte relevante Studie ist die randomisierte koreanische Phase-II-Studie ADORE [30]. Deren primäres Ziel war, bei Patienten, die nach einer neoadjuvanten 5-FU-basierten RChT eine „Hochrisiko“-Pathologie aufwiesen (ypT3–4 und/oder ypN1–2), eine postoperative Therapieintensivierung mit FOLFOX zu untersuchen. Die 320 Patienten erhielten entweder vier Zyklen Bolus-5-FU/Folinsäure (5-FU 380 mg/m², Folinsäure 20 mg/m² Tag 1–5 alle vier Wochen) oder acht Zyklen FOLFOX. Alle Patienten mussten eine 5-FU-haltige neoadjuvante RChT erhalten haben, mittels TME operiert sein und wiesen entweder einen ypT3–4- und/oder ypN1/2-Tumor auf. Primärer Endpunkt war das 3-Jahres-DFS.
Etwa 95% der Patienten beendeten die geplante Chemotherapie – ohne Unterschiede zwischen den Armen. Neutropenie aller Grade, Thrombozytopenie, Fatigue, Nausea und sensorische Neuropathie fanden sich signifikant häufiger im FOLFOX-Arm, es bestand jedoch kein Unterschied in der Häufigkeit von Grad-3/4-Nebenwirkungen. Das 3-Jahres-DFS in der ITT-Population lag bei 71,6% im experimentellen und bei 62,9% im 5-FU-Bolus-Arm (HR 0,66; p = 0,03), wobei der größte Nutzen im Stadium ypIII zu sehen war (HR 0,6; p = 0,04), während im Stadium ypII keine signifikante Verbesserung durch die intensivere adjuvante Therapie nachweisbar war (HR 0,74; p = 0,47). Das Gesamtüberleben war signifikant zugunsten des FOLFOX-Arms verbessert (HR 0,46; p = 0,04). Nach den Daten aus der ADORE-Studie macht der Einsatz in der adjuvanten Situation am ehesten für Patienten mit einem Stadium ypIII Sinn (möglicherweise ab ypN1b), wenngleich betont werden muss, dass auch hier Bolus-5-FU mit FOLFOX verglichen wurde und dass es sich um eine koreanische Phase-II-Studie bei median 55-Jährigen handelt.
Zusammenfassend sollten in der adjuvanten Therapie des Rektumkarzinoms nach auf infusionalem 5-FU oder Capecitabin-basierter RChT sowie TME keine Bolus-Protokolle mehr eingesetzt werden und stattdessen optimierte Fluoropyrimidin-Schemata Verwendung finden (z. B. Capecitabin). Der prinzipielle Einsatz von Oxaliplatin kann nicht empfohlen werden. Jüngere Patienten mit einem erhöhten Rezidivrisiko (Stadium ypIII) sollten zum möglichen Überlebensvorteil einer zusätzlichen Oxaliplatin-Therapie beraten werden. Falls in Einzelfällen einmal eine adjuvante RChT notwendig werden sollte, kann diese mit Capecitabin alleine durchgeführt werden.
Summary
This review article deals with some important questions on the treatment of locally advanced rectal cancer, which are currently being discussed and investigated in clinical trials:
• What is the optimal perioperative chemotherapy? Should oxaliplatin be given in analogy to colon cancer? Can 5-fluorouracil be replaced by capecitabine?
• In which patients can we dispense with a neoadjuvant radiochemotherapy?
• Is an interval of six weeks between the end of preoperative radiochemotherapy and surgery sufficient?
• What is the role of induction or consolidation chemotherapy, i. e. chemotherapy given before or after neoadjuvant radiochemotherapy and before surgery?
• Is it possible to dispense with surgery if a patient has achieved a clinically complete remission after radiochemotherapy? Can functional organ preservation be achieved by local excisioin after significant tumor shrinkage?
Keywords: locally advanced rectal cancer, perioperative (radio-)chemotherapy, induction chemotherapy, consolidation chemotherapy, organ preservation, watchful waiting.
Literatur
1. Fernández-Martos C et al. Phase II, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin (CAPOX) compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imaging-defined, locally advanced rectal cancer: Grupo cancer de recto 3 study. J Clin Oncol 2010; 28: 859-65.
2. Allegra CJ et al. Neoadjuvant 5-FU or capecitabine plus radiation with or without oxaliplatin in rectal cancer patients: A phase III randomized clinical trial. J Natl Cancer Inst 2015; 107 (11): djv248.
3. Liu CG et al. Effect of neoadjuvant chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: A meta-analysis. Gastroenterol Res Pract 2016; 2016: Article ID 1798285.
4. Aschele et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: Pathologic results of the STAR-01 randomized phase III trial. J Clin Oncol 2011; 29: 2773-80.
5. Gerard JP et al. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer. J Clin Oncol 2012; 30: 4558-65.
6. O'Connell MJ et al. Capecitabine and oxaliplatin in the preoperative multimodality treatment of rectal cancer: Surgical end points from National Surgical Adjuvant Breast and Bowel Project trial R-04. J Clin Oncol 2014; 32: 1927-34.
7. Aschele et al. Final results of STAR-01: A randomized phase III trial comparing preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #3521.
8. Etienne PL et al. PRODIGE 2 phase III trial neoadjuvant in rectal cancer: Quality of life and results at 5 years. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #3619.
9. Rödel C et al. Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer (the German CAO/ARO/AIO-04 study): Final results of the multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2015; 16: 979-89.
10. Schmoll HJ et al. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine + oxaliplatin vs. capecitabine alone in locally advanced rectal cancer: Final analyses. ESMO 2016, Abstract 467PD.
11. Fernandez-Martos C et al. Chemoradiation, surgery and adjuvant chemotherapy versus induction chemotherapy followed by chemoradiation and surgery: Long-term results of the Spanish GCR-3 phase II randomized trial. Ann Oncol 2015; 26: 1722-8.
12. Schrag D et al. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: A pilot trial. J Clin Oncol 2014; 32: 513-8.
13. Garcia-Aguilar J et al. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: A multicentre, phase 2 trial. Lancet Oncol 2015; 16: 957-66.
14. Deng Y et al. Advanced rectal cancer: Initial results of the Chinese FOWARC multicenter, open-label, randomized three-arm phase III trial. J Clin Oncol 2016; 34: 3300-7.
15. Lefevre JH et al. Effect of interval (7 or 11 weeks) between neoadjuvant radiochemotherapy and surgery on complete pathologic response in rectal cancer: A multicenter, randomized, controlled trial (GRECCAR-6). J Clin Oncol 2016, Jul 18 [prepub ahead of print, DOI 10.1200/JCO.2016.67.6049].
16. Evans J et al. Results of a prospective randomised control 6 vs 12 trial: Is greater tumour downstaging observed on post treatment MRI if surgery is delayed to 12 weeks versus 6 weeks after completion of neoadjuvant radiochemotherapy? Annals of Oncology 2016; 27(6): vi149 (ESMO 2016, Abstract #452O).
17. Maas M et al. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol 2012; 29: 4633-40.
18. Appelt AL et al. High-dose chemoradiotherapy and watchful waiting for distal rectal cancer: A prospective observational study. Lancet Oncol 2015; 16: 919-27.
19. Garcia-Aguilar J et al. Organ preservation for clinical T2N0 distal rectal cancer using neoadjuvant chemoradiotherapy and local excision (ACOSOG Z6041): Results of an open-label, single-arm, multi-institutional, phase 2 trial. Lancet Oncol 2015; 16: 1537-46.
20. Renehan AG et al. Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): A propensity-score matched cohort analysis. Lancet Oncol 2016; 17: 174-83.
21. Marijnen C. Organ preservation in rectal cancer: Have all questions been answered? Lancet Oncol 2015; 16: e13-22.
22. Petersen SH et al. Postoperative adjuvant chemotherapy in rectal cancer operated for cure. (Review). Cochrane Database of Systematic Reviews 2012; Issue 3. Art. No.: CD004078.
23. Bosset JF et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355: 1114-24. Bosset JF et al. Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: Long-term results of the EORTC 22921 randomised study. Lancet Oncol 2014; 15: 184-90.
25. Sainato A et al. No benefit of adjuvant fluorouracil leucovorin chemotherapy after neoadjuvant chemoradiotherapy in locally advanced cancer of the rectum (LARC): Long term results of a randomized trial (I-CNR-RT). Radiother Oncol 2014; 113: 223-9.
26. Breugom AJ et al. Adjuvant chemotherapy for rectal cancer patients treated with preoperative (chemo)radiotherapy and total mesorectal excision: A Dutch Colorectal Cancer Group (DCCG) randomized phase III trial. Ann Oncol 2015; 26: 696-701.
27. Breugom AJ et al. Adjuvant chemotherapy after preoperative (chemo)radiotherapy and surgery for patients with rectal cancer: A systematic review and meta-analysis of individual patient. Lancet Oncol 2015; 16: 200-7.
28. Hofheinz RD et al. Adjuvant chemotherapy for rectal cancer. Lancet Oncol 2015; 16: e154-155.
29. Hofheinz RD et al. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: A randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol 2012; 13: 579-88.
30. Hong YS et al. Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancer after preoperative chemoradiotherapy (ADORE): An open-label, multicentre, phase 2, randomised controlled trial. Lancet Oncol 2014; 15: 1245-53.

Prof. Dr. Ralf-Dieter Hofheinz
Leiter TagesTherapieZentrum am Interdisziplinären Tumorzentrum Mannheim
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1–3, 68167 Mannheim
+49 621 383 2855
+49 621 383 2488
ralf.hofheinz[at]umm[dot]de

