Hauttumoren: Fortschritte in der adjuvanten Therapie des Melanoms
ESMO 2017
Die Therapie des malignen Melanoms hat sich in den letzten Jahren durch die Einführung der Immuncheckpoint-Inhibitoren und der gegen BRAF und MEK gerichteten Kinase-Inhibitoren grundlegend gewandelt. Wer geglaubt hatte, dass es damit nun längere Zeit nichts Neues in dieser Indikation geben würde, sieht sich nun getäuscht: Beim ESMO-Kongress wurden drei große Phase-III-Studien vorgestellt, die die adjuvante Therapie des Melanoms mutmaßlich auf eine neue Basis stellen werden. Und da es auch im fortgeschrittenen Stadium durchaus noch Raum für Verbesserungen gibt, läuft eine Vielzahl von Studien, in denen Checkpoint-Inhibitoren mit zielgerichteten Medikamenten kombiniert werden – in Madrid wurde etwa über Kombinationen mit BRAF- und MEK-Hemmern, aber auch mit ganz neuen Substanzen wie zum Beispiel einem Inhibitor der Indolamin-2,3-Dioxygenase 1 (IDO-1) berichtet.
Patienten mit einem lokal begrenzten Melanom können chirurgisch in der Regel geheilt werden; Probleme machen allerdings die Fälle, in denen Lymphknoten befallen sind (v. a. Stadium III): Hier sind Rezidiv- und Mortalitätsrisiko postoperativ erhöht, wobei das Risiko von verschiedenen Faktoren wie beispielsweise der Größe der Lymphknoten abhängt. Die Bemühungen um die adjuvante Therapie des malignen Melanoms sind in den letzten beiden Jahren in ein völlig neues Stadium getreten: Nachdem sich mit Interferon jahrelang allenfalls sehr bescheidene Erfolge gezeigt hatten, brachten die Immuncheckpoint-Inhibitoren Bewegung in diese Szene. Vor gerade einmal einem Jahr wurden die Ergebnisse der Phase-III-Studie 18071 der EORTC publiziert, wonach der CTLA-4-Inhibitor Ipilimumab das Überleben von Patienten mit reseziertem Melanom im Stadium III signifikant verlängern kann [1]; Ipilimumab ist in den USA auf der Basis dieser Resultate bereits zur adjuvanten Therapie zugelassen.
Nun musste der CTLA-4-Inhibitor in einer weiteren Phase-III-Studie, CA209-238, randomisiert gegen den PD-1-Blocker Nivolumab antreten. Das komplexe, doppelblinde Studiendesign der Studie, die bei einem Presidential Symposium beim ESMO-Kongress in Madrid von Jeffrey Weber, New York, vorgestellt wurde [2], sah bei über 900 Patienten mit komplett reseziertem Melanom der Stadien IIIB/C oder IV (19% aller Patienten) im experimentellen Arm die Gabe von 3mg/kg Nivolumab alle zwei Wochen für ein Jahr und im Kontrollarm die Gabe von 10 mg/kg Ipilimumab viermal alle drei Wochen und dann ab Woche 24 im 12-wöchigen Abstand vor. Gleichzeitig erhielten die Patienten ein Plazebo für die Substanz der Gegengruppe in den jeweiligen zeitlichen Intervallen. Bei 42% der Patienten wies der Tumor eine BRAF-Mutation auf.
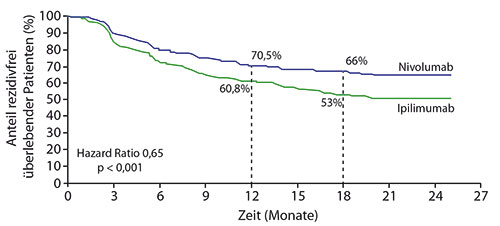
Die Ergebnisse wurden gleichzeitig mit Webers Vortrag in Madrid publiziert [3]: Nach mindestens 18 Monaten Follow-up für alle Patienten war Nivolumab beim primären Endpunkt rezidivfreies Überleben (RFS) signifikant überlegen: Nach zwölf Monaten betrug die Rate 70,5% im Nivolumab- versus 60,8% im Ipilimumab-Arm, nach 18 Monaten 66% versus 53%. Das entsprach einer Reduktion des Risikos für Rezidiv oder Tod um 35% (Hazard Ratio 0,65; p < 0,0001; Abb. 1). Die Überlegenheit von Nivolumab war unabhängig von der Expression des PD-1-Liganden PD-L1 im Tumorgewebe, wenngleich Patienten mit ≥ 5% PD-L1-Expression einen größeren Nutzen von beiden Medikamenten hatten (RFS nach zwölf Monaten 82% unter Nivolumab vs. 74% unter Ipilimumab; HR 0,50) als diejenigen mit < 5% (64% vs. 54%; HR 0,71). Ebenso war der größere Nutzen von Nivolumab unabhängig vom Krankheitsstadium (RFS nach zwölf Monaten bei Stadium III 72% vs. 62%; HR 0,65; bei Stadium IV 63% vs. 58%; HR 0,70) und vom BRAF-Mutationsstatus zu sehen (RFS nach zwölf Monaten bei BRAF-Mutation 68% vs. 63%; HR 0,72; bei BRAF-Wildtyp 72% vs. 57%; HR 0,58). Auch beim exploratorischen Endpunkt Fernmetastasen-freies Überleben schnitt Nivolumab bei den Patienten mit anfänglichem Stadium III nach zwölf Monaten bereits signifikant besser ab (80% vs. 73%; HR 0,73; p = 0,0204).
Daneben war Nivolumab auch deutlich besser verträglich: Nebenwirkungen vom Grad 3 oder 4 traten hier bei 14,4% der Patienten auf, im Ipilimumab-Arm waren sie mit 45,9% dreimal häufiger; Therapieabbrüche wegen unerwünschter Ereignisse waren hier mit 42,6% versus 9,7% sogar mehr als viermal so oft aufgetreten. Zwei toxische Todesfälle im Ipilimumab-Arm mehr als hundert Tage nach der letzten Dosis waren durch eine Knochenmark-Aplasie und eine Kolitis verursacht.
Nivolumab, so Weber, hat damit das Potenzial zu einem neuen Standard für die adjuvante Behandlung von Patienten mit einem komplett resezierten Melanom der Stadien IIIB-IV, unabhängig vom BRAF-Mutationsstatus.
BRAF-mutiertes Melanom: Kinaseinhibitoren adjuvant
Für Patienten mit BRAF-mutiertem Melanom könnten aber auch BRAF- und MEK-Inhibitoren eine Option für die Adjuvanz sein. Beim Presidential Symposium in Madrid wurden zu jeder der beiden Kombinationen, die bislang für fortgeschrittene Stadien zugelassenen sind, Phase-III-Daten zur Adjuvanz präsentiert:
Axel Hauschild, Kiel, berichtete über die COMBI-AD-Studie [4] – die Daten wurden ebenfalls zeitgleich publiziert [5]. Eingeschlossen waren hier nur Patienten mit Hochrisiko-Tumoren des Stadiums III mit BRAF-Mutation (BRAF V600E/K). Sie wurden innerhalb von zwölf Wochen nach einer Komplettresektion ihres Melanoms randomisiert, doppelblind entweder die Kombination aus dem BRAF-Inhibitor Dabrafenib (zweimal täglich 150 mg) und dem MEK-Inhibitor Trametinib (2 mg/d) oder entsprechende Plazebos zu erhalten. Die insgesamt 870 Patienten erhielten die Therapie über ein Jahr.
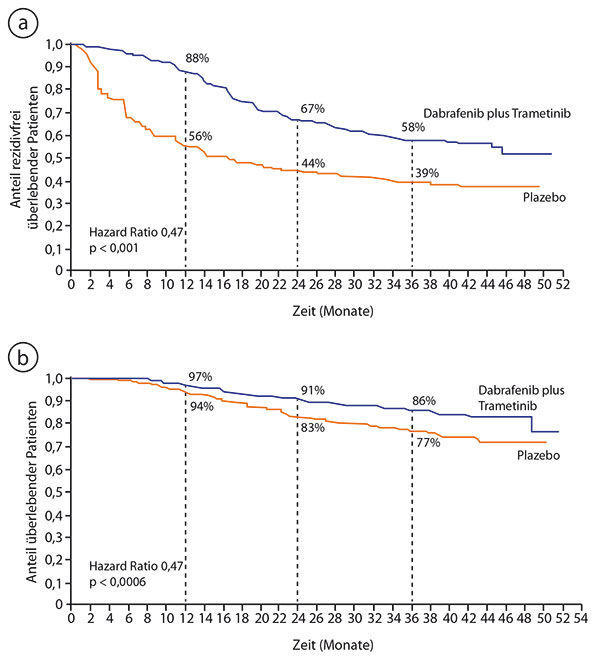
Primärer Endpunkt war auch hier das rezidivfreie Überleben, und hier war die adjuvante Therapie ebenfalls signifikant überlegen: Der Medianwert lag im Plazeboarm bei 16,6 Monaten und ist im experimentellen Arm nach median 2,8 Jahren Nachbeobachtung noch nicht erreicht; der Unterschied zwischen beiden Gruppen betrug nach einem Jahr 88% versus 56%, nach zwei Jahren 67% versus 44% und nach drei Jahren 58% versus 39%. Das Risiko für Rezidiv oder Tod wurde damit etwa halbiert (HR 0,47; p < 0,001; Abb. 2a). Signifikant überlegen war die Kombinationstherapie auch bei den sekundären Endpunkten Gesamtüberleben (HR 0,57; 95%-Konfidenzintervall 0,42–0,79; Abb. 2b), Fernmetastasen-freies Überleben (HR 0,51; 95%-KI 0,40–0,65) und Rezidivfreiheit (HR 0,47; 95%-KI 0,39–0,57).
Nebenwirkungen wurden unter Dabrafenib/Trametinib bei 97% der Patienten im Verumarm beobachtet, bei 41% waren sie vom Grad 3 oder 4, und 26% der Patienten brachen die Behandlung ihretwegen ab. Im Placeboarm lagen die entsprechenden Werte bei 88%, 14% und 3%. Diese Kombination stellt damit nach Hauschilds Ansicht eine neue Option für Patienten mit komplett reseziertem, BRAF-mutiertem Melanom im Stadium III dar.
Vemurafenib-Monotherapie ist Placebo überlegen
Auch der andere in der Palliativtherapie zugelassene BRAF-Inhibitor, Vemurafenib, wurde in der Phase-III-Studie BRIM8 getestet – in diesem Fall, wie Karl Lewis, Aurora, Colorado, in Madrid berichtete, als Monotherapie bei Patienten mit reseziertem Melanom des Stadiums IIC oder III und ebenfalls über ein Jahr und gegen Placebo [6]. Der primäre Endpunkt war hier das krankheitsfreie Überleben (DFS), und er wurde zuerst in der Kohorte von Patienten mit Stadium-IIIC-Melanom analysiert – nach median 34 Monaten Nachbeobachtung.
Zwar zeigte sich Vemurafenib hier überlegen (median 23,1 vs. 15,4 Monate), aber dieser Vorteil war nicht statistisch signifikant (HR 0,80; p = 0,2598), insbesondere wohl, weil die beiden Kurven sich nach zwei Jahren wieder treffen und von da ab identisch zu verlaufen scheinen. In der Kohorte von Patienten mit den Stadien IIC–IIIB hingegen war ein echter Vorteil des BRAF-Inhibitors zu sehen mit DFS-Raten von 72,% versus 56,5% nach zwei und 61% versus 54% nach drei Jahren (HR 0,54; p = 0,0010). Auch in der vorab geplanten gepoolten Analyse der gesamten Intention-to-treat-Population war ein beträchtlicher DFS-Vorteil zu erkennen (HR 0,65; p = 0,0013). Die
Ergebnisse zum Fernmetastasen-freien Überleben sehen ähnlich aus, zum Gesamtüberleben lässt sich noch nichts sagen, so Lewis.
Schwere Nebenwirkungen wurden bei etwa 16% der Patienten unter Vemurafenib beobachtet, zwischen 15% (Stadium IIIC) und 23% (Stadien IIC–IIIB) brachen die Behandlung ab. Insgesamt war das Toxizitätsprofil von Vemurafenib vergleichbar mit dem, was aus der palliativen Situation bekannt ist; an sekundären Tumoren wurden lediglich kutane Plattenepithelkarzinome (7%) und Keratoakanthome (10%) im Verumarm häufiger beobachtet als unter Plazebo.
Bei der adjuvanten Therapie des lokal begrenzten Melanoms tut sich also etwas: Bei nicht BRAF-mutiertem Tumor dürfte Nivolumab künftig die adjuvante Therapie der Wahl sein (eine Zulassungserweiterung vorausgesetzt), beim Vorliegen einer BRAF-Mutation wird man vermutlich die Wahl zwischen Nivolumab und BRAF-Inhibitor (mit oder ohne MEK-Inhibitor) haben, solange es keine direkten Vergleichsstudien gibt.
Dreierkombination beim BRAF-mutierten Melanom?
Checkpoint- und Kinase-Inhibitoren zeigen bei BRAF-mutierten Tumoren jeweils einzeln gute Wirksamkeit – wie sieht es hier mit der Kombination beider Prinzipien aus? Dazu gibt es vielversprechende präklinische Ergebnisse und erste klinische Phase-I-Daten beim fortgeschrittenen Melanom. Zur KEYNOTE-022-Studie, in der der PD-1-Inhibitor Pembrolizumab in der Erstlinie mit Dabrafenib und Trametinib kombiniert wurde, präsentierte Antoni Ribas, Los Angeles beim ESMO-Kongress ein Update [7]: Von 15 eingeschlossenen Patienten zeigten nach bisher median 20 Monaten zehn ein Ansprechen (67%; davon zwei komplette Remissionen) und vier weitere eine Krankheitsstabilisierung. Die mediane Zeit bis zum Ansprechen betrug 2,8 Monate, so Ribas. Von zehn bestätigten Remissionen dauerten sechs zum Zeitpunkt der Datenanalyse noch an.
Die Toxizität unterschied sich nicht von dem, was von den drei Substanzen bekannt ist, sodass die gewohnten Dosierungen nun auch in der Weiterführung der Untersuchung als randomisierte Phase-II-Studie gegeben werden, in der die Dreierkombination in der Erstlinie weiter getestet werden soll. Weitere Studien laufen zu den Kombinationen Dabrafenib/Trametinib/Durvalumab und Vemurafenib/Cobimetinib/Atezolizumab.
Stärkt Hemmung von IDO-1 den Immunangriff auf den Tumor?
Auch andere Kombinationspartner für Checkpoint-Inhibitoren werden untersucht: Ein Mechanismus, durch den Tumorzellen der Immunüberwachung entgehen können, ist die Hochregelung der Indolamin-2,3-Dioxygenase 1 (IDO1). Dieses Enzym baut Tryptophan ab, das von aktivierten zytotoxischen T-Lymphozyten benötigt wird, und die Abbauprodukte aktivieren wiederum regulatorische T-Zellen, die immunsuppressiv wirken. Der orale IDO1-Inhibitor Epacadostat bietet sich daher als Kombinationspartner für Checkpoint-Inhibitoren an, weil beide zusammen in der Theorie synergistisch bei der Aktivierung zytotoxischer T-Zellen wirken müssten. In der Phase-I/II-Studie ECHO-202/KEYNOTE-037 wird Epacadostat daher bei verschiedenen Tumorentitäten mit dem PD-1-Inhibitor Pembrolizumab kombiniert. Omid Hamid, Los Angeles, zeigte in Madrid speziell die aktuellen Phase-I-Daten der 65 eingeschlossenen Patienten mit fortgeschrittenem Melanom, die zuvor keine Checkpoint-Inhibitoren bekommen haben durften [8]:
Nach median 45 Wochen lag die Gesamtansprechrate der 63 auswertbaren Patienten bei 56%; darunter waren neun (14%) Komplettremissionen, und zehn weitere Patienten (16%) erzielten eine Krankheitsstabilisierung. Eine BRAF-Mutation schien keinen Unterschied zu machen, während Patienten mit normalen LDH-Werten, ohne Lebermetastasen und keinem M1c-Stadium besser abzuschneiden schienen. Nach einem Jahr war noch etwa die Hälfte der Patienten progressionsfrei am Leben. An Grad-3/4-Nebenwirkungen von besonderem Interesse traten bei drei Patienten schwere Hautreaktionen, bei zweien eine Kolitis und bei einem eine Autoimmun-Hepatitis auf. Eine Phase-III-Studie (ECHO-301/KEYNOTE-252), in der die Wirksamkeit der Kombination bestätigt werden soll und an der auch fünf deutsche Zentren beteiligt sind, hat bereits die geplante Zahl von 706 Patienten mit nicht systemisch vorbehandeltem fortgeschrittenem Melanom rekrutiert [9].
Literatur
1. Eggermont AMM et al. N Engl J Med 2016; 375: 1845-55.
2. Weber J et al. ESMO 2017, Abstract #LBA8_PR.
3. Weber J et al. N Engl J Med 2017; 377: 1824-35.
4. Hauschild A et al. ESMO 2017, Abstract #LBA6_PR.
5. Long GV et al. N Engl J Med 2017; 377: 1813-23.
6. Lewis K et al. ESMO 2017, Abstract #LBA7_PR.
7. Ribas A et al. ESMO 2017, Abstract #1216O.
8. Hamid O et al. ESMO 2017, Abstract #1214O.
9. ClinicalTrials.gov: NCT02752074.

Josef Gulden

