Das kolorektale Karzinom (KRK) ist weltweit die dritthäufigste Krebs-Todesursache, in Europa ist es das zweithäufigste Karzinom und die zweithäufigste Krebs-Todesursache mit etwa 200.000 Todesfällen pro Jahr [1]. In den letzten Jahren konnten die Überlebenszeiten insbesondere in der metastasierten Situation (UICC-Stadium IV) stetig verlängert werden. Dies ist nicht zuletzt auf effizientere und wirksamere Therapieoptionen in der Systemtherapie (sogenannte „targeted therapies“) sowie verbesserte Lokaltherapien (Lebermetastasen-Resektion, lokal-ablative Verfahren) zurückzuführen.
Etwa 50% aller an einem kolorektalen Karzinom erkrankten Patienten entwickeln im Laufe ihrer Krankheit Fernmetastasen, sei es als Rezidiv, also metachron, oder bereits zum Zeitpunkt der Erstdiagnose, also synchron mit dem Primärtumor. Etwa 20% der Patienten mit der Erstdiagnose KRK zeigen eine prognostisch ungünstige synchrone Metastasierung, wobei die Metastasen am häufigsten in Leber (75%), Lunge (15%) und Skelettsystem (5%) auftreten [2]. Der vorliegende Beitrag konzentriert sich insbesondere auf Patienten mit synchron metastasiertem KRK und stellt die evidenzbasierten Überlegungen zur Auswahl der optimalen Therapie für den individuellen Patienten dar.
Prognostische Überlegungen
Die Resektion von Metastasen eines kolorektalen Karzinoms – bei synchroner Metastasierung in Verbindung mit der Resektion des Primärtumors – macht Sinn, bedeutet sie doch eine potenziell kurative Option und damit die Chance auf eine dauerhafte Heilung der Tumorerkrankung.
Aus Langzeitergebnissen mit 10-Jahres-Überlebensdaten bei resezierten Patienten mit metastasiertem KRK wissen wir, dass sich nach fünf Jahren eine stabile Population von Patienten herauskristallisiert, die tumorfrei sind und damit als geheilt gelten können. Das ist unabhängig davon, ob es sich um primär resektable, meist hepatische Metastasen handelt oder ob die Metastasen erst nach Vortherapie einer sekundären Resektion zugeführt werden konnten; es handelt sich um zwischen 15% und 27% der Patienten [3, 4]. Diese Rate an Langzeitüberlebenden nach Resektion v. a. von Lebermetastasen hat sich durch neue systemische Therapieoptionen sowie verbesserte und neue chirurgische Resektionsverfahren – teilweise in Verbindung mit lokal-ablativen Verfahren – in den letzten Jahren erhöht [5], und es ist zu erwarten, dass diese Entwicklung weiter voranschreitet. Daraus ergibt sich, dass für die überwiegende Mehrzahl der Patienten die Resektion von Metastasen keine Heilung, jedoch eine Verlängerung des Gesamtüberlebens im Vergleich zu nicht resezierten Patienten bringt. Relevant sind auch Phasen mit Remission der Erkrankung ohne Systemtherapie („drug holidays“), die gerade hinsichtlich einer guten Lebensqualität von Bedeutung sind [5].
Es gibt eine Reihe von prognostischen Faktoren zur Identifizierung von Patienten, die mit hoher Wahrscheinlichkeit von einer Metastasen-Resektion profitieren bzw. ein hohes Risiko für ein frühes Rezidiv haben. Der Anteil an Patienten mit krankheitsfreiem Überleben (DFS) nach fünf Jahren ist nach einer retrospektiven Arbeit um mehr als die Hälfte geringer, wenn neben Lebermetastasen zusätzlich Lymphknotenmetastasen vorliegen (5-Jahres-DFS 23% vs. 11%; [6]). Ein wichtiger Prognosefaktor ist auch der Chirurg: Bei mikroskopisch nicht im Gesunden entfernten Metastasen, d. h. einem positiven Resektionsrand (R1) verschlechtert sich die Prognose rapide (5-Jahres-Überleben 10%; [3]). Allerdings ist hier zu berücksichtigen, dass z. B. bei Ultraschallresektion von Lebermetastasen der Pathologe nicht den tatsächlichen Resektionsrand im Präparat vorliegen hat.
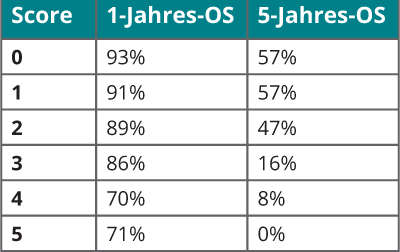
Um diesen und weiteren bekannten Risikofaktoren Rechnung zu tragen, wurden in den letzten Jahren Risikoscores entwickelt, um die Prognose von Patienten mit synchroner, aber auch mit metachroner Metastasierung abzuschätzen. Am weitesten verbreitet ist dabei der Score nach Fong et al. [7]: Neben der Anzahl der Metastasen und der Größe der größten Metastase fließen hier zusätzlich der CEA-Wert und der Lymphknotenstatus des Primarius mit ein. Ein kurzes Intervall bis zum Auftreten von Metastasen (< 12 Monate) bzw. eine synchrone Metastastasierung ist ein negativer prognostischer Faktor (Tab. 1). Ein errechneter Punktwert gibt Aufschluss über die zu erwartende Überlebenschance zu verschiedenen Zeitpunkten (Tab. 2). Der Fong-Score basiert auf Daten von primär chirurgisch behandelten Patienten mit KRK und Lebermetastasierung ohne perioperative medikamentöse Tumortherapie. Neuere retrospektive Analysen zeigen, dass diese Kriterien auch bei Resektion nach perioperativer Systemtherapie Gültigkeit besitzen [8].
Bei isolierten Lungenmetastasen hat sich bisher nur ein erhöhter CEA-Wert präoperativ als prognostisch negativer Marker erwiesen. Die Angaben zur prognostischen Relevanz der Anzahl der Metastasen sind inkonsistent, zeigen aber einen Trend zu einem Überlebensvorteil bei singulärer Metastasierung. Weitere mögliche Einflussfaktoren wie das krankheitsfreie Intervall oder das initiale Tumorstadium konnten sich dagegen nicht als prognostische Marker bei isolierten Lungenmetastasen etablieren [9].