Aktuelle Strategien zur Therapiestratifizierung beim metastasierten kolorektalen Karzinom
Das kolorektale Karzinom (KRK) ist bei Frauen die zweithäufigste und bei Männern die dritthäufigste Tumorerkrankung in Deutschland mit insgesamt ungefähr 60.000 Neuerkrankungen jährlich (RKI-Bericht zum Krebsgeschehen 2016). In den letzten zehn Jahren sind die Neuerkrankungsraten in der Altersgruppe ab 55 Jahren bei beiden Geschlechtern rückläufig, während die Rate der fortgeschrittenen Vorstufen (In-situ-Karzinome) zunimmt. Dies ist wahrscheinlich bedingt durch die Einführung der Darmkrebs-Früherkennung (Koloskopie-Screening) ab 2002. Etwa 20–25% der Patienten mit KRK weisen bereits bei Diagnosestellung Fernmetastasen auf (mKRK), bei weiteren bis zu 25% kommt es nach Resektion des Primärtumors im späteren Verlauf zum Auftreten von Metastasen. Dies führt zu der relativ geringen 10-Jahres-Überlebensrate von ca. 60%. Bei der Mehrzahl der Patienten (80%) ist von der Metastasierung die Leber betroffen, bei ungefähr 20–30% ausschließlich [1, 2].
Während der letzten beiden Jahrzehnte kam es neben der Abnahme der Neuerkrankungsrate durch Vorsorge-Koloskopien auch zu einer Abnahme der Mortalität des KRK, wahrscheinlich bedingt durch die verbesserte und frühzeitige Detektion potenziell heilbarer Stadien, sowie durch Verbesserung und Fortschritte in den therapeutischen Optionen, insbesondere in der interdisziplinären Behandlung von Leber- und Lungenmetastasen mittels Chirurgie und systemischer Therapie. So hat sich das mediane Gesamtüberleben in bestimmten Patientengruppen (z. B. linksseitig lokalisierte Primärtumoren und/oder RAS/BRAF-Wildtyp) auf 30 Monate und mehr verlängert [3, 4]. Über die Hälfte der Patienten durchläuft heutzutage mehr als zwei systemische Therapielinien.
Für die Therapie des metastasierten kolorektalen Karzinoms stehen verschiedene Wirkstoffe entweder als Monotherapie oder im Rahmen von Kombinationstherapien bis hin zu Vierfach-Regimes zur Verfügung. Hierbei handelt es sich um Fluoropyrimidine (5-Fluorouracil (5-FU) mit Folinsäure (FS), Capecitabin), Oxaliplatin, Irinotecan, Trifluridin-Tiparicil (TAS-102), antiangiogene Substanzen wie Bevacizumab, Aflibercept, Regorafenib oder Ramucirumab, und die Antikörper gegen den Rezeptor für epidermalen Wachstumsfaktor (EGFR) Cetuximab und Panitumumab. Darüberhinaus werden chirurgische und in zunehmendem Maße auch lokal-ablative Therapie (Radiofrequenz-/oder Mikrowellenablation, stereotaktische Radiotherapie – SBRT)) entweder primär oder sekundär (nach sehr gutem Ansprechen auf Chemotherapie) eingesetzt. Diese Vielzahl an therapeutischen Optionen wird in verschiedenen Sequenzen und nach zwingend notwendiger interdisziplinärer Maßgabe angewendet [5].
Prognostische und prädiktive Faktoren
Eine Vielzahl von Faktoren hat einen Einfluss auf die Prognose von Patienten mit mKRK. Hierbei lässt sich zwischen Patienten-abhängigen Faktoren wie zum Beispiel Alter, Komorbiditäten und Allgemeinzustand, biochemischen Faktoren wie den initialen Konzentrationen der Laktatdehydrogenase (LDH) und des Carcinoembryonalen Antigens (CEA), Leukozyten, Thrombozyten, Hämoglobin, Albumin und der alkalischen Phosphatase (AP) sowie tumorabhängigen Faktoren wie der Anzahl der Metastasen, der Lokalisation des Primärtumors sowie des Intervalls zwischen Primärtumor und Metastasenentwicklung unterscheiden [6].
Neben den genannten prognostischen Faktoren, die insbesondere zur Festlegung der Therapieintensität relevant sind, gibt es einige prädiktive Faktoren, die die Auswahl der Therapie mitbestimmen und aus diesem Grund bereits bei Erstdiagnose eines mKRK bestimmt werden sollten.
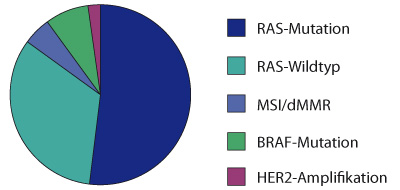
- So ist das Vorliegen einer Mutation im RAS-Gen bzw. -Protein (Tyrosinkinase innerhalb der EGFR-Signalkaskade, die im Falle einer Mutation unabhängig vom EGF-Rezeptor aktiviert ist), insbesondere in den Exonen 2, 3 und 4 des KRAS- oder des NRAS-Gens, prädiktiv für ein fehlendes Ansprechen auf die Therapie mit einem EGFR-Antikörper. Demnach sind Cetuximab und Panitumumab nur bei Patienten mit RAS-Wildtyp (ca. 50% aller Patienten) potenziell wirksam und zugelassen.
- In 8–10% der Fälle kann zudem der Tumor eine BRAF-Mutation aufweisen. Hierbei handelt es sich vorwiegend um eine BRAF-V600E-Mutation. Bei Tumoren mit einer solchen Mutation zeigt sich neben einer sehr ungünstigen Prognose (medianes Überleben ca. zwölf Monate) auch eine deutlich verminderte Wahrscheinlichkeit für ein Ansprechen auf eine auf EGFR-Antikörpern basierende Therapie. Aufgrund der unterschiedlichen biologischen Auswirkungen auf die BRAF-Tyrosinkinase sind andere BRAF-Mutationen (nicht V600E) mit einer deutlich günstigeren Prognose assoziiert [7].
- Weitere prädiktive Marker sind eine Mikrosatelliteninstabilität oder defiziente „Mismatch Repair“-Proteine, die für den Einsatz einer Immuntherapie sprechen, sowie eine HER2-Positivität, bei der eine gegen HER2 gerichtete Therapie mit z. B. Trastuzumab eingesetzt werden kann (Abb. 1). Außerhalb von Studien sind diese beiden Marker allerdings erst in der fortgeschrittenen Therapiesituation relevant („off-label use“; siehe Absatz „Therapie molekular definierter Subgruppen“).
- Neben den molekularen Markern ist die Lokalisation des Primärtumors (rechtes Hemikolon vs. linkes Hemikolon) von prognostischer und prädiktiver Relevanz. Neben einer deutlich ungünstigeren Prognose zeigt sich bei rechtsseitigen Primärtumoren auch ein fehlendes Ansprechen auf Therapien mit EGFR-Antikörpern unabhängig vom RAS/BRAF-Status [4]
Therapiestrategien in der Erstliniensituation
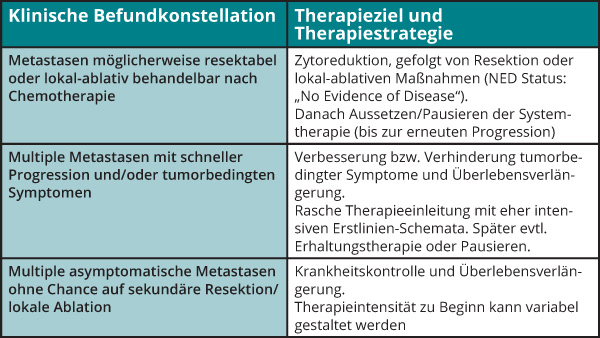
Zur Festlegung der individuellen Therapiestrategie im Rahmen einer interdisziplinären Tumorkonferenz ist neben der Berücksichtigung des Primärtumors und gegebenenfalls primär resektabler Lebermetastasen (siehe Artikel von T. Ettrich, S. 418ff.) die klinische Befundkonstellation von höchster Relevanz (siehe Tab. 1). Beim metastasierten und nicht primär resektablen mKRK ist es sinnvoll, zwischen limitierter oder Oligo-Metastasierung mit Option für chirurgische oder lokale Verfahren nach Erzielen einer Krankheitskontrolle mit systemischer Therapie einerseits und einem mKRK ohne Option für sekundäre Lokalablation aufgrund der Tumor- oder Patientenfaktoren andererseits zu unterscheiden.
Systemische Therapieoptionen für die Erstlinientherapie reichen von einer Monotherapie mit einem Fluoropyrimidin bis hin zu einer Kombination mit zwei (z. B. 5-FU/FS und Oxaliplatin (FOLFOX) oder 5-FU/FS und Irinotecan (FOLFIRI)) oder drei Chemotherapeutika (z. B. FOLFOXIRI), und gegebenenfalls einem Antikörper (Bevacizumab oder ein EGFR-Antikörper; [5]). In den letzten Jahren zeigte sich in randomisierten Studien, dass Patienten in entsprechendem Allgemeinzustand mit einer möglichst intensiven Erstlinientherapie (mindestens Zweifach-Chemotherapie in Kombination mit einem Antikörper) ein längeres Gesamtüberleben erreichen [8–10].
Limitiert oder oligo-metastasiertes KRK
Diese Gruppe ist in der klinischen Definition unscharf umrissen, umfasst aber letztlich alle Patienten mit einer limitierten Metastasierung außerhalb der Kriterien von technisch sicher R0-resezierbaren Lebermetastasen, die demnach initial systemisch therapiert werden müssen. Je nach Lokalisation und Anzahl der Metastasen können in dieser Patientengruppe nach Erreichen einer systemischen Kontrolle (Therapieansprechen) chirurgische oder lokal-ablative Therapien eingesetzt werden. Dies betrifft beispielsweise „potenziell resektable“ Leber- und/oder Lungenmetastasen, die nach einer „Induktionstherapie“ (im Regelfall eine Kombination von FOLFOX, FOLFIRI oder FOLFOXIRI mit einem EGFR-Antikörper oder Bevacizumab) reseziert werden können.
Zudem können auch Patienten mit (technisch) irresektablen Metastasen von der Kombination aus destruierenden, lokal-ablativen Verfahren und systemischen Therapien profitieren, wobei Sequenz und Modalität kontrovers diskutiert werden. So konnte in der CLOCC-Studie für die Kombination aus Radiofrequenz-Ablation, Chirurgie und Chemotherapie bei irresektablen Lebermetastasen auch noch nach zehn Jahren Nachbeobachtung ein Vorteil beim progressionsfreien (PFS) und Gesamtüberleben (OS) gegenüber alleiniger Chemotherapie gezeigt werden [11].
Demgegenüber bewirkt die Hinzunahme einer Radioembolisation (SIRT) zur systemischen Erstlinientherapie bei Patienten mit irresektablen Lebermetastasen und limitierter extrahepatischer Metastasierung zwar eine signifikante Verbesserung des PFS in der Leber, aber keine Verbesserung des Gesamt-PFS und des OS [12]. Möglicherweise bedingen die Dosiskompromisse in der systemischen Therapie bei der Kombination mit SIRT die schnellere extrahepatische Progression.
Als weiteres Verfahren, bislang allerdings ohne randomisierte Daten, kann die stereotaktische Radiotherapie (SBRT) eingesetzt werden, die nicht auf die Leber beschränkt ist und effektiv für limitierte extrahepatische Manifestationen eingesetzt werden kann (z. B. Lunge, Lymphknoten; [13]).
Patienten mit limitierter Peritonealkarzinose (PCI < 12) können ebenfalls von einer multimodalen Behandlung mit systemischer Therapie, zytoreduktiver Chirurgie und hyperthermer intraperitonealer Chemotherapie (HIPEC) profitieren. Eine kleine randomisierte Studie konnte für das multimodale Vorgehen gegenüber alleiniger Systemtherapie einen PFS- und OS-Vorteil zeigen [14].
mKRK ohne Option für Resektion oder lokale Ablation mit Zielsetzung einer anhaltenden systemischen Kontrolle
Bei wahrscheinlich etwas mehr als der Hälfte Patienten mit mKRK ist aufgrund der Erkrankungsausbreitung keine lokal-ablative oder chirurgische Therapie anwendbar. In dieser Patientengruppe stellt sich nach Erzielen einer Krankheitskontrolle durch mehr oder weniger intensive Induktionstherapie-Regimes nach drei bis sechs Monaten die Frage nach dem weiteren Vorgehen. Dies ist von besonderer Relevanz im Hinblick auf Substanzen mit kumulativen Toxizitäten wie z. B. einer Polyneuropathie durch Oxaliplatin und auf den Erhalt der Lebensqualität. In Studien sind verschiedene Konzepte mit intensiver Induktionstherapie, gefolgt von besser verträglichen Erhaltungstherapien oder Therapiepausen und Wiederbeginn der pausierten Therapie entweder bei Voranschreiten der Erkrankung oder in festgelegten Intervallen, geprüft worden [15]. Bevacizumab-basierte Erhaltungstherapien (mit oder ohne Fluoropyrimidin) wurden in diesem Kontext am häufigsten untersucht und zeigten eine Verbesserung des PFS ohne signifikanten Einfluss auf das OS [16]. Insbesondere scheinen Patienten mit Ansprechen auf die Induktionstherapie und ohne Vorliegen einer RAS-Mutation von einer Bevacizumab-basierten Erhaltungstherapie zu profitieren [17].
Zweit- und /Drittlinientherapie
In Anbetracht der Vielzahl der verfügbaren Substanzen stehen heute je nach molekularem Profil (RAS- bzw. BRAF-Status) und Wahl der Erstlinientherapie mindestens zwei weitere Therapielinien zur Verfügung. So können neben den bewährten Optionen mit Wechsel der Chemotherapie-Kombination (von Irinotecan zu Oxaliplatin oder vice versa) in der Regel unter Beibehaltung des Fluoropyrimidins bei Progress unter der Erstlinientherapie sowohl EGFR-Antikörper als auch anti-angiogene Substanzen in Kombination mit Chemotherapie eingesetzt werden. In der Zweitlinientherapie liegen für das Konzept der fortgesetzten anti-angiogenen Therapie nach Bevacizumab-haltiger Erstlinientherapie mit wechselnder Chemotherapie mittlerweile für Bevacizumab, Aflibercept und Ramucirumab positive, aber studienübergreifend sehr ähnliche Daten aus großen Phase-III-Studien vor [18–20]. Sowohl Aflibercept als auch Ramucirumab sind dabei nur in Kombination mit FOLFIRI evaluiert und zugelassen. Für den Einsatz von EGFR-Antikörpern in der Zweitlinientherapie konnte eine Verbesserung des Ansprechens und des PFS gezeigt werden [21, 22]. Ein Gesamtüberlebensvorteil konnte allerdings im Gegensatz zu den anti-angiogenen Substanzen nicht gezeigt werden. Da ein klarer Überlebensvorteil für Patienten mit RAS/BRAF-Wildtyp und linksseitigem Primärtumor unter einer EGFR-haltigen Erstlinientherapie gezeigt wurde und die Primärtumorlokalisation auch in späteren Therapielinien weiterhin prädiktiv ist, bleibt der Einsatz von EGFR-Antikörpern in fortgeschrittenen Therapielinien auf Patienten mit dem oben genannten Profil limitiert, die aus besonderen Gründen in der Erstlinie diese Antikörper nicht bekommen haben [23].
Therapie des refraktären mKRK
Im Falle eines therapierefraktären mKRK ist TAS-102, eine Kombination aus den Wirkstoffen Trifluridin und Tipiracil, zugelassen. In der Phase-III-Studie RECOURSE zeigte sich mit einer TAS-102-Monotherapie im Vergleich zu Placebo bei vorbehandelten Patienten ein verlängertes OS (7,1 vs. 5,3 Monate; p < 0,001). Dabei war das Nebenwirkungsprofil bis auf eine erhöhte Hämatotoxizität günstig [24]. Eine weitere Möglichkeit zur Behandlung des therapierefraktären mKRK stellt der Multikinase-Inhibitor Regorafenib dar. Die Phase-III-Studie CORRECT zeigte, dass eine Therapie mit Regorafenib im Vergleich zu Plazebo mit einem verlängerten OS einhergeht (6,4 vs. 5,0 Monate; p = 0,0052; [25]). Allerdings kann es unter Regorafenib zu potenziell subjektiv beeinträchtigenden Nebenwirkungen wie Hand-Fuß-Syndrom, Diarrhö oder Fatigue kommen. Zudem wurde Regorafenib durch den Hersteller vom deutschen Markt genommen, nachdem der Gemeinsame Bundesausschuss
(G-BA) der Substanz einen Zusatznutzen abgesprochen hatte. Dadurch ist Regorafenib zwar in Deutschland zugelassen, aber nur nach entsprechendem Antrag bei der Krankenkasse über die internationale Apotheke zu beziehen.
Bei Progress unter Dritt- oder sogar Viertlinientherapie und weiter bestehendem adäquatem Allgemeinzustand und Behandlungswunsch des Patienten gibt es weitere Therapieoptionen mit allerdings nur geringem Evidenzniveau. So kann bei initial gutem therapeutischem Ansprechen auf eine Erst- oder Zweitlinientherapie ein erneuter Behandlungsversuch mit dieser im Sinne einer sogenannten Re-Induktion unternommen werden, wenn es unter initialer Therapie nicht zum Progress gekommen ist. Zudem existieren verschiedene Therapieoptionen für molekular definierte Subgruppen, die im Rahmen eines „Off-label use“ eingesetzt werden können (siehe folgendes Kapitel).
Therapie molekular definierter Subgruppen
Mikrosatelliteninstabilität oder defiziente „Mismatch-Repair“-Proteine
Ungefähr 10–15% der kolorektalen Karzinome entstehen auf dem Boden einer genetischen Prädisposition. Das autosomal dominant vererbte Lynch-Syndrom ist eine der häufigsten genetischen Ursachen für ein KRK. Bei diesen Patienten findet sich eine Keimbahnmutation in einem der vier DNA-Reparaturgene MLH1, MSH2, MSH6 oder PMS2 („Mismatch-Repair“, MMR), welche zu einer charakteristischen Mikrosatelliteninstabilität (MSI) infolge einer fehlerhaften DNA-Replikation bei der Zellteilung führt. In über 80% aller kolorektalen Karzinome bei Lynch-Syndrom, aber auch bei 10–15% aller sporadischen Kolonkarzinome lässt sich eine MSI nachweisen. Bei der Mehrzahl der sporadischen MSI-positiven kolorektalen Karzinome liegt eine Inaktivierung des MMR-Gens MLH1 auf dem Boden einer Methylierung von dessen Promotor im Tumor vor. Bei diesen Tumoren ist der MSI-Status mit proximaler Primärtumor-Lokalisation, muzinöser Histologie und Nachweis einer BRAF-Mutation assoziiert.
Aus klinischer Sicht war der Nachweis des MSI-Status in der Vergangenheit insbesondere im UICC-Stadium II von prognostischer Bedeutung, da diese Patienten ein deutlich besseres Überleben aufweisen. Bislang gibt es nur wenige Daten, die auf eine Bedeutung des MSI-Status als prädiktiver Biomarker für Kombinationschemotherapien wie FOLFOX und FOLFIRI in der palliativen Situation hinweisen. In einer aktuellen Auswertung der CALGB-Studie fand sich allerdings ein signifikant schlechteres Überleben von median nur 11,2 Monaten bei mKRK-Patienten mit hoher MSI unter einer Erstlinientherapie mit Cetuximab im Vergleich zu einem Überleben von 30 Monaten unter einer Kombinationstherapie mit Bevacizumab [26]. Wenn sich diese Daten in weiteren Untersuchungen bestätigen, sollte der MSI-Status analog zum RAS-Status vor Einleitung einer palliativen Systemtherapie bestimmt werden.
Von überragender positiver prädiktiver Bedeutung ist der MSI-Status allerding für die Immuntherapie, da diese Tumoren auf Grund ihrer hohen Mutationslast deutlich mehr Neoantigene aufweisen, die wiederum zu einer Aktivierung des Immunsystems führen. Aufgrund der hohen Wirksamkeit der Checkpoint-Inhibition bei Patienten mit MSI-Tumoren wurde die Therapie mit Pembrolizumab erstmals von der FDA organübergreifend allein auf der Grundlage eines gemeinsamen Biomarkers zugelassen. Im Rahmen der CheckMate-142-Studie wird bei Patienten mit einem metastasierten MSI-KRK Nivolumab nach Versagen der Chemotherapie mit der Kombination aus Nivolumab und Ipilimumab verglichen [27]. Bei den 74 mit Nivolumab behandelten Patienten konnte eine Ansprechrate von 32% erreicht werden, mit zwei kompletten und 22 partiellen Remissionen. Die mediane Dauer des Ansprechens wurde noch nicht erreicht. Mit der Kombinationsbehandlung konnte eine Ansprechrate von 55% erreicht werden, und die 1-Jahres-Überlebensrate lag damit bei 88%. Die Wirksamkeit der Immuntherapie war dabei unabhängig vom Vorliegen von BRAF- oder KRAS-Mutationen, der PD-L1-Expression oder eines Lynch-Syndroms. Insgesamt scheint die Wirksamkeit von Nivolumab vergleichbar mit der von Pembrolizumab zu sein: Bei den 61 Patienten mit fortgeschrittenem KRK, die in der KEYNOTE-164-Studie behandelt worden waren, lag die Ansprechrate bei 28% bei einer Krankheitskontrollrate von 51% [28].
BRAF-Mutation (V600E)
Beim Kolonkarzinom ist bei ca. 8–10% der Patienten eine Mutation im BRAF-Gen nachweisbar. Ähnlich wie für den MSI-Status findet sich eine Häufung in rechtseitigen Tumoren sowie bei Frauen und einer muzinösen Histologie. In der metastasierten Situation ist die häufigste BRAF-Mutation, die V600E-Punktmutation, unabhängig vom MSI-Status mit einer sehr schlechten Prognose assoziiert. Deutlich seltener finden sich Mutationen in anderen Kodons des BRAF-Gens, deren Prognose interessanterweise der von Tumoren mit BRAF-Wildtyp vergleichbar ist [7]. Auch bei den Tumoren mit BRAF-V600E-Mutation gibt es bereits erste Hinweise, dass es sich hier nicht um eine homogene Gruppe handelt, sondern dass man schon anhand des Genexpressions-Musters mindestens zwei Subgruppen identifizieren kann [29], die möglicherweise auch eine unterschiedliche Sensitivität gegenüber molekularen Therapien aufweisen.
Neben der negativen prognostischen Bedeutung hat die V600E-Mutation sehr wahrscheinlich auch eine negative prädiktive Bedeutung für eine gegen den EGFR gerichtete Therapie. In zwei publizierten Metaanalysen aus den bereits publizierten Studien konnte entsprechend keine klinisch überzeugende Wirksamkeit für eine Anti-EGFR-Therapie nachgewiesen werden [30]. Bemerkenswert waren die Ergebnisse der TRIBE-Studie, in der in der molekularen Subgruppe der BRAF-mutierten Patienten mittels der intensivierten Triplet-Chemotherapie FOLFOXIRI in Kombination mit Bevacizumab im Vergleich zur Chemotherapie-Doublette das mediane Überleben von 10,7 auf 19 Monate gesteigert werden konnte. Damit konnten in dieser relativ kleinen Subgruppe der TRIBE-Studie die guten Ergebnisse einer einarmigen italienischen Studie an 25 BRAF-mutierten Patienten mit FOLFOXIRI plus Bevacizumab bestätigt werden [31].
Aktuelle Daten zeigen vielversprechende Ergebnisse für eine sequenzielle Hemmung des EGFR-Signalwegs bei Patienten mit BRAF-mutiertem KRK. In einer Studie konnte durch die Kombination des BRAF-Inhibitors Vemurafenib mit Cetuximab und Irinotecan das mediane PFS auf 4,3 Monate gesteigert werden im Vergleich zu 2,0 Monaten bei Patienten, die nur Cetuximab und Irinotecan erhielten [32]. Die Erkrankungskontroll-Rate betrug 67% für die Kombination von Cetuximab/Irinotecan mit gegenüber 22% ohne Vemurafenib. Das mediane Gesamtüberleben konnte von 5,9 Monaten unter der Zweierkombination auf 9,6 Monate bei Zugabe von Vemurafenib gesteigert werden. In einem ähnlichen Ansatz wird in der aktuell rekrutierenden Phase-III-Studie BEACON bei vorbehandelten Patienten eine Standardtherapie mit Irinotecan und Cetuximab mit einer Chemotherapie-freien Kombination aus dem BRAF-Inhibitor Encorafenib und Cetuximab mit und ohne den MEK-Inhibitor Binimetinib untersucht. Für die Studie wurden erste Daten aus der Safety-lead-in-Phase beim ESMO-Kongress 2017 vorgestellt. Unter der Dreifachkombination war bei einer Gesamtansprechrate von 41% nur einer von 28 Patienten progredient. Die Wirksamkeit war dabei unabhängig von der Tumorlokalisation, allerdings zeigte sich ein höheres Ansprechen für Patienten mit nur einer im Vergleich zu Patienten mit zwei Vortherapien [33].
HER2-Positivität
HER2 spielt als prädiktiver Biomarker und Zielstruktur der molekularen Therapie bisher vor allem beim Mamma- und beim Magenkarzinom eine Rolle. Die duale Blockade des HER2-Rezeptors mit Trastuzumab und Lapatinib stellt dabei beim Mammakarzinom eine hocheffektive Therapieoption dar, im Gegensatz zum Magen-Ca, bei dem eine alleinige HER2-Blockade mit Trastuzumab in Kombination mit einer Chemotherapie zur Anwendung kommt. Basierend auf sehr vielversprechenden Daten aus präklinischen Xenograft-Modellen wurde in der italienischen HERAKLES-Studie der Einsatz von Trastuzumab und Lapatinib bei Patienten mit KRAS-Wildtyp untersucht, die in der Immunhistochemie alleine (3+) oder (bei 2+) zusätzlich in der In-situ- Hybridisierung (FISH) positiv für Her2/neu waren [34]. Durch die duale Blockade konnte der primäre Endpunkt der Studie, ein objektives Ansprechen, in 87,5% der Fälle erreicht werden, bei einem medianen PFS von 5,5 Monaten. Allerdings mussten insgesamt 849 Patienten untersucht werden, um 46 Patienten mit HER2/neu-amplifizierten Tumoren zu identifizieren (5,4%). Neben dieser positiven prädiktiven Rolle einer HER2/neu-Amplifikation ergaben sich in der Studie auch Hinweise auf einen negativen prädiktiven Wert hinsichtlich einer gegen den EGFR gerichteten Therapie. Ähnlich wie in den präklinischen Modellen, in denen erstmals eine HER2/neu-Amplifikation als Resistenzmechanismus für eine Anti-EGFR-Therapie identifiziert wurde, war bei den Patienten in der HERAKLES-Studie kein Ansprechen auf die vorab-durchgeführten Therapien mit Anti-EGFR-Antikörpern zu beobachten.
Die Daten aus der HERAKLES-Studie werden von ersten Daten aus der Studie MyPathway gestützt, in der die Wirksamkeit einer dualen Hemmung des Rezeptors mittels Trastuzumab und Pertuzumab bei intensiv vorbehandelten Patienten untersucht wird [35]. Interessanterweise zeigte sich in dieser nicht bezüglich KRAS selektierten Patientenkohorte eine hohe Ansprechrate von 52% und ein medianes OS von 14 Monaten bei Patienten mit KRAS-Wildtyp im Vergleich zu 0% bei Patienten mit KRAS-mutierten Tumoren (medianes OS nur vier Monate). Neben der KRAS-Mutation scheint, ebenso wie bei den gegen den EGFR gerichteten Therapien, auch die Tumorlokalisation von Bedeutung zu sein, da ähnlich wie bei den Patienten mit KRAS-mutiertem Tumor bei denen mit einem rechtsseitigen Primarius keine überzeugende Wirksamkeit gezeigt werden konnte.
Summary
Management of metastatic colorectal cancer includes the administration of several systemic agents (fluoropyrimidines, irinotecan, oxaliplatin, trifluridine/tipiracil, aflibercept, bevacizumab, cetuximab, panitumumab, ramucirumab, regorafenib) stratified for molecular and disease or patient-related factors and the application of surgical or locally ablative techniques to ensure the optimal balance between disease control and quality of life.
Keywords: metastatic colorectal carcinoma, systemic therapy, chemotherapy, targeted therapy, molecular therapeutic stratification
Literatur
1. Mantke R et al. Incidence of synchronous liver metastases in patients with colorectal cancer in relationship to clinico-pathologic characteristics. Results of a German prospective multicentre observational study. Eur J Surg Oncol 2012; 38: 259-65. 2. van der Pool AE et al. Trends in incidence, treatment and survival of patients with stage IV colorectal cancer: A population-based series. Colorectal Dis 2012; 14: 56-61.
3. Tejpar S et al. Prognostic and predictive relevance of primary tumor location in patients with RAS wild-type metastatic colorectal cancer: Retrospective analyses of the CRYSTAL and FIRE-3 trials. JAMA Oncol 2016, Oct 10 [Prepub ahead of print, DOI 10.1001/jamaoncol.2016.3797].
4. Arnold D et al. Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol 2017; 28: 1713-29.
. Van Cutsem E et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016; 27: 1386-422.
6. Schmoll HJ et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23(10): 2479-2516.
7. Jones JC et al. Non-V600 BRAF mutations define a clinically distinct molecular subtype of metastatic colorectal cancer. J Clin Oncol 2017; 35: 2624-30.
8. Douillard JY et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013; 369: 1023-34.
9. Loupakis F et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371: 1609-18.
10. Van Cutsem E et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol 2015; 33: 692-700.
11. Ruers T et al. Local treatment of unresectable colorectal liver metastases: Results of a randomized phase II trial. J Natl Cancer Inst 2017, Sep 1 [prepub ahead of print, DOI 10.1093/jnci/djx015].
12. Wasan HS et al. First-line selective internal radiotherapy plus chemotherapy versus chemotherapy alone in patients with liver metastases from colorectal cancer (FOXFIRE, SIRFLOX, and FOXFIRE-Global): A combined analysis of three multicentre, randomised, phase 3 trials. Lancet Oncol 2017; 18: 1159-71.
13. Timmerman RD et al. Emergence of stereotactic body radiation therapy and its impact on current and future clinical practice. J Clin Oncol 2014; 32: 2847-54.
14. Cashin PH et al. Cytoreductive surgery and intraperitoneal chemotherapy versus systemic chemotherapy for colorectal peritoneal metastases: A randomised trial. Eur J Cancer 2016; 53: 155-62.
15. Berry SR et al. Continuous versus intermittent chemotherapy strategies in metastatic colorectal cancer: A systematic review and meta-analysis. Ann Oncol 2015; 26: 477-85.
16. Stein A et al. Effect of application and intensity of bevacizumab-based maintenance after induction chemotherapy with bevacizumab for metastatic colorectal cancer: A meta-analysis. Clin Colorectal Cancer 2016; 15: e29-39.
17. Hegewisch-Becker S et al. Maintenance strategies after first-line oxaliplatin plus fluoropyrimidine plus bevacizumab for patients with metastatic colorectal cancer (AIO 0207): A randomised, non-inferiority, open-label, phase 3 trial. Lancet Oncol 2015; 16: 1355-69.
18. Van Cutsem E et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30: 3499-506.
19. Bennouna J et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): A randomised phase 3 trial. Lancet Oncol 2013; 14: 29-37.
20. Tabernero J et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): A randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015; 16: 499-508.
21. Seymour MT et al. Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fluorouracil-resistant advanced colorectal cancer (PICCOLO): A prospectively stratified randomised trial. Lancet Oncol 2013; 14: 749-59.
22. Peeters M et al. Final results from a randomized phase 3 study of FOLFIRI +/- panitumumab for second-line treatment of metastatic colorectal cancer. Ann Oncol 2014; 25: 107-16.
23. Brule SY et al. Location of colon cancer (right-sided versus left-sided) as a prognostic factor and a predictor of benefit from cetuximab in NCIC CO.17. Eur J Cancer 2015; 51: 1405-14.
24. Mayer RJ et al. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015; 372: 1909-19.
25. Grothey A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): An international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 303-12.
26. Innocenti F et al. Somatic DNA mutations, MSI status, mutational load (ML): Association with overall survival (OS) in patients (pts) with metastatic colorectal cancer (mCRC) of CALGB/SWOG 80405 (Alliance). J Clin Oncol 2017; 35 (Suppl 15): ASCO 2017, Abstract #3504.
27. Andre T et al. Analysis of tumor PD-L1 expression and biomarkers in relation to clinical activity in patients (pts) with deficient DNA mismatch repair (dMMR)/high microsatellite instability (MSI-H) metastatic colorectal cancer (mCRC) treated with nivolumab (NIVO) plus ipilimumab (IPI): CheckMate 142. Ann Oncol 2017; 28 (Suppl 5): 163 (ESMO 2017, Abstract #484PD).
28. Diaz LA et al. Pembrolizumab therapy for microsatellite instability high (MSI-H) colorectal cancer (CRC) and non-CRC. J Clin Oncol 2017; 35 (Suppl 15): ASCO 2017, Abstract #3071.
29. Barras D et al. BRAF V600E mutant colorectal cancer subtypes based on gene expression. Clin Cancer Res 2017; 23: 104-15.Cremolini C et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: Updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015; 16: 1306-15.
30. Pietrantonio F et al. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: A meta-analysis. Eur J Cancer 2015; 51: 587-94.
31. Cremolini C et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015; 16: 1306-15.
32. Kopetz S et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in BRAF-mutant metastatic colorectal cancer (SWOG 1406). J Clin Oncol 2017; 35 (Suppl 4): ASCO-GI 2017, Abstract #520.
33. Huijberts S et al. BEACON CRC: Safety lead-in (SLI) for the combination of binimetinib (BINI), encorafenib (ENCO), and cetuximab (CTX) in patients (pts) with BRAF-V600E metastatic colorectal cancer (mCRC). Ann Oncol 2017; 28 (Suppl 5): 175 (ESMO 2017, Abstract #517P).
34. Sartore-Bianchi A et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): A proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17: 738-46.
35. Hurwitz H et al. Pertuzumab + trastuzumab for HER2-amplified/overexpressed metastatic colorectal cancer (mCRC): Interim data from MyPathway. J Clin Oncol 2017; 35 (Suppl 4): ASCO-GI 2017, Abstract #676.

