Bei den Lymphomen ist die Aufbruchsstimmung ungebrochen
ASCO (Chicago), ICML (Lugano), EHA (Madrid) 2017
Für Lymphom-Spezialisten ist der Juni alle zwei Jahre besonders ergiebig: Neben dem ASCO-Kongress, bei dem zunehmend auch die hämatologische Onkologie im Fokus steht, und dem EHA-Kongress, dieses Jahr in Madrid, findet im neuerdings zweijährigen Turnus die International Conference on Malignant Lymphomas (ICML) in Lugano – 2017 zum 14. Mal – statt. Die Aufbruchsstimmung der vergangenen Jahre ist in der Hämatologie insgesamt und speziell bei den Lymphomen ungebrochen und äußerte sich sowohl in konsolidierenden Daten zu bereits zugelassenen als auch in zahllosen Studien zu neuen Medikamenten. Wir können hier nur versuchen, einige Ausschnitte aus dem großen Spektrum an Neuigkeiten zu beleuchten.
Hodgkin-Lymphom
Dass das Hodgkin-Lymphom sich in den letzten 30 Jahren von einer lebensbedrohlichen zu einer in mehr als 80% der Fälle heilbaren Erkrankung entwickelt hat, gehört zu den größten Erfolgsgeschichten der Medizin. Dennoch gibt es auch hier Optimierungsmöglichkeiten: Zum einen sind die herkömmlichen Chemotherapien, insbesondere für fortgeschrittene Stadien, ausgesprochen toxisch und damit bei älteren Patienten oft nicht durchführbar und bei Jüngeren mit Langzeit-Toxizitäten assoziiert, die die Lebensqualität stark beeinträchtigen können. Zum anderen treten bei manchen Patienten unter diesen Protokollen Rezidive auf, die dann deutlich schwieriger zu behandeln sind.
Neues zur Therapie mit Anti-CD30-Immunkonjugat …
Die erste „moderne“ Therapie, die seit einigen Jahren zur Behandlung „problematischer“ Patienten verfügbar ist, ist das Immunkonjugat Brentuximab Vedotin (BV), das mithilfe eines gegen das CD30-Antigen auf den Hodgkin-Zellen gerichteten Antikörpers das hochtoxische Zytostatikum Monomethyl Auristatin E gezielt an diese Zellen heranbringt. Es ist bisher zugelassen zur Behandlung erwachsener Patienten mit rezidiviertem oder refraktärem Hodgkin-Lymphom nach einer autologen Stammzelltransplantation oder wenn diese nach mindestens zwei vorangegangenen Therapien nicht infrage kommt sowie als Konsolidierungstherapie nach Transplantation bei Patienten mit einem erhöhten Rezidiv- oder Progressionsrisiko. Allerdings drängt die exzellente Wirksamkeit der Checkpoint-Inhibitoren diese recht neue Therapieform zunehmend in den klinischen Hintergrund. Zu diesen und auch zu bisher noch nicht zugelassenen Indikationen wurden vor allem in Lugano in einer eigenen Sitzung eine Reihe von Studienergebnissen präsentiert.
• In der britischen Phase-II-Studie BREVITY wurde eine Monotherapie mit BV bei Patienten mit neu diagnostiziertem Hodgkin-Lymphom, die für eine Standardchemotherapie nicht geeignet waren, als Erstlinienbehandlung getestet [1]. Primärer Endpunkt war die Rate an kompletten metabolischen Remissionen (d. h. ein Deauville-Score von 1–3 in der Positronenemissions-/Computertomografie [PET/CT] nach vier Zyklen), die 40% erreichen sollte. In der Realität waren es dann aber bei insgesamt 31 auswertbaren Patienten nur 26%, so Adam Gibb, Manchester – bei einer Gesamtansprechrate von 84% –, und die progressionsfreie Überlebenszeit war mit median 7,4 Monaten auch nicht sehr lange; für die acht Patienten, die eine komplette metabolische Remission erreichten, lag sie bei 11,9 Monaten. Die Toxizität war höher als bei der jüngeren und fitteren Klientel der Zulassungsstudie und führte bei einigen Patienten zum Therapieabbruch. Geplant sind nun Studien, so Gibb, in denen zum einen die Dosis von BV reduziert und die Substanz zum anderen in Kombinationen, zum Beispiel mit Checkpoint-Inhibitoren, gegeben werden soll.
• Eine mehr konventionelle Option für fitte Patienten, die in einer US-amerikanischen Phase-II-Studie getestet wurde, ist die Gabe von BV als Konsolidierung nach einer herkömmlichen Chemotherapie [2]. Die Kollegen um Steven Park, Charlotte, behandelten 41 Patienten (median 29 Jahre) mit frühem Hodgkin-Lymphom ohne Bulk mit einer ABVD-Chemotherapie (Doxorubicin, Bleomycin, Vinblastin, Dacarbazin), deren Länge vom PET-Ergebnis nach dem zweiten Zyklus abhängig gemacht wurde. Ab Woche 6 nach der Induktionstherapie bekamen die Patienten sechs Zyklen BV. Das Ziel, danach eine PET-Negativität bei mehr als 85% der Patienten zu erreichen und ihnen damit eine Strahlentherapie-Konsolidierung zu ersparen, wurde erreicht: 72,5% der Patienten waren bereits nach zwei Zyklen ABVD PET-negativ, und nach der Behandlung mit dem Immunkonjugat waren es 37 von 39 auswertbaren Patienten (94,9%). Sie alle erwiesen sich noch nach zwei Jahren als progressionsfrei und mussten nicht bestrahlt werden. Die 2-Jahres-Gesamtraten für progressionsfreies und Gesamtüberleben lagen nach median 22 Monaten Follow-up bei 92% bzw. 97%.
• In einer retrospektiven britischen Studie wurden die Daten von
99 Hodgkin-Patienten analysiert, die im rezidivierten oder refraktären Zustand nach mindestens zwei Chemotherapien BV erhalten hatten, um sie in eine bis dahin nicht erreichte tiefe, dauerhafte Remission zu bringen und so für eine potenziell kurative Stammzelltransplantation zu qualifizieren [3]. Die Ansprechrate, die nach BV erzielt wurde, lag bei 56% mit 29% kompletten Remissionen, so Toby Eyre, Oxford. 34% der Patienten konnten ohne weitere Therapie transplantiert werden, 27% benötigten dazu weitere Behandlungen, bei den restlichen 39% gelang ein Bridging zur Transplantation nicht. Während das progressionsfreie Überleben der Patienten, die keine Remission erzielten, nur median drei Monate betrug, ist der Medianwert bei den transplantierten Patienten (egal ob autolog oder allogen) noch nicht erreicht. In einer multivariaten Analyse war es vom Performancestatus und Hämoglobinwert beim ersten Rezidiv abhängig.
• Fallberichten zufolge könnte das Immunkonjugat auch als Salvagetherapie bei einem Rezidiv nach allogener Stammzelltransplantation wirken. Um das zu überprüfen, analysierten Ali Bazarbachi, Beirut, und Kollegen von der Lymphoma Working Party im Register der EBMT 184 solche Patienten, die überwiegend stark vorbehandelt (im Median vier Vortherapien) und zwischen 2010 und 2014 allogen transplantiert worden und im Median sieben Monate später wieder rezidiviert oder progredient gewesen waren [4]. 100 Patienten hatten BV bereits vor der Transplantation erhalten, und 80 wurden nach dem Versagen des Allografts mit median sechs Dosen davon behandelt. Von 62 auswertbaren Patienten erzielten 27% eine komplette und 42% eine partielle Remission, weitere 24% erreichten zumindest eine Krankheitsstabilisierung. Die Wirksamkeit von BV war unabhängig davon, ob die Patienten es bereits prae transplantationem erhalten hatten. In einer multivariaten Analyse hatte die Salvagetherapie mit BV keinen Einfluss auf die Entwicklung einer chronischen Graft-versus-Host-Reaktion, aber auch nicht auf das Gesamtüberleben der Patienten. Lediglich ein Alter von unter 40 Jahren und ein Karnofsky-Score von mindestens 90% wirkten sich günstig auf das Überleben aus. Bazarbachi hält es allerdings für möglich, dass das Immuntoxin synergistisch mit anderen Immuntherapien wie einer Donor-Lymphozyten-Infusion oder der Gabe von Immun-Checkpoint-Inhibitoren wirken könnte, um in dieser Situation eine anhaltende Kontrolle der Hodgkin-Erkrankung zu erreichen.
… zu Immuntherapien …
Checkpoint-Inhibitoren sind die zweite neue Therapieform, die mittlerweile beim Hodgkin-Lymphom zur Verfügung steht und aufgrund der besonderen Biologie des Hodgkin-Lymphoms exzellente Ergebnisse zeigt. Zugelassen sind bislang die beiden PD-1-Antikörper Nivolumab und Pembrolizumab für Patienten mit rezidivierter oder refraktärer Erkrankung nach Versagen von autologer Stammzelltransplantation und Brentuximab Vedotin, Pembrolizumab zusätzlich für Patienten nach Brentuximab Vedotin, die für eine Transplantation nicht infrage kommen.
• Zur Zulassung von Nivolumab führte die CheckMate-205-Studie, zu der Michelle Fanale, Houston, in Lugano und Andreas Engert, Köln, in Madrid die endgültige Analyse nach median 16 bis 23 Monaten Follow-up für die einzelnen Kohorten präsentierten [5, 6]. Unabhängig von der Vorbehandlung mit BV (gar nicht oder vor und/oder nach autologer Stammzelltransplantation) sprachen etwa zwei Drittel der Patienten auf den PD-1-Inhibitor an, wobei die BV-naiven Patienten mit 29% mehr als doppelt so häufig eine Komplettremission erzielten wie die vorbehandelten. Für Patienten mit Komplettremission war das progressionsfreie Überleben mit median mindestens 17 Monaten etwas länger als für diejenigen mit partieller Remission (≥ 15 Monate) und fast doppelt so lang wie für diejenigen mit lediglich einer Krankheitsstabilisierung (≥ 9 Monate). Der Medianwert war beim Gesamtüberleben noch nicht erreicht.
• Die Zulassung von Pembrolizumab basiert auf der KEYNOTE-087-Studie, in der 210 Patienten mit rezidiviertem oder refraktärem Hodgkin-Lymphom behandelt worden waren. Pier Luigi Zinzani, Bologna, präsentierte in Lugano eine Subgruppenanalyse derjenigen 73 Patienten, die an einer primär refraktären Erkrankung gelitten hatten und deshalb unter den klassischen Therapien eine deutlich schlechtere Prognose gehabt hätten [7]. Unter der Behandlung mit Pembrolizumab zeigten sie eine Ansprechrate von 79,5% mit 23,3% Komplettremissionen. Die Remissionen waren nach median 2,8 Monaten erzielt worden und ihre mediane Dauer war nach median zehnmonatigem Follow-up noch nicht erreicht. Nach sechs Monaten lagen die Raten für progressionsfreies und Gesamtüberleben bei 79,6% bzw. 100%; 30 der Patienten hatten die Therapie beendet, in erster Linie wegen einer Progression oder auf Empfehlung des behandelnden Arztes. Für diese primär therapierefraktären Patienten, für die dringend neue Therapien benötigt werden, ist Pembrolizumab also eine neue Option mit einer Wirkung, die der bei nicht refraktären Patienten entspricht.
… und zur Kombination beider Ansätze
Die Annahme, dass Brentuximab Vedotin und ein Checkpoint-Inhibitor in Kombination eventuell Synergien entwickeln könnten, scheint durch zwei weitere in Lugano vorgestellte Studien bestätigt zu werden, in denen das Immuntoxin mit Nivolumab kombiniert wurde – entsprechend der Vorstellung, dass die Zerstörung von Tumorzellen durch das Immuntoxin zur Aktivierung von Immunzellen im Microenvironment der Hodgkin-Zellen führen könnte:
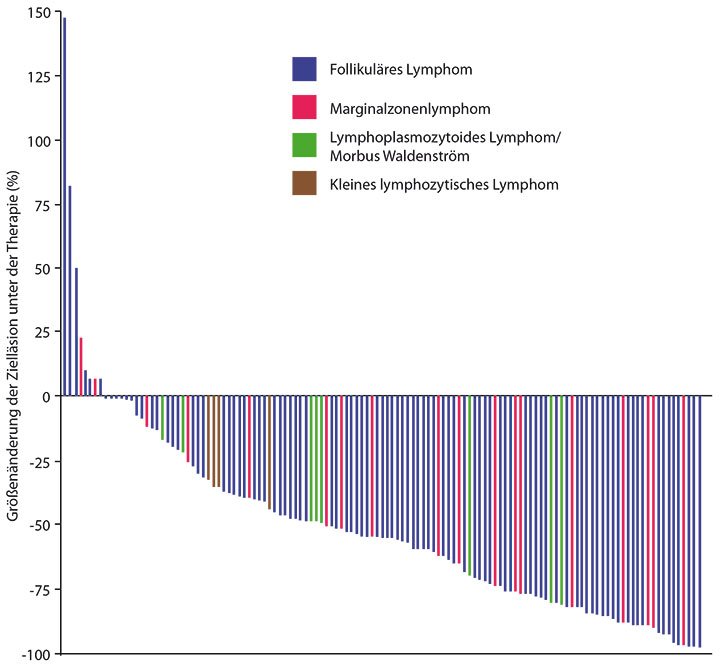
• Die US-amerikanische ECOG-ACRIN-Studiengruppe hat in einer Phase-I-Studie bisher 19 stark vorbehandelte Patienten mit rezidiviertem oder refraktärem Hodgkin-Lymphom mit 3 mg/kg Nivolumab alle drei Wochen und steigenden Dosierungen von BV behandelt und damit eine beachtenswerte Ansprechrate von 89% mit 61% Komplettremissionen erzielt, so Catherine Diefenbach, New York
(Abb. 1; [8]). Zwei der kompletten und eine partielle Remission betrafen Patienten, die früher bereits BV erhalten hatten. Nachdem der Proof-of-Concept damit erbracht ist, soll die Studie weiter rekrutieren mit Kohorten, in denen die Dreierkombination aus BV, Nivolumab und Ipilimumab getestet wird. Die Zweierkombination war nämlich allgemein gut verträglich; lediglich bei zwei Patienten kam es zu einer Pneumonitis.
• In einer weiteren amerikanischen Phase-I/II-Studie wurden Patienten, die nach einer Erstlinientherapie progedient waren, mit der Kombination behandelt [9]. Die objektive Ansprechrate der bisher 61 auswertbaren Patienten lag bei 85% mit 64% Komplettremissionen und nur 5% Progressionen. Bisher
37 Patienten konnten sich anschließend einer autologen Stammzelltransplantation unterziehen, nach der es zu keinen ungewöhnlichen Toxizitäten kam, so Alex Herrera, Duarte. Neben Infusionsreaktionen zeigten 72% der Patienten immunologische Nebenwirkungen, die aber nur sehr selten vom Grad 3 oder gar 4 waren. Die Ergebnisse mit diesem gut verträglichen Chemotherapie-freien Regime, so die Schlussfolgerung aus beiden Studien, rechtfertigen in jedem Fall die fortgesetzte Erprobung in weiteren Studien. Bereits rekrutiert werden Patienten mit rezidiviertem/refraktärem Hodgkin-Lymphom oder solche, die nicht für eine autologe Transplantation geeignet sind, für die Phase-III-Studie CheckMate-812, in der die Kombination randomisiert mit einer BV-Monotherapie verglichen wird [10].
Non-Hodgkin-Lymphome
Indolente NHL
Bei den Non-Hodgkin-Lymphomen (NHL) sind Immunchemotherapien mit dem CD20-Antikörper Rituximab seit Langem der Standard, wobei in den letzten Jahren Bendamustin als Chemotherapie-Komponente den älteren Kombinationen (CHOP, CVP) den Rang abzulaufen schien. Aktualisierte Auswertungen der BRIGHT-Studie (nach fünf Jahren) und der deutschen StiL-NHL1-Studie (nach neun Jahren), die beim ASCO-Kongress von Ian Flinn, Nashville [11], und Mathias Rummel, Gießen [12], vorgestellt wurden, zeigen, dass Rituximab-Bendamustin weiterhin den konventionelleren Regimes zwar nicht beim Gesamtüberleben, wohl aber bei progressionsfreiem Überleben, der Dauer des Ansprechens und der Zeit bis zur nächsten Therapie signifikant überlegen ist.
Als Caveat hinzuzufügen wäre, dass in einer Analyse der GALLIUM-Studie, die Wolfgang Hiddemann, München, in Lugano vorstellte [13], in den Subgruppen, die Bendamustin als Chemotherapie-Backbone erhalten hatten, eine prolongierte T-Zell-Depletion auftrat und in der Folge während der Erhaltungstherapie-Phase die Raten an Infektionen vom Grad 3–5 etwa doppelt so hoch waren wie unter den beiden anderen Chemotherapien. Der nicht-randomisierte Vergleich wird allerdings wieder dadurch relativiert, dass in der Bendamustin-Gruppe zu Beginn mehr Komorbiditäten vorgelegen hatten und dass hier etwa dreimal weniger Patienten eine G-CSF-Prophylaxe erhalten hatten als in der CHOP-Gruppe.
Der Trend auch hier: Chemotherapie-freie Protokolle
Auch bei den Non-Hodgkin-Lymphomen geht der Trend derzeit aber eindeutig in Richtung eines Ersatzes der Chemotherapie durch eines oder mehrere der neuen, zielgerichteten Medikamente. Aus der Fülle von derzeit laufenden Studien (meist in frühen Phasen) sollen hier nur einige erwähnt werden, die bei den jüngsten Kongressen vorgestellt wurden:
• Der Immunmodulator Lenalidomid ist bisher als Monotherapie zur Behandlung des rezidivierten oder refraktären Mantelzell-Lymphoms zugelassen. In mehreren Studien wird es derzeit in Kombination mit Rituximab („R2“) bei indolenten NHL erprobt, so zum Beispiel in der US-amerikanischen Phase-III-Studie MAGNIFY bei rezidivierten oder refraktären indolenten Lymphomen (follikuläres, Marginalzonen- und Mantelzell-Lymphom). Eine Auswertung der 27 Patienten mit Marginalzonen-Lymphomen (13 nodale, acht splenische und sechs MALT-Lymphome), die Morton Coleman, New York, in Lugano vorstellen konnte, zeigte auch hier eine gute Wirksamkeit mit bisher 55% Remissionen, davon 45% komplett [14]. Aus einer weiteren Auswertung berichtete David Jacob Andorsky, Boulder [15], dass von den Patienten mit follikulären Lymphomen diejenigen mit doppelt-refraktärer Erkrankung (gegen Rituximab und ein Alkylans) insgesamt ähnlich gut ansprechen (46%) wie die, die nach einem frühen Rezidiv innerhalb von zwei Jahren nach der ersten Diagnose die Therapie halten hatten (48%), beide allerdings schlechter als die gesamte Kohorte mit follikulärem Lymphom (67%). Die Rekrutierung in MAGNIFY wird derzeit fortgesetzt.
• In einer Phase-II-Studie der CALGB erwies sich das Regime bei
65 Patienten mit zuvor unbehandeltem follikulärem Lymphom der Stadien III und IV [16] nach zwölf vierwöchigen Zyklen Lenalidomid und acht Dosen Rituximab mit 95% Ansprechrate und 72% Komplettremissionen als hochaktiv. Nach fünf Jahren sind 70% aller Patienten progressionsfrei am Leben, verstorben ist bislang keiner, so Peter Martin, New York. Weder die konventionellen Prognosefaktoren wie FLIPI-Score noch molekulare Kenngrößen wie zum Beispiel Polymorphismen von Fcγ-Rezeptoren oder Angiogenese-Marker zeigten irgendeine Assoziation mit dem Ansprechen oder dem progressionsfreien Überleben.
• Der Frage, ob der glykomodifizierte Typ-II-CD20-Antikörper Obinutuzumab (GA101), in Kombination mit Lenalidomid (GALEN-Regime) die Wirksamkeit von R2 noch übertreffen könnte, ging eine französisch-belgische Phase-II-Studie nach [17].
89 Patienten mit follikulärem Lymphom, die zuvor mindestens eine Rituximab-haltige Therapie bekommen hatten, erhielten Frank Morschhauser, Lille, zufolge zunächst eine Induktionstherapie mit sechs vierwöchigen Zyklen einer Kombination aus beiden Medikamenten und anschließend eine knapp zweijährige Erhaltungstherapie. Beim primären Endpunkt Gesamtansprechen erwies sich dieses Protokoll als ausgesprochen wirksam (Tab. 1):
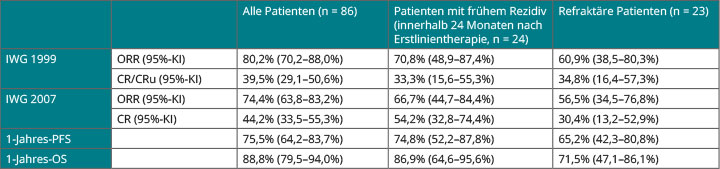
Selbst Patienten, die gegenüber Rituximab oder der zuletzt erhaltenen Therapie refraktär gewesen waren, erreichten hier einen Wert von 60,9% nach den IWG-Kriterien von 1999 bzw. von 56,5% nach denen von 2007 und waren zu zwei Drittel nach einem Jahr noch progressionsfrei am Leben. An Grad-3/4-Nebenwirkungen trat vor allem eine Neutropenie (28,4%) auf, sodass diese Kombination nach Morschhausers Worten in der rezidivierten und refraktären Situation als hocheffektiv bezeichnet werden kann: Sie dürfte dem R2-Regime aus der MAGNIFY-Studie überlegen sein, ohne dass unerwartete Toxizitäten aufgetreten wären.
Erste Versuche mit neuen Substanzen
Zu ganz neuen, noch nicht zugelassenen Medikamenten wurden in Lugano und Madrid eine Vielzahl von Studien vor allem der Phase I vorgestellt, die hier nicht alle aufgeführt werden können. Neben Zweitgenerations-Inhibitoren, etwa der Phosphatidylinositol-3-Kinase (PI3K) wie Buparlisib [18], Umbralisib [19], Duvelisib [20] und Copanlisib [21, 22] geht es auch um völlig neue Wirkmechanismen wie die Hemmung etwa von Cereblon durch die Substanz C-122 [23, 24] oder der Histon-Methyltransferase EZH2 durch Tazemetostat. Eine Phase-II-Studie zu letzterem Medikament stellte Frank Morschhauser in der Plenarsitzung vor [25]: Das Enzym EZH2 ermöglicht es Tumorzellen offenbar, einen undifferenzierten Zustand aufrechtzuerhalten, und aktivierende Mutationen im EZH2-Gen scheinen onkogene Treibermutationen zu sein. In die Studie wurden Patienten mit rezidiviertem oder refraktärem follikulärem oder diffus-großzelligem B-Zell-Lymphom (DLBCL) eingeschlossen. Die ersten vorläufigen Auswertungen zeigen Morschhauser zufolge, dass offenbar in erster Linie follikuläre Lymphome mit mutiertem EZH2 sehr gut ansprechen (zwölf von 13 Patienten [92%] mit einer Komplettremission [8%]).Beim DLBCL lag die Ansprechrate insgesamt bei Patienten mit mutiertem EZH2 nur bei 29%, aber bei beiden Subtypen wurden späte Remissionen und Konversionen von partiellem zu komplettem Ansprechen beobachtet, sodass man die weitere Entwicklung in der Studie, die noch immer rekrutiert, abwarten muss.
Immuntherapien bei indolenten NHL
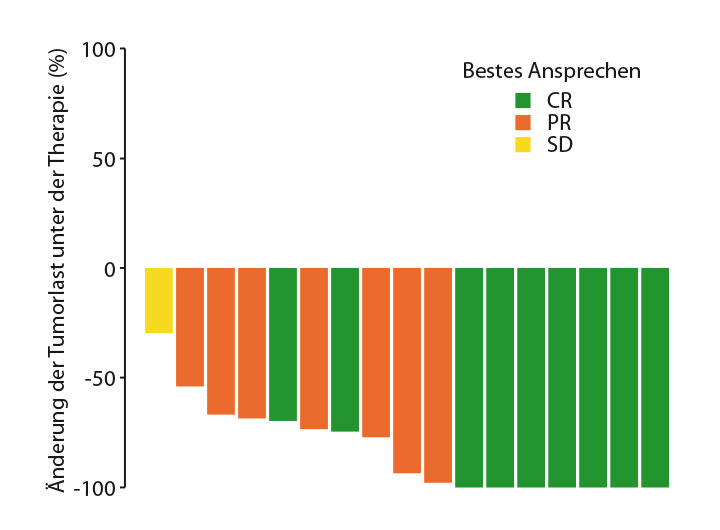
Auch beim follikulären Lymphom sind Immuntherapien vielversprechend: In einer Phase-II-Studie konnte die Kombination aus Pembrolizumab und Rituximab in der rezidivierten Situation bei 20 auswertbaren Patienten eine Ansprechrate von 65% bei 50% Komplettremissionen erzielen (Abb. 2) – bei einem sehr akzeptablen Toxizitätsprofil [26]. Derzeit wird die Erweiterung des Studienkonzepts um Patienten mit refraktären Erkrankungen geplant, so Loretta Nastoupil, Houston.
Bei rezidivierten oder refraktären Lymphom-Patienten mit verschiedenen Histologien wurde in einer Phase-Ib-Studie die Kombination aus dem CD20-Antikörper Obinutuzumab und dem PD-L1-Antikörper Atezolizumab getestet [27]. Interessanterweise, so Lia Palomba, New York, zeigte sich zum Beispiel bei follikulären Lymphomen unter dem im ersten Zyklus alleine gegebenen Obinutuzumab ein Anstieg der Infiltration mit CD8-positiven T-Lymphozyten bei fünf von sechs Patienten. Alle diese fünf Patienten sprachen dann auf die Behandlung mit der Kombination an. Die Gesamtremissionsrate war beim follikulären Lymphom mit 57% erheblich höher als beim DLBCL mit nur 16%. Biomarker-Analysen zufolge ist das immunologische Infiltrat offenbar beim follikulären Lymphom „entzündlicher“ und kann auch durch die Therapie beeinflusst werden.
Aggressive NHL
Die Strahlenbelastung reduzieren
Die Bestrahlung größerer Krankheitsherde (bulky disease) verbessert die Prognose älterer Patienten mit DLBCL, wie wir in der Deutschen Studiengruppe für Hochmaligne Non-Hodgkin-Lymphome (DSHNHL) in der RICOVER-60-Studie zeigen konnten [28, 29]. Da eine Radiotherapie mit Nebenwirkungen behaftet ist, stellte sich allerdings die Frage, ob man sie Patienten ersparen kann, deren Bulk nach der Immunchemotherapie im PET keine Aktivität mehr zeigt. Diese Fragestellung untersuchen wir derzeit prospektiv in der OPTIMAL>60-Studie. Um ein mögliches Risiko für die PET-negativen Patienten durch das Weglassen der Bestrahlung zu minimieren, wurde eine Interimsanalyse geplant, deren Ergebnisse Michael Pfreundschuh, Homburg/Saar, beim ASCO-Kongress und beim ICML vorstellen konnte [30, 31].
Das komplexe Design der OPTIMAL>60-Studie umfasst mehrere Randomisierungen: Zum einen erhalten die 61- bis 80-jährigen Patienten mit neu diagnostiziertem DLBCL vier bis sechs Zyklen von entweder CHOP (Cyclophosphamid, Doxorubicin, Vincristin, Prednison) oder CHLIP (wie CHOP, aber mit Ersatz von konventionellem durch liposomales Vincristin) und dazu jeweils Rituximab mit entweder acht Dosen oder in einem pharmakokinetisch optimierten Schema von zwölf Dosen. Patienten mit Lymphknoten von mindestens 7,5 cm Durchmesser, die nach der Immunchemotherapie noch PET-positiv sind, werden mit 39,6 Gy bestrahlt, PET-negative Patienten nur beobachtet.
In der Interimsanalyse, so Pfreundschuh, wurden zum einen die 187 von
505 Patienten mit PET-positivem Bulk (37%) mit den 117 von 306 entsprechenden Patienten aus der RICOVER-60-Studie (38%) verglichen. Von 80 OPTIMAL>60-Patienten, deren Bulk nach der Chemoimmuntherapie PET-positiv geblieben war, wurden 62 (78%) bestrahlt – das waren 33% der 187 Patienten mit ursprünglichem Bulk. In der
RICOVER-60-Studie hatten hingegen 57% dieser Patienten eine Radiotherapie bekommen. Trotz der etwas ungünstigeren Demografie der OPTIMAL>60-Patienten (etwas höheres Durchschnittsalter, mehr Patienten mit IPI 3 bzw. 4/5) war die Prognose nicht schlechter als in
RICOVER-60: Nach zwei Jahren lag das progressionsfreie Überleben in der gesamten Bulk-positiven Gruppe in
OPTIMAL>60 bei 79%, das Gesamtüberleben bei 88%, in der entsprechenden RICOVER-60-Population waren es 75% und 78% gewesen. In einer multivariaten Analyse, die vor allem die IPI-Risikofaktoren berücksichtigte, lagen die Hazard Ratios zugunsten des OPTIMAL>60-Protokolls bei 0,7 für das progressionsfreie und bei 0,5 für das Gesamtüberleben; aufgrund der relativ niedrigen Patientenzahlen fielen diese Unterschiede nicht signifikant aus.
Bei älteren Patienten mit DLBCL, deren Bulk nach der Immunchemotherapie PET-negativ geworden ist, wird man künftig also guten Gewissens auf die Strahlentherapie verzichten können, ohne ihre Prognose zu beeinträchtigen. Immerhin kann man so 42% der Patienten mit anfänglichem Bulk die Strahlenbelastung ersparen.
Neuer CD19-Antikörper mit hoher Wirksamkeit
Das CD19-Antigen hat sich in den letzten Jahren vom Biomarker für
B-Lymphozyten zum Zielmolekül für Therapien gegen von B-Zellen abgeleitete lymphatische Neoplasien gewandelt. Neben CAR-T-Zellen (s. u.) und bispezifischen Antikörpern wird derzeit ein neuartiger monokloner Antikörper entwickelt, bei dem durch Modifikationen der Aminosäuresequenz in der Fc-Domäne direkte Zytotoxizität sowie Antigen-abhängige Zytotoxizität und Antigen-Präsentation verstärkt sind. In präklinischen und frühen klinischen Studien konnte eine synergistische Wirkung von MOR208 mit dem Immunmodulator Lenalidomid gezeigt werden, und in der noch rekrutierenden Phase-II-Studie
L-MIND hatte sich bei bislang 34 auswertbaren Patienten mit rezidiviertem oder refraktärem DLBCL für die Kombination eine objektive Ansprechrate von 56% mit 32% Komplettremissionen ergeben, wie Giles Salles, Lyon, in Lugano [32] und Kami Maddocks, Columbus, beim EHA-Kongress [33] berichteten. Die mediane Zeit bis zum Ansprechen betrug 1,8 Monate (bis zur Komplettremission 3,4 Monate), und 16 von 19 Remissionen (zehn von elf Komplettremissionen) dauern noch an. Grad-3/4-Toxizitäten waren überwiegend hämatologischer Natur; Infusionsreaktionen traten überhaupt nicht auf, und die Lenalidomid-Dosis (25 mg/d für drei Wochen eines vierwöchigen Zyklus) musste lediglich bei 27% der Patienten reduziert werden (bei 20% auf 20 mg/d). Seit Kurzen rekrutiert auch in Deutschland die internationale Phase-II/III-Studie B-MIND, in der MOR208 bei Patienten mit rezidiviertem oder refraktärem DLBCL in Kombination mit Bendamustin randomisiert gegen Bendamustin-Rituximab getestet werden soll [34, 35].
Mantelzell-Lymphom
Überlebensvorteil für Rituximab-Erhaltung bestätigt
Das Mantelzell-Lymphom liegt, was seinen natürlichen Verlauf angeht, etwa in der Mitte zwischen follikulärem Lymphom und DLBCL: Es gibt sehr indolente, aber auch äußerst aggressive Verläufe, aber im Gegensatz zum DLBCL ist das Mantelzell-Lymphom derzeit grundsätzlich nicht heilbar. Mit einer Induktions-Immunchemotherapie und einer nachfolgenden autologen Stammzelltransplantation lassen sich bei jüngeren Patienten zwar zunächst hohe Komplettremissionsraten erzielen, aber früher oder später stellen sich regelhaft Rezidive ein, die dann meist eine deutlich schlechtere Prognose haben. Die französischen Lymphom-Studiengruppen LYSA und GOELAMS untersuchten deshalb in einer Phase-III-Studie, ob eine Erhaltungstherapie mit Rituximab nach der Transplantation sich hier günstig auswirken könnte.
In die Studie wurden 299 Patienten aufgenommen und sofort in einen Erhaltungs- und einen Beobachtungsarm randomisiert. Nach vier Zyklen einer Therapie mit Rituximab und DHAP (Dexamethason, Cytarabin, ein Platinsalz) gab es eine Ansprechrate von 89,3%, davon 77,3% Komplettremissionen. Bei 257 Patienten konnte eine autologe Stammzelltransplantation durchgeführt werden, und 240 von ihnen wurden schließlich jeweils zur Hälfte mit Rituximab behandelt (375 mg/m2 alle zwei Monate für drei Jahre) oder nur beobachtet.
Was sich bereits in früheren Auswertungen angedeutet hatte, wurde durch die finale Analyse, die Steven Le Gouill, Nantes, in Madrid vorstellen konnte, bestätigt [36]. Median 50 Monate nach der Transplantation zeigten die 4-Jahres-Werte für alle Überlebensdaten eine signifikante Überlegenheit für die Erhaltungstherapie: ereignisfreies Überleben 78,9% versus 61,4% (p = 0,0012), progressionsfreies Überleben 82,2% versus 64,6% (p = 0,0005) und Gesamtüberleben 88,7% versus 81,4% (p = 0,0413). Die Hazard Ratio für Überleben betrug 0,5 (95%-Konfidenzintervall 0,255–0,986), d. h. das Sterberisiko war durch die Rituximab-Erhaltung halbiert worden. Vier Zyklen R-DHAP und eine autologe Stammzelltransplantation, gefolgt von drei Jahren Rituximab-Erhaltungstherapie sind damit als neuer Behandlungsstandard für jüngere Patienten mit Mantelzell-Lymphom anzusehen, so Le Gouill.
CAR-T-Zellen gegen CD19: Zulassungsstudien jetzt auch bei Lymphomen
Die Immuntherapie breitet sich zunehmend auf die gesamte Onkologie aus. Bisher nur in der Hämatologie werden T-Zellen mit chimären Antigenen (CAR-T-Zellen) erprobt: Bei der akuten lymphatischen Leukämie (ALL), wo sie erstmal getestet wurden, laufen bereits Zulassungsstudien, aber mittlerweile wird der Ansatz auch bei aggressiven Non-Hodgkin-Lymphomen intensiv untersucht. Bei der ICML in Lugano wurden vier Studien mit verschiedenen CAR-T-Zellen gegen das CD19-Antigen vorgestellt, von denen zwei auch hier bereits auf eine Zulassung des entsprechenden Präparats zielen.
Vier US-amerikanische Zentren haben unabhängig voneinander gegen CD19 gerichtete CAR-T-Zellen erzeugt, die sich in Details des implantierten Antigen-Rezeptors unterscheiden und derzeit in Zusammenarbeit mit verschiedenen Herstellern für die Klinik entwickelt werden. In kleinen, meist monozentrischen Studien hat sich der Ansatz bei therapierefraktären aggressiven B-Zell-Non-Hodgkin-Lymphomen (NHL) mit ihrer ausgesprochen schlechten Prognose als sehr vielversprechend erwiesen. Die an der University of Pennsylvania in Philadelphia entwickelten CTL019-Zellen werden derzeit in der Phase-II-Zulassungsstudie JULIET bei Erwachsenen mit rezidiviertem oder refraktärem DLBCL getestet. In der einarmigen Studie soll in 27 Zentren auf vier Kontinenten (darunter auch drei deutsche Universitätskliniken) neben der Wirksamkeit der Zellen auch die komplexe Logistik validiert werden: Die dem Patienten entnommenen T-Zellen wurden in gefrorenem Zustand an eines von zwei zentralen Labors geschickt, dort mit dem zusätzlichen Gen für den Antigenrezeptor versehen und dann zurückgesandt, um dem Patienten wieder infundiert zu werden.
Die 141 eingeschlossenen Patienten mit median drei Vortherapien erhalten während der Produktion der Zellen gegebenenfalls eine Bridging-Therapie und vor der Infusion eine Lymphodepletion mit Fludarabin und Cyclophosphamid oder mit Bendamustin. Bisher 85 Patienten, von denen die Hälfte vorher bereits eine autologe Stammzelltransplantation erhalten hatte, bekamen median etwa 300 Millionen Zellen infundiert. Primärer Endpunkt war die beste Ansprechrate, die signifikant über den mit herkömmlichen Therapien erreichbaren 20% liegen sollte. Tatsächlich waren in der Interimsanalyse, die Stephen Schuster, Philadelphia, vorstellte [37], bei den 51 Patienten, die mindestens drei Monate lang nachbeobachtet worden sind, 59% Remissionen nachweisbar (p < 0,0001), darunter 43% Komplettremissionen. Alle nach drei Monaten registrierten Komplettremissionen dauerten auch zum Auswertungszeitpunkt noch an, und der Medianwert der Gesamtansprechdauer ist noch nicht erreicht. Die untersuchten Subgruppen unterschieden sich nicht bezüglich der Wirksamkeit der CAR-T-Zellen, und diese waren bei den Respondern bis zu ein Jahr nach der Infusion nachweisbar.
Zytokin-Release-Syndrom gut handhabbar
Die dramatischste Nebenwirkung bei dieser Art der Therapie ist ein Zytokin-Release-Syndrom, das mittlerweile in erfahrenen Händen gut gemanagt werden kann. In der JULIET-Studie wurde es bei 57% der bisher behandelten Patienten beobachtet und war in 17% der Fälle vom Grad 3 und in 9% vom Grad 4; es trat nach median drei Tagen auf, dauerte median sieben Tage an und führte in keinem Fall zum Tod. Es musste bei jedem vierten Patienten intensivmedizinisch behandelt werden, und 16% der Patienten erhielten den Interleukin-6-Antikörper Tocilizumab. 13% entwickelten neurologische Nebenwirkungen vom Grad 3 oder 4, die supportiv behandelt werden konnten und kein Hirnödem einschlossen. Drei Patienten verstarben binnen 30 Tagen nach Infusion der CAR-T-Zellen an ihrem Lymphom, die therapeutischen Zellen waren für keinen Todesfall verantwortlich.
NIH-Zellen ebenfalls sehr wirksam
In der rein US-amerikanischen Phase-I/II-Studie
ZUMA-1 erhielten von 111 eingeschlossenen Patienten mit refraktären aggressiven NHL bisher 101 ein weiteres, an den National Institutes of Health (NIH) entwickeltes CD19-CAR-T-Zell-Präparat (KTE-C19, Axicabtagene Ciloleucel = Axi-Cel). Neben 77 Patienten mit DLBCL enthielt die Kohorte auch 24 mit primär mediastinalen B-Zell- bzw. transformierten follikulären Lymphomen. Primärer Endpunkt war auch hier die objektive Ansprechrate, die bei 82% lag, so Sattva Neelapu, Houston, in einer aktualisierten Analyse der erstmals beim ASH-Kongress 2016 präsentierten Daten [38]. 54% der Patienten erreichten eine Komplettremission; diese Rate war bei allen eingeschlossenen Entitäten vergleichbar und etwa siebenmal höher als in historischen Kohorten (8%; p < 0,0001). Die mediane Remissionsdauer lag bei 8,2 Monaten; bei den Patienten mit Komplettremission war der Medianwert noch nicht erreicht, bei denen mit partieller Remission betrug er lediglich 1,9 Monate. Nach sechs Monaten waren noch 80% der Patienten am Leben.
Zytokin-Release-Syndrome und neurologische Nebenwirkungen vom Grad ≥ 3 wurden hier bei 13% bzw. 28% der Patienten beobachtet und waren mit Ausnahme einer Gedächtniseinschränkung vom Grad 1 alle reversibel. Patienten, die wegen eines Zytokin-Release-Syndroms Tocilizumab erhalten mussten, hatten mehr als doppelt so viele CAR-T-Zellen im Blut als die übrigen, und diese Konzentrationen korrelierten wiederum mit der Dauer der Remission. Mit diesen Zellen werden derzeit außerdem in Studien Patienten mit Mantelzell-Lymphom und mit CD19-positiver ALL behandelt.
Phase-I-Studien mit gemischten Resultaten
In Phase-I-Studien werden zurzeit zwei weitere CD19-CAR-T-Zell-Präparate getestet: In der multizentrischen Studie TRANSCEND NHL 001 wird ein Präparat bei bisher 67 Patienten mit rezidivierten oder refraktären aggressiven Lymphomen getestet, so Jeremy Abramson, Boston [39]. In verschiedenen Dosierungen wurde eine mittlere Ansprechrate von 76% bei 52% Komplettremissionen erzielt; in einer Subkohorte von Patienten mit DLBCL lagen die Werte mit 86% bzw. 59% noch etwas höher. Das Sicherheitsprofil ist hier so gut, dass sogar über eine ambulante Behandlung nachgedacht wird. Mit einem optimierten Protokoll soll die DLBCL-Kohorte noch in diesem Jahr in eine Zulassungsstudie überführt werden.
In einer monozentrischen Phase-I-Studie schließlich erhalten am Memorial Sloan Kettering Cancer Center in New York derzeit Patienten mit rezidiviertem oder refraktärem Hochrisiko-B-Zell-Lymphom nach autologer Stammzelltransplantation eine Konsolidierungstherapie mit einem weiteren CD19-CAR-T-Zell-Präparat [40]. Wie Craig Sauter, New York, berichtete, korrelierten die Zellzahlen im Körper der Patienten zwar mit der Toxizität; insgesamt war die Persistenz der Zellen aber relativ gering, was sich in einer progressionsfreien Überlebensrate von nur 30% nach zwei Jahren widerspiegelt. Das derzeitige Protokoll scheint zumindest in dieser Situation einer Konsolidierungstherapie nicht sehr effektiv zu sein, sodass man in New York derzeit an Modifikationen arbeitet.
Literatur
1. Gibb A et al. ICML 2017, Abstract #069.
2. Park SI et al. ICML 2017, Abstract #070.
3. Eyre TA et al. ICML 2017, Abstract #071.
4. Bazarbachi A et al. ICML 2017, Abstract #072.
5. Fanale M et al. ICML 2017, Abstract #125.
6. Engert A et al. EHA 2019, Abstract #S412.
7. Zinzani PL et al. ICML 2017, Abstract #126.
8. Diefenbach CS et al. ICML 2017, Abstract #073.
9. Herrera AF et al. ICML 2017, Abstract #075.
10. ClinicalTrials.gov No. NCT03138499.
11. Flinn I et al. ASCO 2017, Abstract #7500.
12. Rummel MJ et al. ASCO 2017, Abstract #7501.
13. Hiddemann W et al. ICML 2017, Abstract #107.
14. Coleman M et al. ICML 2017, Abstract #139.
15. Andorsky DJ et al. ASCO 2017, Abstract #7502.
16. Martin P et al. ICML 2017, Abstract #035.
17. Morschhauser F et al. ICML 2017, Abstract #037.
18. Batlevi CL et al. ICML 2017, Abstract #039.
19. Davids MS et al. ICML 2017, Abstract #040.
20. Zinzani PL et al. EHA 2017, Abstract #777.
21. Dreyling M et al. ICML 2017, Abstract #108.
22. Zinzani PL et al. EHA 2017, Abstract #776.
23. Michot JM et al. ICML 2017, Abstract #038.
24. Bouabdallah R et al. EHA 2017, Abstract #S467.
25. Morschhauser F et al. ICML 2017, Abstract #004.
26. Nastoupil LJ et al. ICML 2017, Abstract #109.
27. Palomba ML et al. ICML 2017, Abstract #127.
28. Pfreundschuh et al. Lancet Oncol 2008; 9: 105-16.
29. Held et al. J Clin Oncol 2014; 32: 1112-8.
30. Pfreundschuh M et al. ASCO 2017, Abstract #7506.
31. Pfreundschuh M et al. ICML 2017, Abstract #120.
32. Salles GA et al. ICML 2017, Abstract #036.
33. Maddocks K et al. EHA 2017, Abstract #S470.
34. Nowakowski GS et al. ASCO 2017, Abstract #TPS7571.
35. ClinicalTrials.gov No. NCT02763319.
36. Le Gouill S et al. EHA 2017, Abstract #S105.
37. Schuster S et al. ICML 2017, Abstract #007.
38. Neelapu S et al. ICML 2017, Abstract #008.
39. Abramson J et al. ICML 2017, Abstract #128.
40. Sauter C et al. ICML 2017, Abstract #129.

Josef Gulden
E-Mail an Josef Gulden

Prof. Dr. Lorenz Trümper
Klinik für Hämatologie und Medizinische Onkologie, Universitätsmedizin Göttingen
Präsident der German Lymphoma Alliance (GLA)
Robert-Koch-Str. 40, 37075 Göttingen
+49 551 39 663 27
+49 551 39 8695
+49 551 39 8587
E-Mail an Prof. Dr. Lorenz Trümper