Was gibt es Neues aus der Uro-Onkologie?
ASCO 2017, Chicago
Die Uro-Onkologen werden von der American Society of Clinical Oncology (ASCO) mit einem eigenen Kongress zu Beginn eines jeden Jahres verwöhnt, aber bis zum ASCO-Hauptkongress Anfang Juni haben sich in der Regel schon wieder genug Forschungsergebnisse angesammelt, um auch hier für eine starke Präsenz der urologischen Tumorentitäten zu sorgen. Das Prostatakarzinom schaffte es dieses Mal mit den Ergebnissen der LATITUDE-Studie sogar in die Plenarsitzung, bei Nieren- und Urotheltumoren war unverkennbar, dass zurzeit die Immuntherapien das Feld beherrschen: Ein Überblick über die wichtigsten Neuigkeiten.
Prostatakarzinom
Steroidsynthese-Hemmung früher einsetzen? Daten von STAMPEDE …
Die erste Therapielinie beim lokal fortgeschrittenen oder metastasierten Prostatakarzinom ist seit Jahrzehnten eine Androgendeprivationstherapie (ADT). Für Patienten mit kastrationsresistenten Tumoren (CRPC), die nicht mehr auf die ADT ansprechen, stehen seit einigen Jahren neue Hormontherapien zur Verfügung, die entweder die Synthese von Androgenen oder ihre Wechselwirkung mit ihrem Rezeptor inhibieren und das Überleben der Patienten erneut verlängern können. Die Frage, ob etwa Abirateronacetat, ein selektiver Inhibitor der Steroid-17α-Hydroxylase (CYP17A1), die an der Androgen- und Estrogen-Biosynthese beteiligt ist, bei einem früheren Einsatz größeren Nutzen bringen könnte, wurde in den letzten Jahren in den beiden großen Phase-III-Studien STAMPEDE und
LATITUDE untersucht. Beide wurden begonnen, bevor Docetaxel in die Primärtherapie von Patienten mit therapienaivem Prostatakarzinom und hoher Krankheitslast eingeführt wurde, und beide konnten beim diesjährigen ASCO-Kongress Überlebensdaten präsentieren:
Das STAMPEDE-Studienprogramm bearbeitet eine ganze Reihe von Fragestellungen im Zusammenhang mit der Primärtherapie des Prostatakarzinoms; ein Projekt vergleicht randomisiert eine Standard-ADT – bei Patienten ohne Fernmetastasen gegebenenfalls mit zusätzlicher Bestrahlung – alleine oder in Kombination mit täglich 1.000 mg Abirateron und 5 mg Prednisolon. Die Behandlung wurde bis zum Eintreten einer Progression (anhand der PSA-Konzentrationen, radiologisch oder klinisch) bzw. bei Patienten ohne Fernmetastasen, die bestrahlt worden waren, maximal zwei Jahre lang gegeben, so Nicholas James, Birmingham [1]. Als primärer Endpunkt war das Gesamtüberleben definiert, wobei für einen positiven Ausgang der Studie eine Reduktion des Mortalitätsrisikos um mindestens 25%, d. h. eine Hazard Ratio von höchstens 0,75 gefordert wurde.
Im Verlauf von etwas mehr als zwei Jahren konnten 1.917 Patienten in diese beiden Arme randomisiert werden. Nach einer medianen Nachbeobachtungszeit von 40 Monaten lag die Hazard Ratio für Tod bei 0,63 zugunsten des Abirateron-Arms (p = 0,00000115); nach drei Jahren hatte sich die Überlebensrate von 76% im Kontroll- auf 83% im Abirateron-Arm verbessert. Beim versagensfreien Überleben war der Vorteil der zusätzlichen hormonellen Therapie noch ausgeprägter, mit einer Hazard Ratio von 0,29
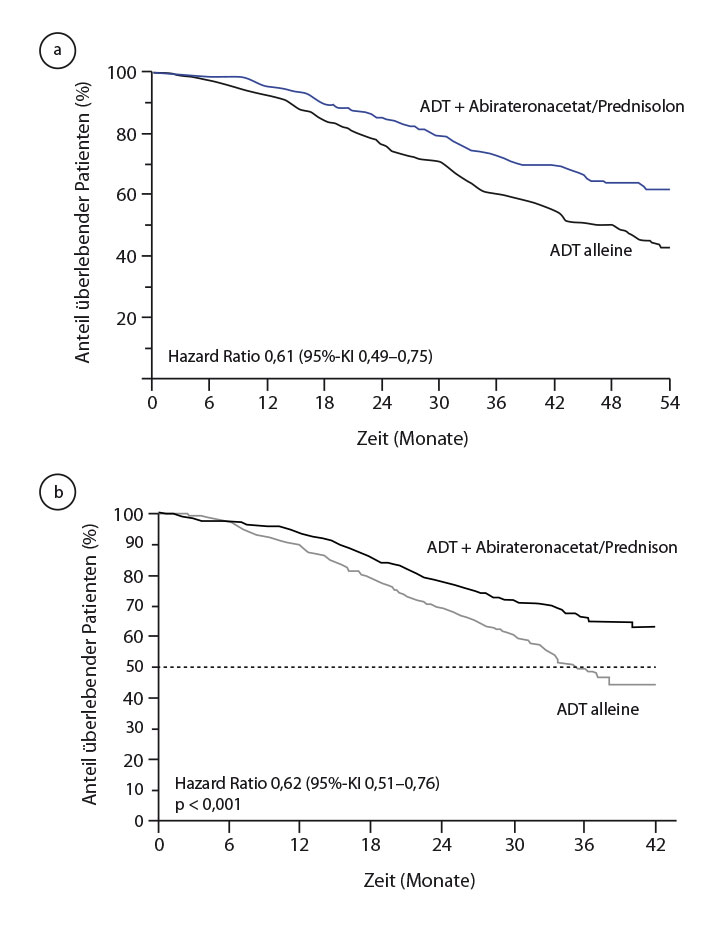
(p = 0,377 x 10-61). Bei den 1.002 Patienten mit metastasierter Erkrankung waren die Überlebensresultate mit einer Hazard Ratio von 0,61 ähnlich gut wie im Gesamtkollektiv (Abb. 1a), bei den Patienten mit M0-Status sind sie mit einer Hazard Ratio von 0,75 gerade grenzwertig positiv; hier muss die weitere Entwicklung abgewartet werden.
… und von LATITUDE
Die LATITUDE-Studie bearbeitete eine ähnliche Fragestellung: 1.199 Patienten mit neu diagnostiziertem und noch unbehandeltem metastasiertem Prostatakarzinom mit mindestens zwei von drei Risikofaktoren (Gleason-Score ≥ 8, mindestens drei Knochenmetastasen, radiologisch messbare viszerale Metastasen) erhielten eine herkömmliche Androgendeprivation und wurden randomisiert, zusätzlich entweder Abirateronacetat (1.000 mg/d) plus Prednison (5 mg/d) oder anstelle dieser beiden Substanzen Placebos einzunehmen.
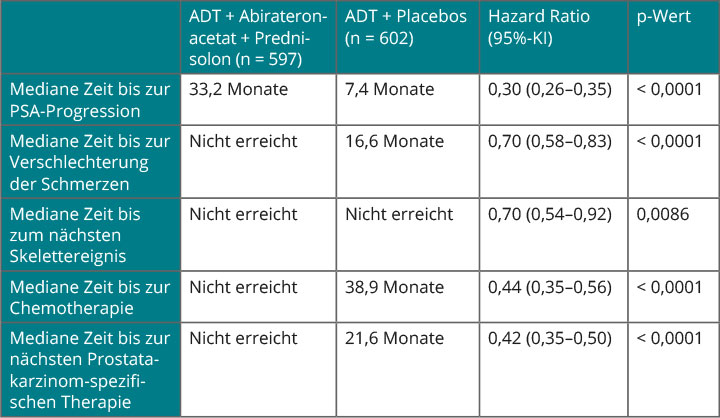
Gesamt- und radiologisch definiertes progressionsfreies Überleben waren die ko-primären Endpunkte. Beide fielen bereits in der ersten Interimsanalyse nach median 30,4 Monaten, die Karim Fizazi, Villejuif, in der Plenarsitzung des ASCO-Kongresses in Chicago vorstellen konnte [2], positiv zugunsten der Kombinationstherapie aus: Im experimentellen Arm war der Medianwert beim Gesamtüberleben noch nicht erreicht, im Kontrollarm betrug er 34,7 Monate (HR 0,62; p < 0,001; Abb. 1b). Der positive Effekt war für alle untersuchten Subgruppen zu sehen. Beim zweiten ko-primären Endpunkt, dem progressionsfreien Überleben, war das entsprechende Intervall durch die zusätzliche Hormontherapie von 14,8 auf 33,0 Monate mehr als verdoppelt worden (HR 0,47; p < 0,001). Sekundäre Endpunkte waren die Zeit bis zur Verschlechterung der Schmerzen und der PSA-Progression, die Zeit bis zum nächsten symptomatischen Skelettereignis, zur ersten Chemotherapie und zur nächsten Therapie gegen das Prostatakarzinom. Bei allen diesen Endpunkten war die Zugabe von Abirateron und Prednisolon ebenfalls signifikant überlegen (Tab. 1).
Im experimentellen Arm wurden häufiger Grad-3/4-Nebenwirkungen registriert (63% vs. 48%), v. a. ein Hypertonus, eine Hypokaliämie und kardiale Störungen, aber das führte nicht zu mehr Therapieabbrüchen oder Todesfällen, so Fizazi.
Das sehr akzeptable Sicherheitsprofil und die deutliche Verlängerung des Überlebens sowie des progressionsfreien Überlebens lässt die Kombination einer klassischen Hormontherapie mit Abirateronacetat und Prednisolon/Prednison möglicherweise als einen neuen Standard in der Initialbehandlung von Hochrisiko-Patienten mit hormonsensiblem Prostatakarzinom erscheinen, sagten sowohl James als auch Fizazi in Chicago, während diese Empfehlung so dezidiert in den beiden parallel zu den Vorträgen online erschienenen Publikationen im New England Journal of Medicine noch nicht enthalten sind [3, 4].
Offene Fragen
So positiv diese Ergebnisse sind, ergeben sich daraus doch zahlreiche weitere Fragen:
- Die Gesamtüberlebenskurven der Subgruppe der metastasierten Patienten in der STAMPEDE-Studie sind denen der LATITUDE-Studie, in der eine Metastasierung Einschlusskriterium war, sehr ähnlich, sodass eine gepoolte Analyse die Signifikanz der erzielten Ergebnisse sicherlich noch verstärken würde (Abb. 1). Ein grober Vergleich der Ergebnisse mit denen der CHAARTED-Studie lässt aber auch erkennen, dass nicht nur die Überlebenskurven der Kontrollarme (jeweils nur ADT), sondern auch die experimentellen Arme (ADT + Abirateron bzw. ADT + Docetaxel) praktisch deckungsgleich verlaufen. Was die Überlebensverlängerung angeht, scheinen die Chemo- und die Hormontherapie also vergleichbare Effizienz zu haben. Die Frage, welche Kombination man in der Erstlinie anwenden sollte, wird man daher wohl für jeden einzelnen Patienten etwa mit Blick auf die jeweiligen Toxizitäten individuell beantworten müssen.
- In diesem Kontext stellt sich auch die Frage, ob man bei Patienten mit Nebenwirkungen die zusätzliche Hormontherapie intermittierend geben kann, ohne ihre Wirksamkeit zu kompromittieren.
- Die LATITUDE-Studie schloss nur Patienten mit hohem Risikoprofil ein. Betrachtet man zusätzlich die Ergebnisse der STAMPEDE-Studie, so scheinen die Ergebnisse hinsichtlich des Überlebensbenefits auf andere Risikogruppen übertragbar. Unklar ist jedoch, wie sich die Zulassungsbehörden hier äußern werden.
- Und schließlich: Welches ist die beste Anschlusstherapie, wenn eine initiale Kombination aus ADT und Abirateron versagt?
Wie lange sollte eine ADT gegeben werden?
Die optimale Dauer der Androgendeprivation ist bisher nicht genau definiert. In einer kanadischen Phase-III-Studie wurden deshalb 630 Patienten mit Hochrisiko-Prostatakarzinom randomisiert, eine Bestrahlung der Prostata und des Beckens sowie eine ADT für entweder 36 oder lediglich 18 Monate zu erhalten [5]. Primäre Endpunkte waren Gesamtüberleben, Lebensqualität und krankheitsspezifisches Überleben.
Nach zehn Jahren waren im länger behandelten Arm noch 62,4% der Patienten am Leben, im 18-Monats-Arm mit 62,0% genauso viele, so Abdenour Nabid, Sherbrooke (HR 1,024; p = 0,8411). Auch beim krankheitsspezifischen Überleben war kein Unterschied zu erkennen
(HR 0,948; p = 0,830). Anders bei der Lebensqualität: In sechs Skalen und
13 Einzel-Items fanden sich signifikante Unterschiede zugunsten der 18-monatigen Behandlung (p < 0,001); in zwei dieser Auswertungen – bei Hitzewallungen und beim Genuss an sexueller Betätigung – wurden klinisch relevante Unterschiede von mindestens zehn Punkten gefunden. Die kanadischen Autoren ziehen aus ihren Ergebnissen die Folgerung, dass eine ADT ohne onkologisches Risiko nur
18 Monate lang gegeben werden kann und dass das einen neuen Standard in der Behandlung des Hochrisiko-Prostatakarzinoms darstellt.
Die Frage nach der Sequenz: erste randomisierte Daten
Die erste Therapie nach Versagen der ADT, also die erste Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) wird normalerweise als Erstlinientherapie bezeichnet. Dafür stehen mittlerweile zwei hormonelle Therapieoptionen zur Verfügung: der Androgensynthese-Hemmer Abirateronacetat, der zusammen mit einem Kortikosteroid gegeben wird, und Enzalutamid, das den Androgenrezeptor-Signalweg an mehreren Stellen inhibiert. Beide Regimes sind bisher nicht direkt miteinander verglichen worden, und die optimale Sequenz ist ebenso wenig klar wie die Antwort auf die Frage, ob es dafür hilfreiche Biomarker gibt. In einer ebenfalls in Kanada durchgeführten Phase-II-Studie wurden beide Protokolle bei 202 therapienaiven Patienten mit mCRPC randomisiert miteinander verglichen, wobei bei Auftreten eines PSA-Progresses jeweils ein Cross-over zu der anderen Substanz vorgesehen war. Die primären Endpunkte Ansprechen und Zeit bis zur PSA-Progression nach der Zweitlinie sind noch nicht auswertbar, weil die Rekrutierung der Patienten erst im Oktober 2016 abgeschlossen wurde; aber die Ergebnisse zu den sekundären Endpunkten PSA-Ansprechen und Zeit bis zum PSA-Progress unter der Erstlinientherapie konnte Kim Chi, Vancouver, beim ASCO-Kongress vorstellen [6]:
Eine Abnahme der PSA-Werte um mindestens 50% nach zwölf Wochen wurde bei 53% der Patienten unter Abirateron und bei 73% unter Enzalutamid gesehen (p = 0,004), während bei der Zeit bis zum PSA-Progress mit median 7,4 versus 8,0 Monaten kein signifikanter Unterschied bestand (HR 0,88; 95%-KI 0,61–1,27). Auf der Suche nach Biomarkern wurden in der zirkulierenden Tumor-DNA 73 für das mCRPC relevante Gene mittels Deep-Sequencing analysiert. Die 60% der Patienten, bei denen sich mehr als 2% Tumor-DNA im Blut fanden, hatten eine signifikant kürzere Zeit bis zum PSA-Progress (HR 1,8, p = 0,005). Ebenfalls mit einer kürzeren Zeit bis zum biochemischen Progress waren in einer univariaten Analyse pathogene Veränderungen in den Genen für den Androgenrezeptor, TP53, RB1, in Genen des PI3K-Signalwegs sowie in den DNA-Reparatur-Genen BRCA2 und ATM assoziiert; in der multivariaten Analyse blieben Mutationen von TP53, PI3K-Komponenten und BRCA2/ATM als signifikante Faktoren übrig (HR 2,54 bzw. 2,68). Außerdem wurden strukturelle Rearrangements im Gen für den Androgenrezeptor gefunden, die einen verkrüppelten Rezeptor zur Folge haben und Ursache einer primären Resistenz sein könnten.
Carboplatin: Nur aggressive Prostatakarzinome sprechen an
Eine aggressive Variante des Prostastakarzinoms, die sich durch eine spezifische molekulare Signatur auszeichnet, entspricht in klinischen Merkmalen weitgehend dem histologisch definierten kleinzelligen Prostatakarzinom, das bekanntermaßen schlecht auf gegen den Androgenrezeptor gerichtete Therapien anspricht. Molekular sind diese aggressiven Tumoren durch Defekte in mindestens zwei von drei Tumorsuppressor-Genen (TP53, RB1 und/oder PTEN) definiert, die immunhistochemisch oder molekulargenetisch nachgewiesen werden können. In einer randomisierten Phase-II-Studie am M. D. Anderson Cancer Center hatten Patienten mit CRPC von der Zugabe von Carboplatin (AUC4) zu Cabazitaxel mit einer Verlängerung des progressionsfreien Überlebens von median 4,6 auf 7,4 Monate profitiert (p = 0,004). Dabei hatte sich gezeigt, dass dieser Vorteil auf die Subgruppe mit der klinisch definierten aggressiven Variante beschränkt war [7].
Beim diesjährigen ASCO-Kongress präsentierten die Kollegen aus Houston die molekulargenetischen Daten dazu [8]: Die Verlängerung des progressionsfreien Überlebens im Gesamtkollektiv von
160 Patienten nach median 21,6 Monaten Follow-up spiegelt sich weitgehend in der Subgruppe der nach molekulargenetischen Kriterien aggressiven Tumoren (8,0 vs. 4,5 Monate; p = 0,0036). Hingegen schienen die Patienten, deren Tumoren diese molekulare Signatur nicht aufwiesen, mit median 6,8 Monaten unter Cabazitaxel und 5,4 Monaten unter der Kombination keinerlei Vorteil von der Carboplatin-Zugabe zu haben, so Ana Aparicio, Houston (p = 0,1445). Dieser Unterschied war vor allem in den Analysen aus Tumormaterial zu sehen, während er in der zirkulierenden Tumor-DNA zwar erkennbar, aber nicht statistisch signifikant war.
Offenbar reagieren diese aggressiven Tumoren zwar nicht auf die Hemmung des Androgenrezeptors, sind aber auf der anderen Seite platinsensibel, während für die übrigen Prostatakarzinome das Gegenteil gilt. Daraus, so Aparicio, könnte sich eine neue, therapeutisch relevante Klassifikation des Prostatakarzinoms ergeben, sobald es gelingt, eine in der klinischen Routine anwendbare Methode zum Nachweis der betreffenden molekularen Signatur zu etablieren.
Nierenzellkarzinom
Avelumab plus Axitinib: gleich in die Erstlinie
Nach der teilweise rasanten Entwicklung der letzten Jahre war es um das Nierenzellkarzinom beim diesjährigen ASCO-Kongress etwas ruhiger: Von Interesse waren vor allem Daten einer Reihe von frühen Studien zu Kombinationen aus Immuntherapie und Tyrosinkinase-Inhibitoren, von denen man sich durch die Ausnutzung komplementärer Wirkmechanismen einen beträchtlichen Zusatznutzen verspricht.
Die Zuversicht, die auf diesem Gebiet herrscht, lässt sich schon daran erkennen, dass derartige Kombinationen in der Regel gleich in der Erstlinientherapie erprobt werden. Bereits beim ESMO-Kongress 2016 waren vorläufige Ergebnisse einer Phase-Ib-Studie präsentiert worden, in der die Kombination aus Pembrolizumab und dem bisher nur zur Zweitlinientherapie des Nierenzellkarzinoms zugelassenen Tyrosinkinase-Inhibitor Axitinib bei insgesamt 52 Patienten eine Gesamtansprechrate von 67% mit zwei Komplettremissionen erzielt hatte [9]. Und in einer Phase-II-Studie, die beim ASCO-GU-Kongress im Februar dieses Jahres vorgestellt wurde, hatten ebenfalls nicht vorbehandelte Patienten entweder die Kombination aus Bevacizumab und dem PD-L1-Antikörper Atezolizumab oder den Antikörper alleine oder den bisherigen Erstlinien-Standard Sunitinib alleine erhalten [10]. Trotz eines Crossover-Designs schnitt die Kombination vor allem bei den 164 Patienten mit PD-L1-Expression auf den tumorinfiltrierenden Immunzellen mit einer medianen progressionsfreien Überlebensdauer von
14,7 Monaten deutlich besser ab als Atezolizumab alleine (5,5 Monate) bzw. Sunitinib (7,8 Monate; HR 0,64; p = 0,095). Atezolizumab/Bevacizumab wird derzeit in der globalen Phase-III-IMmotion151-Studie, an der auch einige deutsche Zentren teilnehmen, gegen Sunitinib geprüft [11].
Beim ASCO-Kongress in Chicago wurden nun zwei weitere Immuntherapie-Kombinationsstudien vorgestellt: In der Phase-I-Studie JAVELIN Renal 100 wurde Axitinib, das nur zur Zweitlinientherapie zugelassen ist, aber in einer Phase-III-Studie auch in der Erstlinie Sorafenib überlegen war [12], bei Patienten mit unbehandeltem fortgeschrittenem Nierenzellkarzinom mit dem PD-L1-Antikörper Avelumab kombiniert [13]. 54 der 55 eingeschlossenen Patienten haben beide Substanzen für median rund
25 Wochen erhalten, so Toni Choueiri, Boston. Die Therapie war sicher: Über 90% der Patienten zeigten Nebenwirkungen beider Medikamente (für Avelumab vor allem Fatigue und Diarrhö, für Axitinib Diarrhö, Hypertonus, Dysphonie und Fatigue), aber für den Antikörper waren nur 20% dieser unerwünschten Wirkungen vom Grad 3 oder 4, für Axitinib etwas über 50%. Bei 9% der Patienten führten Nebenwirkungen zum Abbruch der Avelumab-Behandlung, für Axitinib waren es 7,3%. 32 der 55 Patienten sprachen auf die Behandlung an (Gesamtansprechrate 58,2%), darunter waren drei komplette Remissionen; elf weitere Patienten reagierten mit einer Krankheitsstabilisierung. 24 der 32 Remissionen hielten zum Zeitpunkt der Auswertung noch an, so Choueiri. Die Expression von PD-L1 auf Immunzellen im Tumorgewebe war mit einem besseren Ansprechen assoziiert, aber auch bei PD-L1-freien Tumoren wurden Remissionen gesehen.
Bei einem handhabbaren Sicherheitsprofil, so Choueiri, rechtfertigen diese Ansprechraten, die diejenigen mit den Einzelsubstanzen übertreffen, die weitere Untersuchung der Kombination aus Avelumab und Axitinib. In der globalen, auch an einigen deutschen Zentren laufenden Phase-III-Studie JAVELIN Renal 101 wird sie derzeit bei nicht vorbehandelten Patienten mit fortgeschrittenem klarzelligem Nierenzellkarzinom randomisiert gegen den bisherigen Erstlinien-Standard Sunitinib getestet [14].
Aus für Pazopanib/Pembrolizumab
Eine zugelassene Erstlinientherapie für das metastasierte Nierenzellkarzinom ist der Angiokinase-Inhibitor Pazopanib. Er sollte in einer Phase-I/II-Studie in Kombination mit dem PD-1-Inhibitor Pembrolizumab getestet werden. Aufgrund starker Hepatotoxizität wurde das Protokoll dahingehend geändert, dass Pazopanib zunächst neun Wochen lang in einschleichender Dosierung gegeben und erst danach mit dem Antikörper kombiniert wurde, so Simon Chowdhury, London [15]. Von den 15 Patienten, die in diese Kohorte rekrutiert wurden, erhielten nur fünf die Kombination tatsächlich, und bei ihnen traten drei dosislimitierende Toxizitäten auf (eine Pneumonitis und eine Darmperforation vom Grad 3 und eine Lipase-Erhöhung vom Grad 4). Trotz eines positiven Aktivitätssignals – in der ersten Kohorte, die 800 mg Pazopanib und 2 mg/kg Pembrolizumab alle drei Wochen bekommen hatte, sprachen sechs Patienten an – wurde die Studie nicht wie ursprünglich geplant in die Phase II überführt und die Entwicklung dieser Kombination gestoppt.
Zur Kombination des PD-1-Inhibitors Nivolumab mit dem CTLA-4-Antikörper Ipilimumab beim unbehandelten Nierenzellkarzinom laufen ebenfalls eine Reihe von klinischen Untersuchungen, darunter die CheckMate-214-Studie, deren Daten mit Spannung erwartet werden.
Adjuvante Therapie des Nierenzellkarzinoms: immer noch kein Fortschritt
Etwa drei Viertel aller Nierenzellkarzinome werden heute in einem operablen Stadium diagnostiziert, aber ein gutes Drittel davon wird irgendwann nach der Resektion Rezidive ausbilden. Deshalb wird seit einigen Jahren verstärkt nach Möglichkeiten gesucht, dieses Rezidivrisiko bei Hochrisiko-Patienten mithilfe adjuvanter Therapien zu vermindern – mit bisher widersprüchlichen Ergebnissen: In der ASSURE-Studie konnten weder Sunitinib noch Sorafenib das krankheitsfreie Überleben verlängern [16], während eine Verlängerung des Medianwerts von 5,6 auf 6,8 Jahren in der S-TRAC-Studie zwar relativ bescheiden, aber statistisch signifikant ausfiel (HR 0,76; p = 0,03; [17]). In Chicago konnte Robert Motzer, New York, in diesem Jahr die ersten Ergebnisse der Phase-III-Studie PROTECT vorstellen, in der Pazopanib bei Patienten mit lokal fortgeschrittenem Hochrisiko-Nierenzellkarzinom nach Nephrektomie gegen Placebo getestet wurde [18]. 1.538 Patienten wurden auf eine einjährige Behandlung mit Pazopanib oder Placebo randomisiert, wobei der TKI zunächst mit 800 mg/d gegeben wurde. Aufgrund hoher Abbruchraten wegen Nebenwirkungen unter den ersten 403 Patienten wurde die Dosis auf 600 mg/d reduziert (die bei guter Verträglichkeit auf 800 mg/d gesteigert werden konnten) und als primärer Endpunkt das krankheitsfreie Überleben unter der reduzierten Dosierung versus Placebo festgelegt.
Gemessen an diesem primären Endpunkt fiel das Ergebnis negativ aus mit einer Hazard Ratio von 0,862 (p = 0,165) in der primären Analyse. Bei den sekundären Endpunkten des krankheitsfreien Überlebens unter 800 mg/d Pazopanib sowie bei allen Patienten zeigte sich hingegen ein signifikanter Rückgang des Rezidiv- oder Sterberisikos um 31% bzw. 20%. Das Sicherheitsprofil einschließlich der Dosisreduktions- und Abbruchraten war allerdings zwischen beiden Dosierungen vergleichbar. Pazopanib kann daher nicht zur adjuvanten Gabe nach Resektion eines Nierenzellkarzinoms empfohlen werden, so Motzers Resümee. Was die adjuvante Behandlung des Nierenzellkarzinoms angeht, wird man die Ergebnisse von zum Teil bereits laufenden Studien abwarten müssen, in denen deutlich nebenwirkungsärmere Immuntherapien geprüft werden.
Harnblasenkarzinom
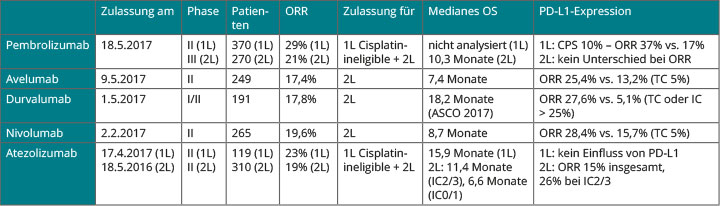
Beim Harnblasenkarzinom haben die Immuntherapien nach Jahrzehnten frustraner Erfahrungen erstmals Hoffnung auf Erfolg bei Patienten mit fortgeschrittenen Erkrankungen gebracht. Die Liste der Zulassungen von Checkpoint-Inhibitoren in den USA mit vier Neuzulassungen und einer Zulassungserweiterung alleine in diesem Jahr ist eindrucksvoll (Tab. 2); in Europa hat bisher lediglich Nivolumab seit Kurzem eine Zulassung für die Zweitlinie nach Versagen einer platinhaltigen Chemotherapie. In Chicago gab es einige interessante Abstracts zu diesem Themenkomplex:
Checkpoint-Inhibition: Hoffnung auf Langzeitüberleben
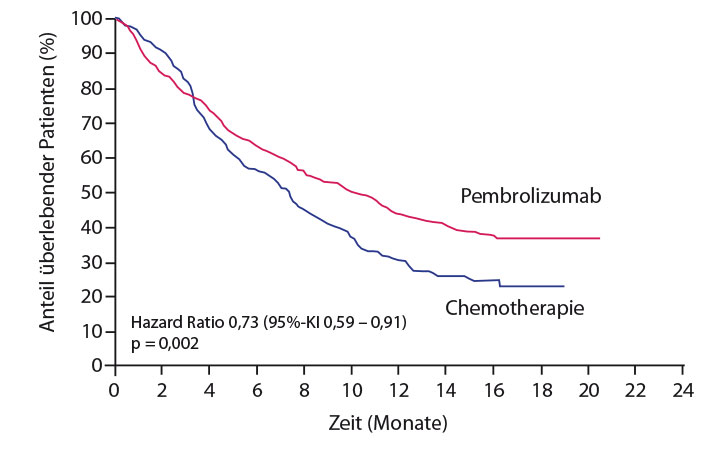
Die US-Zulassung von Pembrolizumab zur Zweitlinientherapie des Urothelkarzinoms beruht auf der Studie KEYNOTE-045 mit 542 Patienten mit einem nach einer platinhaltigen Therapie progredienten Tumor. Darin war der Antikörper nach median 14 Monaten Follow-up einer Chemotherapie mit Paclitaxel, Docetaxel oder Vinflunin mit einer medianen Überlebenszeit von 10,3 versus 7,4 Monaten (HR 0,73; p = 0,002) signifikant überlegen gewesen (Abb. 2; [19]). Beim ASCO-Kongress stellte Dean Bajorin, New York, eine detaillierte Analyse aller relevanten Daten nach median 18,5 Monaten Follow-up vor [20]: Der Überlebensvorteil durch Pembrolizumab gegenüber der Chemotherapie mit median 10,3 versus 7,4 Monaten konnte bestätigt werden (HR 0,70; p = 0,0004). Er erstreckte sich über alle Subgruppen, während der Antikörper beim progressionsfreien Überleben mit median 2,1 versus 3,3 Monaten (HR 0,96; p = 0,32) nicht überlegen war. Der positive Effekt auf das Überleben war zwar bei Tumoren mit PD-L1-Expression stärker, aber auch bei PD-L1-negativem Ergebnis nicht auszuschließen – das ist der Grund, warum die FDA-Zulassung für alle in Zweitlinie zu behandelnden Urothelkarzinome unabhängig von der Expression des Liganden ausgesprochen wurde.
Die Ansprechrate war durch Pembrolizumab beinahe verdoppelt worden (von 11% auf 21,1% mit 2,9% bzw. 7,8% Komplettremissionen). Besonders eindrucksvoll war das Verhältnis der Überlebensraten nach zwölf und nach 18 Monaten: Nach einem Jahr waren noch 44,4% der Patienten aus dem Pembrolizumab-, aber nur 30,2% derer aus dem Kontrollarm am Leben, nach 18 Monaten lagen die betreffenden Werte bei 36,1% bzw. 20,5%. Ähnlich war das Verhältnis bei der Dauer der Remissionen: 69% von ihnen dauerten unter Pembrolizumab mindestens ein Jahr an, unter der Chemotherapie mit 36% kaum mehr als halb so viele. Die Überlebenskurven sind zwar noch nicht vollständig reif, dennoch kann man den Ansatz eines Plateaus auf einem für diesen Tumor hohen Niveau (Abb. 2) und damit die Aussicht auf ein Langzeitüberleben für einen Teil der Patienten erkennen, wie es etwa für die Immuntherapien beim malignen Melanom mittlerweile als gesichert gelten kann (z. B. [21]). Darüber hinaus war in der KEYNOTE-045-Studie auch die Verträglichkeit der Immuntherapie besser: Behandlungsbedingte Nebenwirkungen wurden hier bei 61,3% der Patienten registriert, im Kontrollarm bei 90,2%, Ereignisse vom Grad 3 oder höher waren unter der Chemotherapie mit 49,8% dreimal häufiger als mit dem Antikörper (16,5%).
IDO1- in Kombination mit Checkpoint-Inhibitor
Ein neuer Wirkmechanismus, der auf eine Stärkung der anti-tumoralen Immunantwort abzielt, ist die Hemmung des Enzyms Indolamin-2,3-dioxygenase 1 (IDO1). Es baut Tryptophan ab, das die T-Lymphozyten zur Proliferation benötigen. Die Überexpression von IDO1 ist daher mit der Progression von Tumoren und mit einem verkürzten Überleben der Patienten assoziiert. Deshalb wird derzeit der potente, selektive IDO1-Inhibitor Epacadostat bei zahlreichen Tumorentitäten getestet, unter anderem in der Phase-I/II-Studie ECHO-202 (auch KEYNOTE-037): Darin wird Epacadostat bei fortgeschrittenen Tumoren, darunter auch vorbehandelten Urothelkarzinomen, mit Pembrolizumab kombiniert [22]. Alle 40 bisher auswertbaren Patienten mit Urothelkarzinom, so David Smith, Ann Arbor, waren mit platinhaltigen Chemotherapien vorbehandelt. Fünf von ihnen waren in der Phase I eingeschlossen, wo zweimal täglich 100 mg Epacadostat in Kombination mit 200 mg Pembrolizumab alle drei Wochen als Dosierung für die Phase II ausgewählt wurde, in der 35 weitere Patienten behandelt wurden.
Primärer Endpunkt war, wie in Phase-II-Studien üblich, die Gesamtansprechrate, und sie lag für alle Patienten bei 35% und damit höher als für Pembrolizumab in der Zulassungsstudie für die Zweitlinie (21%). Weitere 22% der Patienten erzielten mit der Kombination eine Krankheitsstabilisierung. Zwölf der
13 Remissionen dauerten zum Zeitpunkt der Datenerfassung noch an. Auch hier waren die Ansprechraten bei Patienten mit PD-L1-exprimierenden Tumoren höher, aber auch in PD-L1-negativen Fälle waren Remissionen zu sehen. Die Kombination war sicher: Die Häufigkeit von Grad-3/4-Nebenwirkungen und therapiebedingten Abbrüchen waren nicht höher als mit einer Pembrolizumab-Monotherapie; lediglich Hautausschläge vom Grad 3 oder 4 traten unter der Kombination öfter auf. Aufgrund dieser positiven Resultate soll die Kombination aus Epacadostat und Pembrolizumab nun beim Urothelkarzinom in zwei Phase-III-Studien weiter untersucht werden.
Mutationen in DNA-Reparaturgenen mit Ansprechen auf Immuntherapie assoziiert
Die PD-L1-Expression ist als Biomarker nur bedingt zur Selektion von Patienten geeignet, die von einer Therapie mit Checkpoint-Inhibitoren profitieren könnten. Wegen der Bedeutung dieses Therapieansatzes für nahezu die gesamte Onkologie und nicht zuletzt auch wegen der enormen Kosten wird fieberhaft nach weiteren Biomarkern gesucht, die eine klinische Wirkung zuverlässiger vorhersagen könnten. Ein Ansatzpunkt ist die Tatsache, dass Ansprechen und auch Überleben unter Checkpoint-Inhibitoren mit der Mutationslast der Tumoren korrelieren [23]. Gene, die an der Reaktion der Zelle auf DNA-Schäden und ihrer Reparatur (DNA Damage Response and Repair, DDR) beteiligt sind, können ihrerseits defekt sein, und solche Defekte führen zu einer höheren Mutationslast und in der Folge zu einem besseren Ansprechen auf die Checkpoint-Inhibition. Kollegen am Memorial Sloan Kettering Cancer Center in New York um MinYuen Teo überprüften deshalb die Hypothese, dass Veränderungen in DDR-Genen beim metastasierten Urothelkarzinom mit einem besseren klinischen Ergebnis bei Blockade von PD-1 oder PD-L1 assoziiert sind [24].
In einer Stichprobe von 69 Patienten aus drei Phase-II-Studien fanden sie tatsächlich in 49% der Proben Veränderungen dieser Gene, die bei 27,5% das betreffende Gen funktionsunfähig machten. In der Tat waren Veränderungen im Allgemeinen mit einem verbesserten Ansprechen und mit einer deutlichen und signifikanten Verlängerung des progressionsfreien (HR 0,27; p < 0,001) und des Gesamtüberlebens (HR 0,30; p < 0,001) unter dem Checkpoint-Inhibitor korreliert. Bei Vorliegen funktionsuntüchtiger Gene war lediglich ein Trend in diese Richtung zu erkennen. Hier ist noch viel Arbeit zu erledigen, so die Autoren: Diese Befunden müssen in prospektiven Studien erhärtet und in Beziehung zu anderen potenziellen prädiktiven Markern gesetzt werden.
Darm-Mikrobiom beeinflusst Wirkung von Checkpoint-Inhibition
Einen auf den ersten Blick etwas ungewöhnlichen, möglicherweise aber tatsächlich prädiktiven Faktor nahmen Onkologen am M. D. Anderson Cancer Center in Houston unter die Lupe: Die Zusammensetzung des Mikrobioms im Darm des Patienten wird zunehmend häufiger mit malignen Erkrankungen in Verbindung gebracht. In Tiermodellen haben außerdem Veränderungen im Mikrobiom bereits einen Einfluss auf das Ansprechen auf Checkpoint-Inhibitoren gezeigt. Untersuchungen an Patienten gibt es bisher kaum, sodass diejenige, die Jennifer Wargo, Houston, beim ASCO-Kongress präsentierte, allgemeines Interesse beanspruchen dürfte, auch wenn sie sich mit Melanom-Patienten beschäftigte, die Checkpoint-Inhibitoren erhielten [25].
Bei 105 Patienten, die wegen eines malignen Melanoms mit PD-1- oder PD-L1-Inhibitoren behandelt wurden, untersuchten die Kollegen das orale sowie das Darm-Mibrobiom. Dabei zeigten sich signifikante Unterschiede zwischen Respondern und Non-Respondern auf die Checkpoint-Inhibitoren, was die Vielfalt ebenso wie die spezielle Zusammensetzung der bakteriellen Flora betraf: So wurde bei Respondern eine signifikant höhere Artenvielfalt gefunden (p = 0,03), und außerdem beherbergten sie häufiger Clostridiales, die Non-Responder hingegen öfter Bacteroidales. Das immunologische Profil, das mithilfe von Immunhistochemie, Durchflusszytometrie, Zytokin- und Genexpressions-Profilen erstellt wurde, ergab eine stärkere Infiltration der Tumoren mit Immunzellen bei den Respondern, insbesondere mit mehr CD8-positiven T-Zellen, die wiederum mit hohen Konzentrationen an bestimmten Keimen wie Ruminococcus- und Faecalibacterium-Spezies im Darm korrelierten. Die Anwesenheit von Faecalibacterium prausnitzii beispielsweise war auch signifikant mit einem längeren progressionsfreien Überleben unter der Immuntherapie assoziiert. Ähnliche Beobachtungen, so Wargo, gibt es auch bereits bei Patienten mit Lungen- und Nierentumoren.
Antibiose verschlechtert Outcome unter Immuntherapie
Dass solche Befunde weitreichende Konsequenzen haben dürften, die allerdings in großen prospektiven und kontrollierten klinischen Studien getestet werden müssen, belegt eine weitere Untersuchung, die französische Onkologen in Chicago präsentierten [26]: Sie analysierten 175 Patienten mit verschiedenen malignen Tumoren – darunter auch Nierenzell- und Urothelkarzinome –, die alle mit Checkpoint-Inhibitoren behandelt wurden, im Hinblick darauf, ob sie in den zwei Monaten vor und/oder im ersten Monat der Immuntherapie Antibiotika eingenommen hatten. Das war bei 51 der Patienten (29%) der Fall, so Lisa Derosa, Villejuif, und in dieser Subgruppe fielen tatsächlich progressionsfreies (median 3,4 vs. 5,2 Monate; p < 0,013) und Gesamtüberleben (median 12,2 vs. 20,8 Monate; p < 0,001) signifikant kürzer aus. Bei genauem Hinsehen war bei Patienten mit nicht-kleinzelligem Lungenkarzinom das Gesamt- und bei denen mit den urologischen Tumoren das progressionsfreie Überleben verkürzt, aber solche Unterschiede sind vielleicht auch den niedrigen Patientenzahlen geschuldet. Diese Resultate bedürfen sicherlich der Validierung in größeren Kohorten, aber ihre Relevanz wird schon jetzt durch die Tatsache unterstrichen, dass der negative Einfluss der Antibiotika-Therapie in einer multivariaten Analyse unabhängig von den spezifischen Risikofaktoren für die jeweiligen Tumorentitäten signifikant blieb.
Erstes Immunkonjugat: gutes Ansprechen von Urothelkarzinomen
Eine Therapierichtung, die in den letzten Jahren bei verschiedenen Tumoren vorangetrieben wurde und die man ebenfalls unter dem Überbegriff Immuntherapie subsummieren kann, sind Immunkonjugate. Dabei wird ein gegen ein möglichst tumorspezifisches Oberflächenantigen gerichteter monoklonaler Antikörper so mit einem potenten Zytostatikum gekoppelt, dass diese Verbindung erst nach Aufnahme des Komplexes in die Tumorzelle gelöst und systemische toxische Effekte dadurch möglichst vermieden werden. Solche Präparate werden beim Mammakarzinom (gegen HER2) und beim Hodgkin-Lymphom (gegen das CD30-Antigen) bereits in der Klinik angewendet, und ein weiteres solches Immuntoxin wurde nun in einer Phase-I-Studie bei Patienten mit verschiedenen Tumoren, darunter 81 mit stark vorbehandeltem metastasiertem Urothelkarzinom, getestet [27].
Hodentumoren: Langzeitschäden durch Cisplatin
Mit Heilungsraten von 80–90% ist die Therapie von Hodentumoren so erfolgreich, dass die klinische Forschung hier im Vergleich zu anderen Tumorentitäten weit weniger aktiv ist. Ähnliche Verhältnisse findet man bei Hodgkin-Lymphomen, wo allerdings in den letzten Jahren verstärkt versucht wird, die teilweise extrem aggressiven Therapien durch Reduktion der Intensität oder durch Anwendung neuer, weniger toxischer Optionen verträglicher zu machen. Vor allem die Langzeit-Toxizitäten stellen für die teilweise noch ziemlich jungen Patienten ein großes Problem dar, und das trifft noch stärker auf Hodenkarzinome zu, die ausschließlich junge Männer betreffen. Dort wurde vor etwa 40 Jahren Cisplatin in die Behandlung eingeführt, was für niederländische Onkologen Anlass war, in einem großen Kollektiv von Patienten die Auswirkungen einer solchen Therapie auf die Lebenserwartung zu untersuchen [28].
Von den 321 Patienten, deren Daten Sjoukje Lubberts und Kollegen, Groningen, aus medizinischen Akten, dem niederländischen Krebsregister und den Unterlagen von Allgemeinärzten zusammentrugen und die bei Beginn der Chemotherapie im Median 28 Jahre alt gewesen waren, war nach median 25 Jahren jeder dritte verstorben. Die standardisierte Mortalitätsrate (SMR), also das Verhältnis zwischen tatsächlicher und entsprechend der Altersstruktur zu erwartender Mortalität lag insgesamt bei 4,0 (95%-KI 3,6–4,4), für die nicht durch den Hodentumor verursachte Mortalität aber immer noch bei 1,5 (95%-KI 1,1–1,9), für den Tod durch Sekundärmalignome bei 1,7 (95%-KI 1,0–2,2) und für kardiovaskulär bedingte Todesfälle bei 1,5 (95%-KI 0,7–2,2). Im Median waren die Patienten um fünf bis zehn Jahre früher verstorben als ihrem Alter entsprechend zu erwarten gewesen wäre.
Über Konsequenzen aus diesen Daten wird man nachdenken müssen: Möglicherweise wäre es sinnvoll, die Intensität der adjuvanten Therapie etwa bei Seminomen des Stadiums IIA/B zu reduzieren.
PET-positive Residuen von Seminomen nach Chemotherapie meist falsch-positiv
Das metastasierte Seminom spricht gut auf eine Chemotherapie an, aber man findet nicht selten danach noch Residuen. Als Behandlungsstrategie wird hier bloße Beobachtung empfohlen, wenn die Läsionen kleiner als 3 cm oder PET-negativ sind. Wie PET-positive Läsionen zu behandeln sind, ist mangels zuverlässiger Daten nicht wirklich klar. Die International Global Germ Cell Cancer Group (G3) trug in einer retrospektiven Analyse die Daten von 91 Patienten aus neun Ländern zusammen, die eine Chemotherapie wegen eines metastasierten Seminoms erhalten und danach im PET positive Resttumoren aufgewiesen hatten [29]. Sie durften kein erhöhtes α-Fetoprotein gehabt haben, und der Tumor durfte bei Diagnose keine nicht-seminomatösen Komponenten enthalten haben.
Insgesamt wurden in dem Kollektiv 15 Rezidive beobachtet, die nach median 3,7 Monaten aufgetreten waren, so Richard Cathomas, Chur, Schweiz. Neun der Patienten wurden biopsiert, alle mit negativem Ergebnis. Lediglich in zwei biopsierten Fällen trat ein Rezidiv auf. Bei 32 Patienten wurden die Tumoren reseziert, wobei nur sieben der Resektate Reste des Seminoms aufwiesen. Die Autoren folgern aus ihren Ergebnissen, dass etwa drei Viertel der positiven PET-Befunde nach Chemotherapie falsch-positiv sind und daher mit einer chirurgischen Intervention übertherapiert würden. Da fast alle Patienten mit manifesten Rezidiven mit einer Salvagetherapie erfolgreich behandelt werden konnten, empfehlen sie, acht bis zwölf Wochen nach einem positiven Befund ein weiteres PET durchzuführen, bevor man über das weitere Vorgehen entscheidet.
Wie Daniel Petrylak, New Haven, in Chicago berichtete, ist das Immunkonjugat Enfortumab Vedotin gegen das Nectin-4-Molekül gerichtet, das auf der Mehrzahl aller metastasierten Urothelkarzinome überexprimiert ist. Eine Anti-Tumor-Aktivität wurde bei allen untersuchten Dosierungen gesehen; insgesamt lag die Ansprechrate bei 41%, bei Patienten, die vorher bereits Checkpoint-Inhibitoren erhalten hatten, betrug sie 44% und bei Patienten mit Lebermetastasen 47%. Bei drei Patienten stellte sich bei Dosen von 1 mg/kg oder mehr sogar eine Komplettremission ein. Die mediane Dauer des Ansprechens beträgt bisher etwa 24 Wochen. Diese Ergebnisse, so Petrylak, rechtfertigen jedenfalls die weitere Entwicklung von Enfortumab Vedotin als Monotherapie bzw. in Kombination mit anderen Behandlungsmodalitäten.
Literatur
1. James ND et al. ASCO 2017, Abstract #LBA5003.
2. Fizazi K et al. ASCO 2017, Abstract #LBA3.
3. James ND et al. N Engl J Med 2017, June 3 [prepub ahead of print, DOI: 10.1056/NEJMoa1702900].
4. Fizazi K et al. N Engl J Med 2017, June 4 [prepub ahead of print, DOI: 10.1056/NEJMoa1704174].
5. Nabid A et al. ASCO 2017, Abstract #5008.
6. Chi KN et al. ASCO 2017, Abstract #5002.
7. Corn PG et al. ASCO 2016, Abstract #5020.
8. Aparicio A et al. ASCO 2017, Abstract #5013.
9. Atkins MB et al. ESMO 2016, Abstract #773PD.
10. McDermott DF et al. ASCI-GU 2017, Abstract #431.
11. ClinicalTrials.gov No. NCT02420821.
12. Hutson TE et al. Lancet Oncol 2013; 14: 1287-94.
13. Choueiri TK et al. ASCO 2017, Abstract #4504.
14. ClinicalTrials.gov No. NCT02684006.
15. Chowdhury S et al. ASCO 2017, Abstract #4506.
16. Haas NB et al. Lancet 2016; 387: 2008-16.
17. Ravaud A et al. N Engl J Med 2016; 375: 2246-54.
18. Motzer RJ et al. ASCO 2017, Abstract #4507.
19. Bellmunt J et al. N Engl J Med 2017; 376: 1015-26.
20. Bajorin DF et al. ASCO 2017, Abstract #4501.
21. Schadendorf D et al. J Clin Oncol 2015; 33: 1889-94.
22. Smith DC et al. ASCO 2017, Abstract #4503.
23. Rosenberg JE et al. Lancet 2016; 387: 1909-20.
24. Teo MY et al. ASCO 2017, Abstract #4509.
25. Wargo JA et al. ASCO 2017, Abstract #3008.
26. Derosa L et al. ASCO 2017, Abstract #3015.
27. Petrylak DP et al. ASCO 2017, Abstract #106.
28. Lubberts S et al. ASCO 2017, Abstract #4550.
29. Cathomas R et al. ASCO 2017, Abstract #4521.

PD Dr. Thomas Horn

Prof. Dr. Jürgen E. Gschwend
Urologische Klinik und Poliklinik
Klinikum rechts der Isar der TU München
Ismaninger Straße 22, 81675 München
+49 89 4140 2522
t.horn[at]tum[dot]de

