Neues aus der Thorax-Onkologie
ASCO 2017, Chicago
Naturgemäß überwogen beim 53. ASCO-Kongress in Chicago, was die Thorax-Onkologie betraf, Nachrichten zum nicht-kleinzelligen Lungenkarzinom (NSCLC): Es ist bei Weitem der häufigste Lungentumor, und deshalb wurden hier in den letzten 20 Jahren durch sehr viel Grundlagenforschung zahlreiche neue Therapieoptionen geschaffen. Die neuen Immuntherapien setzen ihren Erfolgszug in den fortgeschrittenen Stadien fort, werden aber mittlerweile auch in der adjuvanten Situation erprobt. Bei den ALK-positiven NSCLC gibt es in der Erstlinientherapie mit dem ALK-Inhibitor Alectinib bemerkenswerte Fortschritte. Nicht zuletzt scheinen die Immuntherapien derzeit auch bei den selteneren Thorax-onkologischen Indikationen, beim kleinzelligen Lungenkarzinom (SCLC) und beim malignen Pleuramesotheliom, bei denen in den letzten Jahren weniger Fortschritte gemacht wurden, vielversprechende Effektivität zu haben.
Frühes NSCLC
Bei EGFR-Mutationen Gefitinib adjuvant?
Kann ein nicht-kleinzelliges Lungenkarzinom (NSCLC) im Stadium II–IIIA bei einem Patienten in kurativer Absicht reseziert werden – das ist bei jedem vierten bis fünften Patienten der Fall –, so ist bisher eine Cisplatin-basierte adjuvante Chemotherapie Standard. Tyrosinkinase-Inhibitoren (TKI) gegen den EGF-Rezeptor haben in den Studien BR19 und RADIANT keinen Nutzen in dieser Situation erbracht [1,2]; allerdings waren hier alle Patienten mit resezierten Tumoren zugelassen. In der RADIANT-Studie konnte für die Subgruppe der Patienten mit EGFR-Mutationen weder ein Vorteil bei progressionsfreien (PFS) noch beim Gesamtüberleben (OS) durch die Therapie mit Erlotinib gegenüber der Beobachtungsgruppe erzielt werden. Die chinesische Phase-III-Studie
ADJUVANT ist die erste randomisierte Studie, in der der EGFR-Inhibitor Gefitinib (250 mg/d über 24 Monate) nur bei Patienten mit einer aktivierenden EGFR-Mutation gegen eine Chemotherapie aus vier dreiwöchigen Zyklen Vinorelbin und Cisplatin getestet wurde (n = 222, Stadium II–IIIA, N1–2; [3]). Primärer Endpunkt war das krankheitsfreie Überleben (DFS) in der Intention-to-treat-Population.
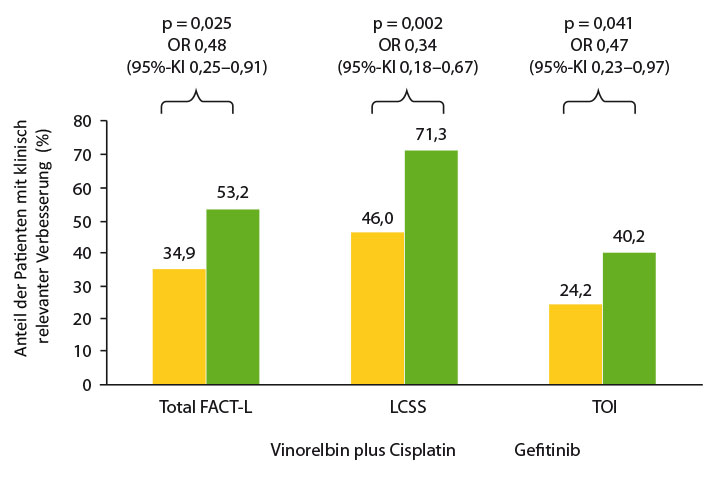
Es war nach median etwa dreijähriger Nachbeobachtung im Gefitinib-Arm signifikant verlängert – auf median 28,7 gegenüber 18 Monaten im Kontrollarm, so Yi-Long Wu, Guangzhou (Hazard Ratio 0,60; p = 0,005). Nach drei Jahren beträgt der absolute Unterschied 7% (34% unter Gefitinib versus 27% unter der Chemotherapie; p = 0,013). In einer Subgruppenanalyse korrelierte ein positiver Lymphknotenstatus signifikant mit dem krankheitsfreien Überleben (p < 0,05). Neben dem positiven Effekt auf diesen Parameter wurden unter Gefitinib auch Nebenwirkungen vom Grad ≥ 3 um den Faktor 4 reduziert (12,3% vs. 48,3%; p < 0,001), was sich in einer klinisch relevanten Verbesserung der gesundheitsbezogenen Lebensqualität äußerte (Abb. 1). Es wurden unter dem TKI keine interstitiellen Lungenerkrankungen beobachtet, sodass er sich nach Ansicht von Wu und Kollegen als eine bedeutsame adjuvante Therapieoption bei diesen Patienten empfiehlt.
Diese Daten wurden jedoch kritisch diskutiert: Der Standard des Stagings mittels PET-CT wurde bei der in China durchgeführten Studie nicht eingehalten, sodass vermutlich auch Patienten in der metastasierten Situation eingeschlossen wurden. Das würde erklären, warum die DFS-Kurven kein Plateau erreichen, was in einer kurativen Situation eigentlich zu erwarten wäre. Schließlich liegen keine Überlebensdaten vor. Daher kann derzeit eine adjuvante EGFR-TKI-Therapie bei EGFR-mutierten Patienten nicht empfohlen werden. Weitere Studien werden derzeit in dieser Indikation durchgeführt, deren Ergebnis abzuwarten bleibt.
Salvagetherapie nach Versagen einer stereotaktischen Radiotherapie
Die stereotaktische ablative Radiotherapie ist ein Pfeiler der kurativ intendierten Behandlung inoperabler Patienten mit frühem NSCLC (Stadium I–II): In einer kleinen Metaanalyse war sie der Operation mit 3-Jahres-Überlebensraten von 95% versus 79% (HR 0,14; p = 0,037) signifikant überlegen. Allerdings entwickelt etwa jeder vierte Patienten nach der Strahlentherapie ein Rezidiv, bei jedem siebten ist das aber lokal oder regional begrenzt. Wie sich die weitere Behandlung dieser Patienten üblicherweise gestaltet und wie ihre Prognose ist, wollten Kollegen am M. D. Anderson Cancer Center in Houston wissen; sie fanden in ihren Akten unter 772 solchen Patienten, die zwischen 2004 und 2014 stereotaktisch bestrahlt worden waren, 34 mit einem isolierten lokalen und 41 mit einem regionalen Rezidiv; 569 Patienten haben bislang krankheitsfrei überlebt [4]. Die Salvagetherapie der rezidivierten Patienten bestand in einer Operation (20% bei lokalem, 2% bei regionalem Rezidiv), einer Re-Bestrahlung (24% bzw. 17%), einer Radiofrequenzablation (15% bzw. 0%), einer Chemotherapie (15% bzw. 26%) oder einer Chemoradiotherapie (6% bzw. 44%).
Von den Patienten mit Lokalrezidiven, die eine solche Salvagetherapie erhalten hatten, lebten nach fünf Jahren noch 45,2%, von denen mit regionalen Rezidiven 42,9%, während von denjenigen, die nicht mehr behandelt worden waren, kein einziger mehr am Leben war, so Eric Brooks, Houston (p = 0,009). Die Patienten ohne ein Rezidiv wiesen eine 5-Jahres-Überlebensrate von 53,5% auf, die sich nicht signifikant von den Raten der mit einer Salvagetherapie behandelten Patienten unterschied.
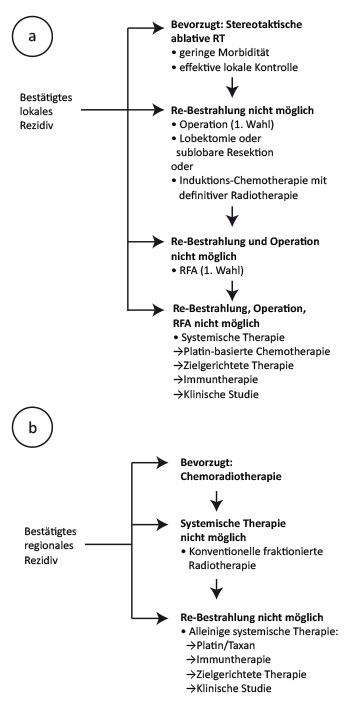
Die stereotaktische Radiotherapie beim frühen NSCLC ist also ein hochgradig kurativer Ansatz, so die erste Schlussfolgerung der Autoren. Die zweite: Im Fall eines lokalen oder regionalen Rezidivs lohnt sich eine aggressive Salvage-Strategie, für die sie einen Algorithmus anbieten (Abb. 2). Für die Zukunft sehen sie eine Kombination aus wiederholter stereotaktischer Bestrahlung und einer Immuntherapie mit dem Checkpoint-Inhibitor Nivolumab als eine weitere mögliche Option, die bereits in einer randomisierten Phase-II-Studie getestet wird [5].
Stadium III: prophylaktische kranielle Bestrahlung
Wenn ein NSCLC, das bei Diagnose ein Stadium III hatte, nach der Primärtherapie rezidiviert, ist in 15–40% aller Fälle zuerst das Hirn von der Metastasierung betroffen. Das Risiko dafür soll durch eine prophylaktische Bestrahlung ungefähr genauso stark reduziert werden wie beim kleinzelligen Lungenkarzinom mit „Limited Disease“, aber exakte Daten dazu gibt es für Patienten, die mit modernen Methoden der Thoraxchirurgie und der Radiochemotherapie behandelt werden, nicht. In einer niederländischen Phase-III-Studie wurden daher 175 Patienten mit Stadium-III-NSCLC randomisiert, nachdem sie eine zeitgleiche oder sequenzielle Chemoradiotherapie erhalten hatten; eine Operation war gestattet, aber nicht obligat [6].
Die Patienten wurden je zur Hälfte entweder nur beobachtet oder prophylaktisch kraniell bestrahlt mit einer Dosis, die die behandelnden Ärzte auswählen konnten: 36 Gy in 18 Fraktionen oder 30 Gy in zwölf oder in zehn Fraktionen. Primärer Endpunkt war der Anteil der Patienten, die radiologisch nachweisbare und symptomatische Hirnmetastasen entwickelten (erhöhter Hirndruck, Kopfschmerzen, Nausea und Erbrechen, kognitive oder affektive Störungen, Krampfanfälle und fokale neurologische Symptome). Die Studie hätte mit den ursprünglich geplanten 300 Patienten genug statistische Power gehabt, um eine Abnahme um 17% durch die Bestrahlung nach zwei Jahren nachzuweisen.
Dass die Patientenzahl wegen schleppender Rekrutierung schließlich auf 175 reduziert werden musste, war kein Schaden, so Harry Groen, Groningen: Nach einem medianen Follow-up von mittlerweile vier Jahren fanden sich im Kontrollarm bei 28,4% der Patienten symptomatische Hirnfiliae, im Bestrahlungsarm hingegen nur bei 4,6% (p < 0,00001); bei den radiologisch nachweisbaren Metastasen waren es 29,7% gegenüber 8,1%. Beim Gesamtüberleben ist der Unterschied mit median 24,2 gegenüber 21,9 Monaten bisher nicht signifikant. Die Lebensqualität hatte sich nach drei Monaten im Bestrahlungsarm verschlechtert (p = 0,02), aber das war danach rasch reversibel. Allerdings war die Zeit bis zum Auftreten neurologischer Symptome im Bestrahlungsarm nicht signifikant besser als im Beobachtungsarm, was mit der Toxizität der Strahlentherapie zusammenhängt.
Ein Problem bleiben weiterhin die extrakraniellen Metastasen, die im Bestrahlungsarm fast so häufig auftraten wie im Kontrollarm. Bevor eine generelle Empfehlung für die Radiotherapie-Prophylaxe ausgesprochen werden kann, so der Diskutant Suresh Senan, Amsterdam, müssten weitere Auswertungen der Studie abgewartet werden, etwa zur Frage, ob die auftretenden Hirnmetastasen mit dem Cyberknife behandelbar sind – was bei bis zu vier gleichzeitig vorliegenden Metastasen heute der Standard wäre. Außerdem sollten Metaanalysen durchgeführt werden, in die auch Daten aus anderen Studien zu dieser Thematik eingehen. Daher kann derzeit im Stadium III eine prophylaktische kranielle Bestrahlung – im Gegensatz zum kurativ behandelten SCLC – nicht empfohlen werden.
Nivolumab neoadjuvant beim frühen NSCLC?
Die systemische Therapie des resektablen NSCLC hat sich in den letzten zehn Jahren kaum verändert, aber sie könnte durch die Entwicklungen der vergangenen Jahre beim fortgeschrittenen NSCLC jetzt befruchtet werden: Dort können Immuncheckpoint-Inhibitoren bei einem Teil der Patienten tiefe und lang andauernde Remissionen induzieren. Für eine Gruppe US-amerikanischer Onkologen war das Anlass, die neoadjuvante Gabe des PD-1-
Inhibitors Nivolumab bei Patienten mit neu diagnostiziertem NSCLC der Stadien I–IIIA zu testen [7]. Die präoperative Behandlung früher Stadien bietet außerdem die Möglichkeit, die Wirkmechanismen der eingesetzten Medikamente an dem hinterher entfernten Tumor zu studieren, wie das beim frühen Mammakarzinom seit vielen Jahren genutzt wird.
Die Kollegen am Memorial Sloan Kettering Cancer Center in New York behandelten dazu bisher 22 Patienten mit NSCLC der Stadien I–IIIA zunächst mit zwei Dosen von 3 mg/kg Nivolumab im Abstand von vier Wochen. Von 21 Patienten konnte bei 20 der Tumor anschließend reseziert werden, und dabei ergab sich keine Verzögerung der Operation durch die vorhergehende systemische Therapie, so Jamie Chaft, New York. Bei neun Patienten (43%) zeigte sich ein starkes pathologisches Ansprechen auf die neoadjuvante Therapie, definiert als ein Rückgang des Anteils lebender Tumorzellen im Resektat auf weniger als 10% der Ausgangswerte ([8,9]; Abb. 3). Das korreliert nicht direkt mit dem radiologischen Remissionsstatus nach RECIST: Hier waren lediglich zwei partielle Remissionen und 18 Krankheitsstabilisierungen zu erkennen. Nach median neun Monaten Follow-up sind 18 Patienten (86%) rezidivfrei am Leben.
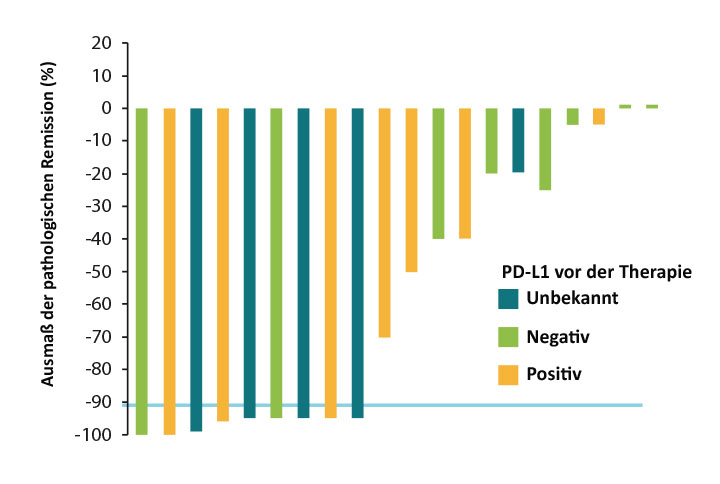
Begleitende molekularbiologische Untersuchungen zeigten, dass die Mutationslast des Tumors vor Therapie und die dadurch vorhergesagte Beladung mit Neoantigenen mit dem Ausmaß des pathologischen Ansprechens korrelierte, nicht aber mit der PD-L1-Expression (Abb. 3). Außerdem schien der Checkpoint-Inhibitor die Infiltration des Tumors mit PD-1- und CD8-positiven T-Lymphozyten und die Expansion von T-Zellen gegen mutationsassoziierte Neoantigene im peripheren Blut zu induzieren. Diese Ergebnisse sind sehr ermutigend, so Chaft; eine pathologisch komplette Remission bei 43% der Patienten lässt sich mit einer platinbasierten neoadjuvanten Chemotherapie nicht erreichen.
Anne Tsao, Houston, betonte in ihrer Diskussion des Vortrags vor allem die hier erbrachte Evidenz für eine prognostische Rolle der Mutationslast und anderer molekularer Marker wie der Beladung mit Neoantigenen. Möglicherweise könnten sich diese Parameter auch als prädiktive Biomarker für die Behandlung mit Checkpoint-Inhibitoren erweisen [10]; aber um solche Zusammenhänge valide nachzuweisen, seien noch viele Forschungsanstrengungen erforderlich. Ein Problem bleibe außerdem weiterhin die intratumorale Heterogenität von Veränderungen [11]; deshalb könnte es sinnvoll sein, verschiedene Regionen des Primärtumors zu untersuchen, was die pathologische Aufarbeitung natürlich deutlich verkomplizieren würde.
Fortgeschrittenes NSCLC: Kinase-Inhibitoren
Osimertinib wirksamer bei zerebralen Metastasen als Chemotherapie
Beim NSCLC wurde in den vergangenen zwei Jahrzehnten eine Vielzahl von Treibermutationen gefunden, die ihrerseits potenzielle Angriffspunkte für zielgerichtete Therapien darstellen. Das erste derartige Ziel waren aktivierende Mutationen im Rezeptor für den epidermalen Wachstumsfaktor (EGFR), bei deren Vorliegen eine Verlängerung des Überlebens mit spezifischen EGFR-Tyrosinkinase-Inhibitoren (TKI) möglich ist. Es gibt inzwischen eine ganze Reihe solcher Inhibitoren, die sich in verschiedenen klinischen Situationen unterschiedlich wirksam gezeigt haben; eine Herausforderung war lange Zeit die Mutation T790M im EGFR-Gen, die auf keinen der herkömmlichen Hemmstoffe ansprach.
Speziell für diese Situation wurde der selektive EGFRT790M-Inhibitor Osimertinib entwickelt, der als bisher einzige Substanz bei solchen Tumoren wirksam ist. Da Hirnmetastasen beim NSCLC häufig auftreten, war es zunächst interessant, dass Osimertinib im Tierversuch die Blut-Hirn-Schranke passieren konnte, und in einer gepoolten Analyse von zwei Phase-II-Studien deutete sich auch eine klinische Wirksamkeit bei ZNS-Befall an [12]. Die ersten Daten aus der randomisierten Phase-III-Studie AURA3 konnte nun in Chicago Tony Mok, Hongkong, zeigen [13]:
In dieser Studie wurden Patienten mit T790M-positivem NSCLC, die unter einer vorhergehenden TKI-Therapie progredient gewesen waren, im Verhältnis 2 : 1 randomisiert, entweder 80 mg/d Osimertinib oder sechs dreiwöchige Zyklen einer platinbasierten Chemotherapie-Doublette zu erhalten. Patienten mit stabilen, asymptomatischen Hirnmetastasen konnten ausdrücklich mit in die Studie eingeschlossen werden. Eine erste, vorab geplante Subgruppenanalyse von 46 dieser Patienten, die zu Beginn mindestens eine radiologisch messbare Hirnmetastase aufgewiesen hatten, zeigte unter Osimertinib eine Ansprechrate von 70% gegenüber nur 31% unter der Chemotherapie (OR 5,13; p = 0,015). In einer größeren Population, die auch Patienten mit nicht messbaren Hirnfiliae enthielt, waren die Werte mit 40% versus 17% insgesamt niedriger (OR 3,24; p = 0,014), aber auch hier konnte die progressionsfreie Überlebensdauer durch den Drittgenerations-TKI mit 11,7 versus 5,6 Monaten verdoppelt werden (HR 0,32; p = 0,004). Das Ansprechen auf Osimertinib war unabhängig davon, ob die Hirnmetastasen der betreffenden Patienten vorher bestrahlt worden waren oder nicht, und eine Aktivität des Inhibitors war ebenso bei den Patienten zu sehen, die zu Beginn leptomeningeale Metastasen aufgewiesen hatten.
Neuer Erstlinien-EGFR-Inhibitor?
In einer weiteren, auch von Tony Mok vorgestellten Phase-III-Studie (ARCHER 1050) musste sich die Erstgenerations-Substanz Gefitinib in der Erstlinie head-to-head mit dem neuen, irreversiblen EGFR-Inhibitor Dacomitinib messen, der in einer einarmigen Phase-II-Studie mit Ansprechraten von 75% und einem medianen progressionsfreien Überleben von
18 Monaten aufwarten konnte [14]. In der Phase-II-Studie LUX-Lung 7 hatte bereits Afatinib (ein Zweitgenerations-TKI) gegenüber Gefitinib einen signifikanten Vorteil bei Ansprechrate, PFS und Zeit bis zur nächsten Therapie (TTF) gezeigt. In dieser ersten Phase-III-Studie mit der Fragestellung eines Vergleichs zwischen Erst- und Zweitgenerations-TKI wurden 452 Patienten mit NSCLC und aktivierenden EGFR-Mutationen randomisiert, Dacomitinib (45 mg/d) oder Gefitinib (250 mg/d) bis zur Progression zu erhalten [15].
Beim primären Endpunkt progressionsfreies Überleben (verblindet von unabhängigen Gutachtern bestimmt) begannen die beiden Kaplan-Meier-Kurven sich bereits nach sechs Monaten zu trennen, und sind auch noch nach zwei Jahren deutlich getrennt mit Raten von 30,6% für Dacomitinib und 9,6% für Gefitinib. Die Medianwerte lagen bei 14,7 versus 9,2 Monaten (HR 0,59; p < 0,0001). Die bessere Wirkung auf das progressionsfreie Überleben (wo der Wert von 14,7 Monaten zu den höchsten jemals bestimmten gehört) scheint nicht durch ein besseres Ansprechen bedingt (hier unterschieden sich die Raten mit 74,9% versus 71,6% kaum), sondern durch eine längere Dauer der Remissionen im Dacomitinib-Arm mit median 14,8 versus 8,3 Monaten (p < 0,0001). Zum Gesamtüberleben sind derzeit noch keine Aussagen möglich, so Mok.
Unter Dacomitinib traten häufiger Diarrhö, Hautausschlag und Mukositis auf, unter Gefitinib hepatische Nebenwirkungen; Dosisreduktionen waren bei Dacomitinib deutlich häufiger erforderlich. Da aber die von den Patienten selbst berichteten Verbesserungen von Symptomen in beiden Armen ähnlich ausfielen, ist Dacomitinib laut Mok als eine neue Option in der Erstlinientherapie des
EGFR-mutierten NSCLC anzusehen. Die Daten unterstreichen die höhere Wirksamkeit von Zweit- gegenüber Erstgenerations-TKI, bei allerdings erhöhter, jedoch behandelbarer Toxizität.
Neuer ALK-Inhibitor Lorlatinib auch im ZNS wirksam
Die zweite Gruppe von Mutationen, die beim NSCLC zur Therapie klinisch nutzbar gemacht werden konnte, waren onkogene Mutationen und Fusionen der anaplastischen Lymphomkinase (ALK) und der ROS1-Kinase. Zu deren Hemmung wurden Inhibitoren entwickelt, von denen bisher Crizotinib (in der Erstlinie und auch bei ROS1-positiven Tumoren), Ceritinib und Alectinib (jeweils nach Crizotinib-Vorbehandlung und nur bei ALK-positiven Tumoren) zugelassen sind. Eine Substanz der nächsten Generation, Lorlatinib, das ALK ebenso wie ROS1 hemmt, hat in einer Phase-I-Studie bei Patienten mit diesen Mutationen (von denen die meisten Hirnmetastasen hatten) Aktivität demonstriert. Die Studie wurde deshalb in die Phase II überführt, in der die Patienten ebenfalls asymptomatische ZNS-Metastasen (behandelt oder unbehandelt) haben durften. Sie wurden in Abhängigkeit von der Vorbehandlung in vier Kohorten eingeteilt (s. Tab. 1; [16]). Ko-primäre Endpunkte waren die Gesamtansprechraten insgesamt sowie intrakraniell, die durch ein unabhängiges Gremium bestimmt wurden.
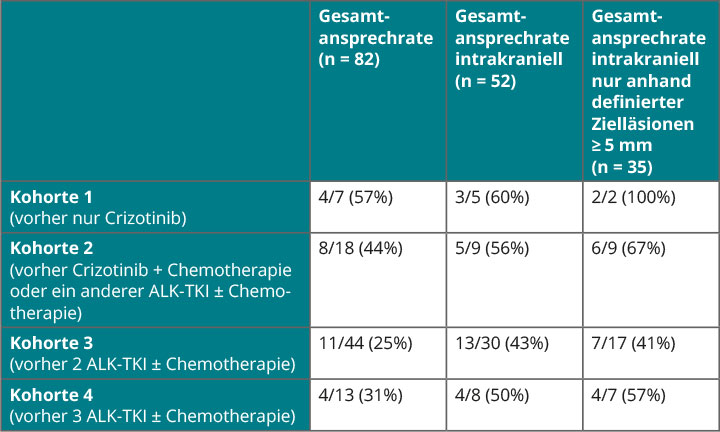
Von bislang 116 eingeschlossenen Patienten waren 82 bezüglich der Wirksamkeit auswertbar, so Alice Shaw, Boston, davon konnte wiederum bei 52 das intrakranielle Ansprechen insgesamt beurteilt werden. Bei 35 Patienten, die vorher keine Radiotherapie erhalten hatten bzw. nicht nach einer solchen progredient gewesen waren, lagen zerebrale Zielläsionen von mindestens 5 mm Durchmesser vor, die einzeln radiologisch bewertet werden konnten. Wie Tabelle 1 verdeutlicht, zeigte Lorlatinib eine beeindruckende Aktivität, die sich vor allem bei den definierten intrakraniellen Zielläsionen in hohen Ansprechraten manifestierte.
Bei allen bisher eingeschlossenen 116 Patienten waren die häufigsten durch die Behandlung bedingten Nebenwirkungen eine Hypercholesterinämie (90%) und eine Hypertriglyzeridämie (72%), in jeweils 17% der Fälle vom Grad 3 oder 4. Angesichts der teilweise extrem starken Vorbehandlung der Patienten sind die Ergebnisse überzeugend, so Frau Shaw. Allerdings sind die Ansprechraten in den Kohorten 3 und 4 im Gegensatz zu den Kohorten 1 und 2 deutlich niedriger, trotz einer Wirksamkeit gegenüber allen bekannten Resistenzmutationen.
ALK-positives NSCLC: neuer Erstlinien-Standard?
Ebenfalls von Alice Shaw wurden die ersten Ergebnisse der Phase-III-Studie ALEX vorgestellt, in der der neue ALK-Inhibitor Alectinib den bisherigen Erstlinienstandard Crizotinib in der Erstlinientherapie des ALK-mutierten NSCLC herausforderte [17]; zeitgleich mit dem Vortrag in Chicago wurden die Resultate auch online publiziert [18]. Vorausgegangen waren Studien, in denen der Zweitgenerations-Inhibitor höhere Ansprechraten als Crizotinib und bemerkenswert lange progressionsfreie Zeiten gebracht hatte sowie die randomisierte J-ALEX-Studie mit einem vergleichbaren Design, in der Alectinib in der Dosierung von 300 mg zweimal täglich bei japanischen Patienten wirksamer gewesen war als Crizotinib [19, 20]. In der globalen ALEX-Studie nun hatten 303 Patienten randomisiert zweimal täglich 600 mg Alectinib oder zweimal täglich 250 mg Crizotinib erhalten. Asymptomatische ZNS-Metastasen waren auch hier kein Ausschlusskriterium, und alle Patienten unterzogen sich einer systematischen kraniellen Bildgebung.
Primärer Endpunkt war das durch die Prüfärzte bestimmte progressionsfreie Überleben, und hier war Alectinib mit einer Reduktion des Risikos für Progression oder Tod um mehr als die Hälfte deutlich und hochsignifikant überlegen: Die mediane Dauer des progressionsfreien Überlebens ist unter der Zweitgenerations-Substanz noch nicht erreicht, unter Crizotinib lag sie bei 11,1 Monaten, so Shaw (HR 0,47; p < 0,0001; Abb. 4a). Auch bei den wichtigsten sekundären Endpunkten wie dem durch unabhängige Experten bestimmten progressionsfreien Überleben (HR 0,50; p < 0,0001) und vor allem bei der Zeit bis zur Progression im ZNS war Alectinib deutlich überlegen: Ein ZNS-Rezidiv war im Crizotinib-Arm nach einem Jahr mehr als viermal häufiger mit einer Hazard Ratio von 0,16 (p < 0,0001; Abb. 4b). Beim Gesamtüberleben fiel die Hazard Ratio zwar mit 0,76 auch bereits sehr günstig aus, aber bei insgesamt erst 25% verstorbenen Patienten war das noch nicht signifikant (p = 0,24).
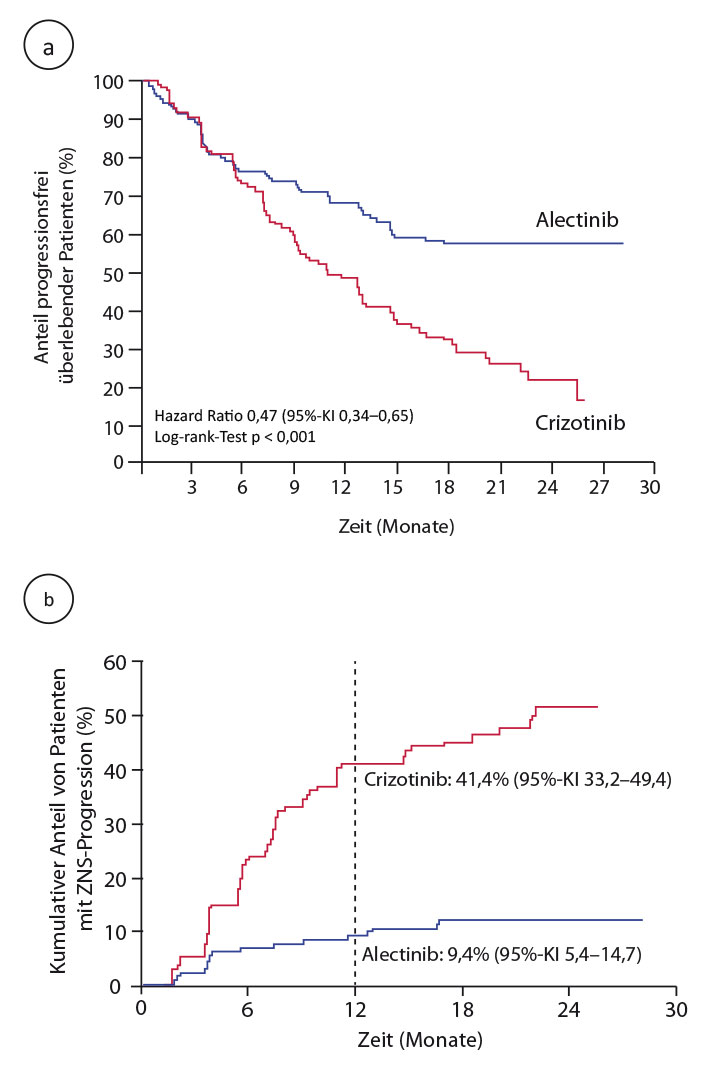
Alectinib schien auch etwas verträglicher zu sein als Crizotinib mit einer Rate an Grad-3/4-Nebenwirkungen von 41% versus 50% und 3% versus 5% Todesfällen durch unerwünschte Ereignisse. In eine ähnliche Richtung wiesen die Raten an Dosisreduktionen, Unterbrechungen und Therapiestopps.
Diese deutlich bessere Wirksamkeit spricht dafür, so Shaw, dass die Erstlinienbehandlung mit Alectinib einer sequenziellen Therapie mit Crizotinib, gefolgt von Alectinib, überlegen sein dürfte. Ihrer Ansicht nach und auch nach dem Urteil des Diskutanten Sanjay Popat, London, ist Alectinib damit als optimale Erstlinientherapie für das fortgeschrittene ALK-positive NSCLC etabliert [17] – eine Schlussfolgerung, die so dezidiert in der Publikation im New England Journal of Medicine noch nicht vertreten wird [18]. Popat wies auch darauf hin, dass Alectinib bei vorliegenden Hirnmetastasen wirksamer als Crizotinib ist und in Abwesenheit solcher Metastasen neuroprotektiv zu sein scheint: Dadurch würde die Rolle einer primären kraniellen Radiotherapie bei diesen Patienten infrage gestellt werden. Eine offene Frage ist die Behandlung nach Alectinib-Versagen; vermutlich wird hier die Testung auf potenzielle Resistenzmutationen von ALK eine zunehmende Rolle spielen.
Fortgeschrittenes NSCLC: Immuntherapien
KEYNOTE-024: Pembrolizumab langfristig wirksam
Dass eine Immuntherapie mit dem Checkpoint-Inhibitor Pembrolizumab beim NSCLC bereits in der Erstlinie angewendet werden kann, geht auf die Studie KEYNOTE-024 zurück, in der gezeigt werden konnte, dass diese Therapie progressionsfreies (HR 0,50; p < 0,001) und Gesamtüberleben (HR 0,60; p = 0,005) von Patienten ohne therapierbare Treibermutation gegenüber einer Chemotherapie-Doublette signifikant verlängert, wenn sich bei ihnen eine PD-L1-Expression in mindestens 50% der Tumorzellen nachweisen lässt [21]. Um zu sehen, wie sich die Erstlinientherapie auf den Verlauf unter Folgetherapien auswirkt, wurde als exploratorischer Endpunkt nun das PFS2 ausgewertet, d. h. die Zeit zwischen der ursprünglichen Randomisierung für die Erstlinientherapie und dem Eintritt einer Progression oder des Todes nach der folgenden Zweitlinienbehandlung. Das PFS2 ist auch von der EMA als Endpunkt anerkannt.
Das erste interessante Ergebnis nach median 19 Monaten Follow-up, das Julie Brahmer, Baltimore, in Chicago präsentieren konnte [22]: Nur 31,2% der
154 Patienten im Pembrolizumab-Arm hatten bereits eine Zweitlinientherapie erhalten, während es von den 151 im Kontrollarm mit 64,2% etwa doppelt so viele waren. Der Medianwert des PFS2 liegt unter Pembrolizumab bei 18,3, im Kontrollarm bei 8,4 Monaten. Nach zwölf Monaten waren unter Pembrolizumab 59,7% der Patienten frei von einer zweiten Progression, nach Chemotherapie 38,5%; die entsprechenden 18-Monats-Werte lagen bei 51% versus 24,6% (HR 0,48; p < 0,001). 36% der Patienten im Verumarm erhielten immer noch Pembrolizumab oder wurden nur beobachtet, ohne dass eine Zweitlinienbehandlung nötig gewesen wäre. Auch beim Gesamtüberleben ist Pembrolizumab weiterhin signifikant überlegen, mit einer 12-Monats-Überlebensrate von 70,3% gegenüber 54,8% und 18-Monats-Werten von 61,2% versus 43,0% (HR 0,63; p = 0,003)
Bei weiterhin guter Verträglichkeit bestätigen diese Daten die herausragende Rolle, die Pembrolizumab in der Initialtherapie des NSCLC ohne behandelbare Treibermutation spielt.
Kleinzelliges Lungenkarzinom
Beim kleinzelligen Lungenkarzinom (SCLC) gab es in den letzten Jahren erheblich weniger positive Nachrichten als beim NSCLC. Drei Abstracts zum SCLC waren beim diesjährigen ASCO-Kongress erwähnenswert:
Die Phase-I/II-Studie CheckMate-032, in der eine Immuntherapie mit Nivolumab ± Ipilimumab bei verschiedenen soliden Tumoren getestet wurde, enthielt auch eine Kohorte von Patienten mit fortgeschrittenem und nach einer platinbasierten Chemotherapie progredientem SCLC [31]. Sie erhielten Nivolumab entweder alleine (3 mg/kg alle zwei Wochen) oder in Kombination mit Ipilimumab (dann viermal Nivolumab 1 mg/kg und Ipilimumab 3 mg/kg im dreiwöchigen Abstand, anschließend Nivolumab wie in der Monotherapie-Kohorte), wobei der Vergleich in einer Expansionskohorte randomisiert erfolgte. Die Ansprechrate lag im Monotherapie-Arm bei 11%, im Kombinationsarm bei 25%. Im Kombinationsarm war das Ansprechen unabhängig von der Platinsensitivität, während die Monotherapie bei Platinresistenz schlechter abzuschneiden schien. Auch das Gesamtüberleben fiel im Kombinations-Arm mit median 7,8 versus 4,1 Monaten länger aus, allerdings waren hier auch Grad-3/4-Nebenwirkungen (33% vs. 14%) und therapiebedingte Abbrüche (11% vs. 5%) etwa doppelt so häufig. Derzeit laufen zwei Phase-III-Studien: In CheckMate-331 wurden Patienten im ersten Rezidiv nach Chemo- oder Radiochemotherapie mit Nivolumab oder einer Chemotherapie (Topotecan oder Amrubicin) behandelt; die Rekrutierung ist hier abgeschlossen [32]. In CheckMate-451 werden Patienten mit „Extensive Disease“-SCLC, die nach vier Zyklen einer platinhaltigen Chemotherapie mindestens eine Krankheitsstabilisierung aufweisen, für eine Art Konsolidierungs- oder Erhaltungstherapie zwischen Nivolumab, Nivolumab und Ipilimumab oder Placebo randomisiert [33]. In beiden Studien werden bzw. wurden auch Patienten in Deutschland eingeschlossen.
Die deutlich geringere Aktivität einer Nivolumab-Monotherapie in CheckMate-032 spiegelt sich gewissermaßen auch in den Ergebnissen einer Phase-II-Studie, in der
45 Patienten mit fortgeschrittenem SCLC eine Erhaltungstherapie mit dem PD-1-Inhibitor Pembrolizumab über maximal zwei Jahre erhielten [34]. Das progressionsfreie Überleben nach RECIST 1.1 war mit median 1,4 Monaten enttäuschend, nach den für Immuntherapien modifizierten Kriterien mit 4,7 Monaten deutlich länger. Wirklich beeindruckend war aber das Gesamtüberleben, das mit median 9,4 Monaten höher zu liegen schien als in historischen Kollektiven. Bemerkenswerterweise zeigte das progressionsfreie Überleben eine negative Korrelation mit der Konzentration von im Blut zirkulierenden Tumorzellen vor Beginn der Erhaltungstherapie, und auch die PD-L1-Expression an der Grenzfläche zwischen Tumor und Stroma scheint einen Einfluss vor allem auf das progressionsfreie Überleben zu haben.
PARP-Inhibitor beim SCLC?
Einen anderen Ansatz verfolgt die ECOG-ACRIN-Studiengruppe in einer randomisierten Studie: Beim SCLC findet man eine erhöhte Expression von Enzymen der Poly(ADP)-Ribose-Polymerase(PARP)-Familie, die sich an der DNA-Reparatur beteiligen und dadurch Resistenzen gegen Chemotherapien fördern. Diese PARP-Enzyme können mittlerweile mit spezifischen Inhibitoren gehemmt werden – ein Vorgehen, das beim Ovarialkarzinom bereits in der Klinik angekommen ist. In der ECOG-ACRIN-Studie erhielten 128 Patienten mit nicht vorbehandeltem „Extensive Disease“-SCLC eine Chemotherapie aus Cisplatin und Etoposid und dazu randomisiert entweder den PARP-Inhibitor Veliparib oder Placebo [35]. Beim primären Endpunkt progressionsfreies Überleben war mit Veliparib ein grenzwertig signifikanter Vorteil von median 6,1, versus 5,5 Monaten erkennbar (HR0,75; p = 0,06), nicht jedoch bisher beim Gesamtüberleben (10,3 vs. 8,9 Monaten; HR 0,83; p = 0,17). Besonders schienen Männer mit hohen Werten für die Laktatdehydrogenase mit einer Hazard Ratio für progressionsfreies Überleben von 0,34 zu profitieren (für die übrigen Patienten: HR 0,81). Diese Strategie, so die Autoren, wird sich höchstwahrscheinlich optimieren lassen, wenn es gelingt, anhand von Biomarkern diejenigen Patienten zu identifizieren, die den größten Nutzen von dem PARP-Inhibitor haben könnten. Derzeit rekrutiert eine globale randomisierte Phase-II-Studie, in der die Zugabe von Veliparib bzw. Placebo zu einer Chemotherapie aus Carboplatin und Etoposid getestet wird [36].
Checkpoint-Inhibitoren “beyond progression” einsetzen?
In der OAK-Studie, in der der PD-L1-Inhibitor Atezolizumab in der Zweit- oder Drittlinie beim NSCLC gegen Docetaxel geprüft worden war, hatte sich ein bemerkenswertes Phänomen gezeigt: Das Gesamtüberleben war durch die Immuntherapie signifikant von median 9,6 auf 13,8 Monate verlängert worden, ohne dass sich das in einem Anstieg der Ansprechraten oder des progressionsfreien Überlebens gespiegelt hätte [23]. Diese Verlängerung des Überlebens trotz möglicherweise sogar einer Progression nach den RECIST-1.1-Kriterien wird bei den neuen Immuntherapien häufiger gesehen und wird darauf zurückgeführt, dass es durch eine Infiltration der Tumorläsionen nicht zu einer Abnahme, eventuell sogar zu einer Zunahme von deren Volumen kommt. Radiologisch imponiert das als ein Progress, obwohl es im Tumor möglicherweise zu einer massiven Zerstörung von Krebszellen kommt. Es könnte daher sehr wohl sinnvoll sein, auch nach einer RECIST-Progression die Therapie nicht abzubrechen, wie das traditionell üblich ist.
Der Effekt einer solchen Weiterbehandlung wurde in der OAK-Studie untersucht, und die Resultate stellte beim ASCO-Kongress David Gandara, Sacramento, vor [24]. Von den 332 Patienten im Atezolizumab-Arm hatten 168 (51%) Atezolizumab auch nach Auftreten einer Progression weitererhalten. Bei zwölf von ihnen (7% vom Gesamtkollektiv) stellte sich darunter doch noch eine Remission in einer Zielläsion ein (d. h. eine Reduktion um mindestens 30% vom Zeitpunkt der Progression an), bei 49% kam es zu einer Krankheitsstabilisierung (d. h. zu einer Größenzunahme um höchstens 20% oder einer Abnahme um höchstens 30%). Die mediane Überlebenszeit nach Auftreten der Progression lag für diese Patienten bei über einem Jahr, nämlich bei
12,7 Monaten, nach 18 Monaten lag die Überlebensrate bei 37%, während für Patienten, die eine andere Post-Progress-Therapie erhalten hatten, 20% und für die, die nicht weiterbehandelt worden waren, 9% bestimmt wurden. Im Docetaxel-Arm wirkte sich die Post-Progress-Therapie ebenfalls aus: Von den Patienten, die dafür eine Immuntherapie bekommen hatten, waren nach 18 Monaten noch 42% am Leben, von den übrigen lediglich 12%.
Die Verträglichkeit war beim Einsatz von Atezolizumab nach Progression eher besser als vorher: Die Nebenwirkungsrate insgesamt sank von 58,9% auf 36,3%, bei den Grad-3/4-Toxizitäten von 10,7% auf 6,0%. Dadurch, so Gandara, wird die Strategie, Checkpoint-Inhibitoren „beyond progression“ zu geben, um ihren Nutzen voll auszuschöpfen, zusätzlich unterstützt. Zugleich verstärkt sich der Eindruck, dass RECIST 1.1 keine adäquaten Kriterien mehr bietet, um diesen Nutzen im Fall einer Progression zu beurteilen.
Die Daten wurden von Solange Peters insofern kritisch diskutiert, als die Definition der Patienten sicherlich schwierig war. Ob es sich bei den meisten Patienten um Oligoprogression handelte, die mit einer lokalen Therapie behandelbar war unter Fortsetzung der bei den anderen Tumormanifestationen wirksamen Therapie, war nicht sicher zu beurteilen. Die Pseudoprogression ist bei den PD-1- und PDL-1-Inhibitoren eine Rarität, und bei einer eindeutigen Progression, die auch zu einer symptomatischen Verschlechterung des Patienten führt, sollten die Patienten auf eine alternative Therapie, z. B. eine Chemotherapie umgestellt werden.
ALK- und Ckeckpoint-Inhibitor kombinieren?
Die Entdeckung von Treibermutationen in vielen verschiedenen Tumorentitäten hat in den letzten 15 Jahren zu vielen neuen, zielgerichteten Therapien geführt, die wie zum Beispiel die ALK-Inhibitoren nur für einen zum Teil extrem eng begrenzten Kreis von Patienten anwendbar sind, weil Tumoren ohne die betreffende Mutation nicht darauf ansprechen. Die modernen Immuntherapien sind im Augenblick beim NSCLC zwar nur für Patienten zugelassen, die keine behandelbare Mutation aufweisen, aber es gibt keinen Grund anzunehmen, dass zum Beispiel ein PD-1-Antikörper bei ALK-positiven Tumoren nicht auch wirksam sein sollte. Im Gegenteil wurde bei solchen Tumoren im Tiermodell eine Induktion der Expression des PD-1-Liganden PD-L1 beobachtet. In einer globalen Phase-I-Studie wurde deshalb bei vorbehandelten oder therapienaiven Patienten mit ALK-positivem NSCLC eine Kombination aus dem ALK-Inhibitor Ceritinib und dem PD-1-Antikörper Nivolumab getestet [25].
Die vorläufigen Daten, die Enriqueta Felip, Barcelona, in Chicago zeigte, belegen eine Wirksamkeit des Regimes vor allem bei ALK-Inhibitor-naiven Patienten mit einer medianen progressionsfreien Überlebenszeit von 16,6 Monaten, aber auch eine nicht zu vernachlässigende Toxizität: Neben Erhöhungen von Leberenzymen werden vor allem mehr Hautausschläge als mit den einzelnen Substanzen gesehen. In einem Amendment wurde das Protokoll nun dahingehend geändert, dass zunächst zwei Zyklen Ceritinib als Monotherapie gegeben werden, die daraufhin mit Nivolumab in verschiedenen Dosierungen kombiniert werden soll.
Malignes Pleuramesotheliom
Immuntherapie auch beim Mesotheliom Erfolg versprechend
Das maligne Pleuramesotheliom ist ein seltener Tumor, der aber meist erst im fortgeschrittenen Stadium diagnostiziert wird und dann rasch progredient ist. Die seit fast eineinhalb Jahrzehnten einzige zugelassene Therapie ist die Kombination aus Cisplatin und Pemetrexed. Die Zugabe des VEGF-Inhibitors Bevacizumab konnte in einer Studie progressionsfreies und Gesamtüberleben verlängern, ist aber nicht zugelassen. Nintedanib, bisher zur Zweitlinientherapie von Adenokarzinomen der Lunge verwendet, hemmt die VEGF-Rezeptoren 1–3 sowie weitere onkologisch bedeutsame Signaltransduktionswege und hat sich in Tiermodellen des Mesothelioms als wirksam erwiesen. Es wurde deshalb in der Phase-II/III-Studie LUME-Meso in der Erstlinientherapie bei 87 Patienten mit inoperablem Mesotheliom mit Cisplatin/Pemetrexed kombiniert und randomisiert gegen die Kombination aus Chemotherapie und Placebo getestet [37]. Beim primären Endpunkt progressionsfreies Überleben zeigte sich vor allem bei Patienten mit epitheloiden Tumoren ein deutlicher Anstieg durch Nintedanib von median 5,7 auf
9,7 Monate (HR 0,49; p = 0,006), der sich auch beim Gesamtüberleben bemerkbar machte, aber hier nicht signifikant ausfiel (HR 0,70; p = 0,197). Auch objektive Ansprechraten, Dauer des Ansprechens und forcierte Vitalkapazität waren im Nintedanib- gegenüber dem Placeboarm verbessert.
Bei der Häufigkeit von Nebenwirkungen fand sich insgesamt kein Unterschied zwischen den Armen; was Toxizitäten vom Grad ≥ 3 angeht, waren unter Nintedanib vor allem Neutropenien (27,3% vs. 4,9%), Erhöhungen von ALT (11,4% vs. 0%) und GGT (6,8% vs. 0%) sowie Diarrhö (6,8% vs. 0%) stärker ausgeprägt. Therapieabbrüche durch Nebenwirkungen waren allerdings im Placeboarm häufiger (17,1% vs. 6,8%).
Eine Überlebensdauer von über 20 Monaten ist bei epitheloiden Mesotheliomen bisher beispiellos, so Nowak. Angesichts der geringen Patientenzahlen ist die fehlende statistische Signifikanz nicht von so großer Bedeutung, sodass die Rekrutierung für die Phase III derzeit aktiv verfolgt wird [38].
Für Patienten mit malignem Pleuramesotheliom, die nach der Erstlinien-Chemotherapie progredient sind, gibt es derzeit keine empfohlene Behandlungsoption. Da das Mesotheliom häufig einen inflammatorischen Phänotyp und die Expression von PD-L1 zeigt und in vorläufigen Untersuchungen PD1-Antikörper in der Zweit- und Drittlinie bessere Ergebnisse gebracht haben als die Behandlung mit dem CTLA-4-Antikpörper Ipilimumab, wurde der PD-1-Blocker Nivolumab in der multizentrischen französischen Phase-II-Studie MAPS-2 alleine oder in Kombination mit Ipilimumab getestet [39]. Primärer Endpunkt war die Krankheitskontrollrate nach zwölf Wochen, ermittelt durch unabhängige Gutachter.
Wie Arnaud Scherpereel, Lille, in Chicago berichtete, lag sie bei den ersten 54 Patienten unter Nivolumab alleine bei 44,4% und unter der Kombination bei 50%; die betreffenden Ansprechraten betrugen 18,5% bzw. 25,9%. Das mediane progressionsfreie Überleben lag bei 10,4 Monaten, beim Gesamtüberleben ist der Medianwert noch nicht erreicht.
Im Kombinationsarm traten drei therapiebedingte Todesfälle auf; ansonsten war die Behandlung gut handhabbar, und angesichts der vielversprechenden Überlebensdaten sind die Autoren zuversichtlich, dass Checkpoint-Inhibitoren bei diesem schwierig zu behandelnden Tumor eine neue therapeutische Ära einleiten könnten. Auch nach Ansicht der Diskutantin Anne Tsao, Houston, werden Checkpoint-Inhibitoren vermutlich die Therapiestandards beim Mesotheliom verändern, wenn erst längere Nachbeobachtungszeiten den Nutzen für das Überleben bestätigt haben und diejenigen Subpopulationen identifiziert worden sind, die am meisten von diesen Substanzen profitieren. Derzeit läuft bereits eine Vielzahl von Studien – viele von ihnen mit dem Einsatz von Checkpoint-Inhibitoren – bei dieser Indikation, darunter die Phase-III-Studie CheckMate-743, in der die Kombination aus Nivolumab und Ipilimumab in der Erstlinie gegen den bisherigen Standard aus Cisplatin und Pemetrexed antritt [40].
Weitere Mutationen
Weitere Mutationen beim NSCLC betreffen unter anderem den vom Mammakarzinom bekannten HER2-Rezeptor sowie den MET-Rezeptor. Während bei Patienten mit einer Überexpression von HER2 die Gabe des Immunkonjugats Trastuzumab Emtansin (T-DM1) in einer Phase-II-Studie nicht sehr erfolgreich zu sein schien [26], lag die Ansprechrate bei
18 Patienten mit HER2-Mutationen (ca. 2% aller NSCLC) bei mindestens 33%, was die Durchführung einer multizentrischen Studie rechtfertigt, so Bob Li, New York [27].
Exon-14-Skipping-Mutationen des MET-Gens: eine neue behandelbare Mutation
Bemerkenswert hingegen scheint die Wirkung bestimmter Inhibitoren bei Patienten zu sein, deren Tumoren Mutationen in Exon 14 des MET-Gens aufweisen. Es kodiert einen Rezeptor für den Hepatozyten-Wachstumsfaktor, und Exon-14-
Mutationen haben sich als neue mögliche Zielstruktur empfohlen, nachdem die immunhistochemische Bestimmung von MET-Veränderungen sich etwa im Fall des Antikörpers Onartuzumab nicht als Companion Diagnostic bewährt hat. Exon-14-
Mutationen treten bei ungefähr 3% aller NSCLC-Tumoren auf [28], und aufgrund von Fallberichten über dramatische Reaktionen auf Medikamente, die den Rezeptor inhibieren, sammelten Mark Awad, Boston, und Kollegen an zwölf Universitätskliniken retrospektiv die Daten von 148 Patienten mit Exon-14-Deletionen im MET-Gen. Das gleichzeitige Vorliegen anderer Treibermutationen war in dieser Kohorte selten [29].
Von verschiedenen Substanzen ist bekannt, dass sie auch den MET-Rezeptor hemmen (Crizotinib, Glesatinib, Capmatinib, ABBV-399). Für die 34 Patienten mit metastasierter Erkrankung, die niemals einen dieser Hemmstoffe erhalten hatten, war das Gesamtüberleben mit median
8,1 Monaten kurz, wenn gleichzeitig eine MET-Amplifikation vorlag, mit 5,2 Monaten noch kürzer. Hingegen überlebten die 27 metastasierten Patienten, die wenigstens einen der genannten Inhibitoren bekommen hatten, mit median 24,6 Monaten etwa dreimal so lang. In einem statistischen Modell, das auch berücksichtigte, ob der Inhibitor als Erst- oder Zweitlinientherapie eingesetzt worden war, betrug die Hazard Ratio für Überleben 0,11, d. h. das Mortalitätsrisiko schien durch eine solche Therapie um fast 90% reduziert zu werden.
Insbesondere bei Patienten mit NSCLC im Stadium IV, die keine Veränderungen von KRAS, EGFR, ALK, ROS1 und BRAF aufweisen, sollte bereits initial auf MET-Exon-14-Mutationen getestet werden, so Awad. Ob man im positiven Fall schon aufgrund dieser retrospektiv erhobenen Daten die sofortige Behandlung mit einem MET-Inhibitor erwägen sollte, wurde vom Diskutanten Patrick Ma, Morgantown, offengelassen. Die neue S3-Leitlinie in Deutschland befürwortet einen Off-
label-use bei Nachweis einer c-MET-
Exon-14-Skipping-Mutation; daher sollte dies mit dem Patienten und ggf. der Krankenkasse besprochen werden.
In einem ähnlichen Design identifizierten Joshua Sabari und Kollegen, New York, 81 Patienten mit MET-Exon-14-
Mutationen, die eine Immuntherapie mit einem Checkpoint-Inhibitor erhalten hatten [30]. Zwar wies durchaus ein Teil dieser Patienten eine hohe Expression von PD-L1 im Tumor auf, aber das Ansprechen auf die Inhibitoren war unabhängig von den PD-L1-Konzentrationen gering. Im Vergleich zu anderen NSCLC-Subtypen wiesen diese Tumoren eine eher geringere Mutationslast auf, so Sabari, und auch bei Patienten mit zahlreichen Mutationen zeigte sich keine Wirkung der Immuntherapie.
Literatur
1. Goss GD et al. J Clin Oncol 2013; 31: 3320-6.
2. Kelly K et al. J Clin Oncol 2015; 33: 4007-14.
3. Wu YL et al. ASCO 2017, Abstract #8500.
4. Brooks E et al. ASCO 2017, Abstract #8501.
5. ClinicalTrials.gov No. NCT03110978.
6. Groen HJM et al. ASCO 2017, Abstract #8502.
7. Chaft JE et al. ASCO 2017, Abstract #8508.
8. Pataer A et al. J Thorac Oncol 2012; 7: 825-32.
9. Hellmann MD et al. Lancet Oncol 2014; 15: e42-50.
10. Anagnostou et al. Cancer Discov 2017; 7: 264-76.
11. Jamal-Hanjani M et al. N Engl J Med 2017; 376: 2109-21.
12. Goss G et al. J Thoracic Oncol 2017; 12 (S1): S440 (WCLC 2016, Abstract #MA16.11).
13. Mok T et al. ASCO 2017, Abstract #9005.
14. Jänne PA et al. Lancet Oncol 2014; 15: 1433-41.
15. Mok T et al. ASCO 2017, Abstract #LBA9007.
16. Shaw AT et al. ASCO 2017, Abstract #9006.
17. Shaw AT et al. ASCO 2017, Abstract #LBA9008.
18. Peters S et al. N Engl J Med 2017, June 6 [prepub ahead of print, DOI 10.1056/NEJMoa1704795.
19. Seto T et al. Lancet Oncol 2013; 14: 590-8.
20. Tamura T et al. J Clin Oncol 2017; 35: 1515-21.
21. Reck M et al. N Engl J Med 2016; 375: 1823-33.
22. Brahmer JR et al. ASCO 2017, Abstract #9000.
23. Rittmeyer A et al. Lancet 2017; 389: 255-65.
24. Gandara D et al. ASCO 2017, Abstract #9001.
25. Felip E et al. ASCO 2017, Abstract #2502.
26. Stinchcombe T et al. ASCO 2017, Abstract #8509.
27. Li BT et al. ASCO 2017, Abstract #8510.
28. Awad MM et al. J Clin Oncol 2016; 34: 879-81.
29. Awad MM et al ASCO 2017, Abstract #8511.
30. Sabari JK et al. ASCO 2017, Abstract #8512.
31. Hellmann MD et al. ASCO 2017, Abstract #8503.
32. ClinicalTrials.gov No. NCT02481830.
33. ClinicalTrials.gov No. NCT02538666.
34. Gadgeel SM et al. ASCO 2017, Abstract #8504.
35. Owonikoko TK et al. ASCO 2017, Abstract #8505.
36. ClincalTrials.gov No. NCT02289690.
37. Nowak AK et al. ASCO 2017, Abstract #8506.
38. ClinicalTrials.gov No. NCT01907100.
39. Scherpereel A et al. ASCO 2017, Abstract #LBA8507.
40. ClinicalTrials.gov No. 02899299.

Prof. Dr. Frank Griesinger
Direktor der Klinik für Hämatologie und Onkologie, Universitätsklinik Innere Medizin
Onkologie-Koordinator Cancer Center
Oldenburg, Pius-Hospital
Georgstraße 12, 26121 Oldenburg
+49 441 229 1611
+49 441 229 1607
Frank.Griesinger[at]Pius-Hospital[dot]de

