Zielgerichtete Therapie des fortgeschrittenen Melanoms
Die Erkenntnis, dass Mutationen in bestimmten, für Wachstum oder Überleben der Zelle wichtigen Genen bzw. Proteinen für das maligne Verhalten von Tumoren essenziell sind, wurde zum ersten Mal bei der chronischen myeloischen Leukämie (CML) ausgenutzt: Die Entwicklung und Zulassung von Imatinib, einem spezifischen Inhibitor der in den CML-Zellen mutierten BCR-ABL-Tyrosinkinase, stellte die Therapie dieser Erkrankung auf eine völlig neue Basis. Seither wurden bei zahlreichen anderen malignen Erkrankungen solche Treibermutationen gefunden, und die Bemühungen, spezifische Inhibitoren gegen die betreffenden mutierten Proteine zu entwickeln, halten nach wie vor an.
Die bisher zugelassenen zielgerichteten Therapien des malignen Melanoms basieren auf der 2002 publizierten Erkenntnis, dass etwa die Hälfte aller Melanom-Erkrankungen eine aktivierende somatische Mutation im Gen für die BRAF-Kinase aufweist, einer zentralen Komponente des RAS/RAF/MEK/ERK (MAPK)-Signaltransduktionswegs [2]. Der MAP-Kinase-Signalweg wird bei Vorliegen solcher Mutationen, von denen die BRAF-V600E-Mutation die bei Weitem häufigste ist, konstitutiv aktiviert.
Als erste zielgerichtete Medikamente wurden daher Inhibitoren der mutierten BRAF-Kinase entwickelt. Der Nachweis der Wirksamkeit von Vemurafenib ([3] und Dabrafenib [4] beim metastasierten Melanom in klinischen Studien führte zur Zulassung durch die EMA (2012 für Vemurafenib und 2013 für Dabrafenib) für die Behandlung des BRAF-mutierten, nicht resezierbaren oder metastasierten malignen Melanoms.
Allerdings entwickeln die Tumoren früher oder später Resistenzen gegen die BRAF-Inhibitoren. Bei der molekularen Charakterisierung dieser Resistenzen zeigte sich, dass in der Mehrheit der Fälle der MAPK-Signalkaskade-Weg wieder aktiviert ist, was u. a. auf BRAF-Amplifizierungen, NRAS- oder MEK-Mutationen zurückzuführen ist. In drei großen klinischen Phase-III-Studien [5–7] konnte daraufhin gezeigt werden, dass Kombinationen von BRAF- und MEK-Inhibitoren (Vemurafenib und Cobimetinib bzw. Dabrafenib plus Trametinib) der alleinigen BRAF-Inhibition hinsichtlich Ansprechraten und progressionsfreiem und Gesamtüberleben signifikant überlegen sind, was zur Zulassung dieser beiden Kombinationen im Jahr 2015 geführt hat. Weil die Kombinationen bei Patienten, die unter einer Monotherapie mit einem BRAF-Inhibitor progredient sind, nicht mehr sehr wirksam sind [8], ist ihre Anwendung möglichst von Anfang an angezeigt.
Klinische Aktivität und Wirksamkeit
Die Zulassung der Kombinationen aus BRAF- und MEK-Inhibitoren beruht auf drei großen klinischen Phase-III-Studien, von denen zwei die Dabrafenib/Trametinib-Kombination gegen eine Monotherapie mit Dabrafenib (COMBI-d) bzw. Vemurafenib (COMBI-v) testeten, während die Kombination aus Vemurafenib und Cobimetinib gegen Vemurafenib alleine geprüft wurde (co-BRIM):
- In der COMBI-d-Studie waren
423 Patienten mit nicht vorbehandeltem BRAF-mutiertem metastasiertem Melanom randomisiert mit Dabrafenib/Trametinib oder mit Dabrafenib/Placebo behandelt worden. In der initialen Auswertung war der Vorteil beim progressionsfreien Überleben durch die Kombination zwar statistisch signifikant, aber relativ bescheiden ausgefallen (median 9,3 vs. 8,8 Monate; Hazard Ratio 0,75; p = 0,03; [9]). In einer weiteren Analyse mit einer medianen Nachbeobachtungszeit zwischen 16 und 20 Monaten hatte sich die Differenz zwischen beiden Armen beim progressionsfreien Überleben deutlich vergrößert (median 11,0 Monate unter der Kombination versus 8,8 Monate unter der Monotherapie;
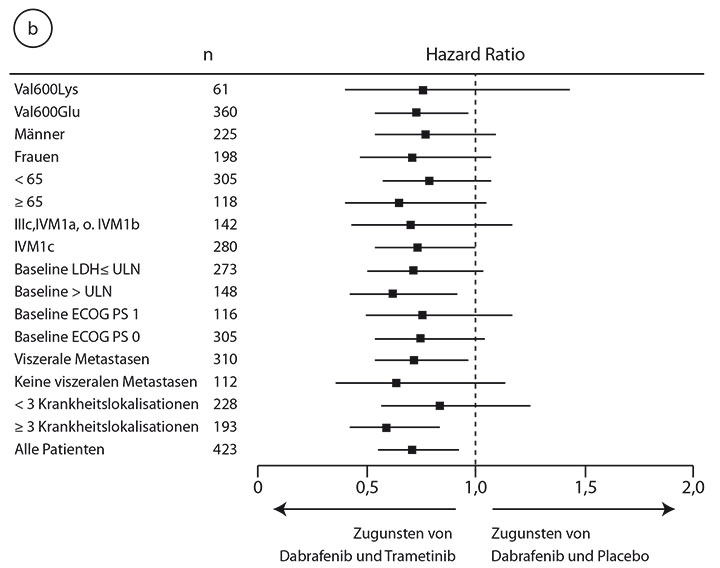
HR 0,67; p = 0,0004; [6]). Darüber hinaus war im Kombinationsarm hier auch das Gesamtüberleben bereits signifikant länger (median 25,1 vs. 18,7 Monate; HR 0,71; p = 0,0107). Die Überlebensraten nach einem und nach zwei Jahren lagen für die Kombinationstherapie bei 74% bzw. 51% und für die Monotherapie bei 68% bzw. 42% (Abb. 1a). Dieser Trend setzt sich auch nach drei Jahren mit Überlebensraten von 44% versus 32% weiter fort, wie eine aktualisierte Auswertung beim ASCO-Kongress 2016 zeigen konnte [10]. Der Vorteil der Kombination war für alle untersuchten Subgruppen vergleichbar (Abb. 1b; [6]).
- In der COMBI-v-Studie wurde die Kombination aus Dabrafenib und Trametinib ebenfalls in der Erstlinie mit dem anderen zugelassenen BRAF-Inhibitor Vemurafenib als Monotherapie verglichen. In der ersten Interimsanalyse nach median 10–11 Monaten Nachbeobachtungszeit hatte die Kombination bereits zu einer Verbesserung beim primären Endpunkt Gesamtüberleben geführt, wobei der Medianwert in der Kombinationsgruppe noch nicht erreicht worden war; im Vemurafenib-Arm errechnete er sich zu 17,2 Monaten mit 12-Monats-Überlebensraten von 72% versus 65% (HR 0,69; p = 0,005; [7]). In einer beim ESMO-Kongress im Herbst 2016 vorgestellten aktualisierten Analyse hatte sich der Überlebensvorteil mit Dabrafenib/Trametinib bei median 26,1 versus
17,8 Monaten stabilisiert (HR 0,68) mit 2- bzw. 3-Jahres-Überlebensraten von 53% versus 38% bzw. 45% versus 31% und entsprechenden progressionsfreien Überlebensraten von 30% versus 16% und 22% versus 12% [11]. Die Gesamtansprechrate betrug 67% im Kombinations- und 53% im Monotherapie-Arm mit 19% versus 12% kompletten Remissionen.
- In der co-BRIM-Studie waren ebenfalls unbehandelte Patienten mit fortgeschrittenem Melanom randomisiert worden, entweder die Kombination aus Vemurafenib und Cobimetinib oder Vemurafenib zusammen mit einem Placebo zu erhalten. Die Kombination mit dem MEK-Inhibitor resultierte hier ebenfalls in einer signifikanten Verlängerung von medianem Gesamt- (22,5 vs.
17,4 Monate; HR 0,70; p = 0,005) und progressionsfreiem Überleben (11,0 vs. 8,8 Monate; HR 0,58; p < 0,0001) und einer Erhöhung der Ansprechrate von 50% auf 70% [5, 12]. In der Phase-Ib-Studie BRIM7 waren BRAF-Inhibitor-naive Patienten ebenso mit Vemurafenib und Cobimetinib behandelt worden wie solche, die unter einer vorangegangenen Behandlung mit Vemurafenib progredient gewesen waren. Letztere schnitten bezüglich Gesamtüberleben mit median 8,5 Monaten erheblich schlechter ab als die nicht vorbehandelten mit median 31,2 Monaten [12].
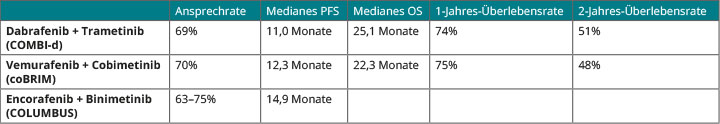
Es gibt bislang keine direkten Vergleichsstudien zwischen den beiden Kombinationsregimes, aber die Ergebnisse der drei Phase-III-Studien lassen vermuten, dass Vemurafenib/Cobimetinib und Dabrafenib/Trametinib ähnlich wirksam sind. Dass die Überlebenszeiten in der co-BRIM-Studie etwas kürzer ausfielen als in den COMBI-Studien, könnte an einem höheren Anteil an Patienten mit erhöhten Konzentrationen an Laktatdehydrogenase (LDH) liegen (co-BRIM: 46%; COMBI-d bzw. COMBI-v: 34–36%). Die LDH-Titer bei Therapiebeginn sind nämlich ein bekannter ungünstiger Prognosefaktor beim metastasierten Melanom. Auch in den drei Phase-III-Studien mit den BRAF-/MEK-Inhibitor-Kombinationen waren sowohl progressions- als auch Gesamtüberleben bei diesen Patienten durchweg kürzer als bei denen mit normalen LDH-Werten [5–7, 10–12]: Von den Patienten mit normalen LDH-Konzentrationen war nach drei Jahren etwa die Hälfte noch am Leben, 30% sogar progressionsfrei. Mit rund zwei Dritteln bzw. 40% waren diese Werte sogar noch besser bei den Patienten, die neben den normalen LDH-Konzentrationen weniger als drei Metastasierungsorte aufgewiesen hatten [5–7, 10–12].
In der Phase-III-Studie COLUMBUS wird außerdem derzeit bei mehr als
900 Patienten die Kombination aus dem BRAF-Inhibitor Encorafenib (450 mg/d) und dem MEK-Inhibitor Binimetinib (45 mg/d) randomisiert gegen eine Monotherapie aus Encorafenib (300 mg/d) bzw. Vemurafenib (960 mg zweimal täglich) getestet [13]. Im ersten Teil der randomisierten Studie mit 577 Patienten war die Kombination beim progressionsfreien Überleben dem Vemurafenib deutlich (median 14,9 vs. 7,3 Monate; HR 0,54; p < 0,001) und der Encorafenib-Monotherapie knapp nicht signifikant überlegen (median 14,9 vs. 9,6 Monate; HR 0,75; p = 0,051). Die Encorafenib-Monotherapie schnitt gegenüber Vemurafenib ebenfalls besser ab (median 9,6 vs. 7,3 Monate;
HR 0,68; p = 0,007). Bei den Ansprechraten war die Kombination mit 63% in der zentralen und 75% in der lokalen Beurteilung ebenfalls besser.
Im Vergleich der verfügbaren Daten sind die bisher in Phase-III-Studien getesteten BRAF-/MEK-Inhibitor-Kombinationen beim Ansprechen weitgehend vergleichbar, während beim progressionsfreien Überleben Encorafenib/Binimetinib am besten abzuschneiden scheint. Zum Gesamtüberleben gibt es aus der
COLUMBUS-Studie noch keine Ergebnisse; hier liegt bisher Dabrafenib/Trametinib vorne, wobei ein solcher nicht randomisierter Vergleich der Daten aus verschiedenen Studien mit der üblichen Vorsicht zu betrachten ist (Tab. 1).
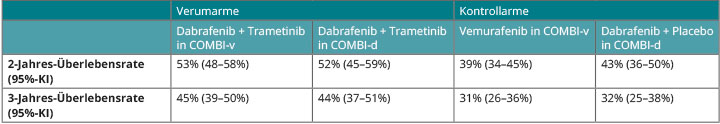
Dass auch Vergleiche zwischen Studien dennoch recht zuverlässig sein können, zeigt sich, wenn man die Überlebens-Daten der beiden COMBI-Studien nebeneinanderstellt (Tab. 2): Die beiden Verumarme, in denen die Patienten jeweils Dabrafenib und Trametinib erhalten hatten, sind in ihren Resultaten praktisch deckungsgleich, und auch die Monotherapien in den Kontrollarmen (in der COMBI-v-Studie Vemurafenib, in COMBI-d Dabrafenib plus Placebo) unterscheiden sich in ihrer Wirksamkeit nicht [10, 11].
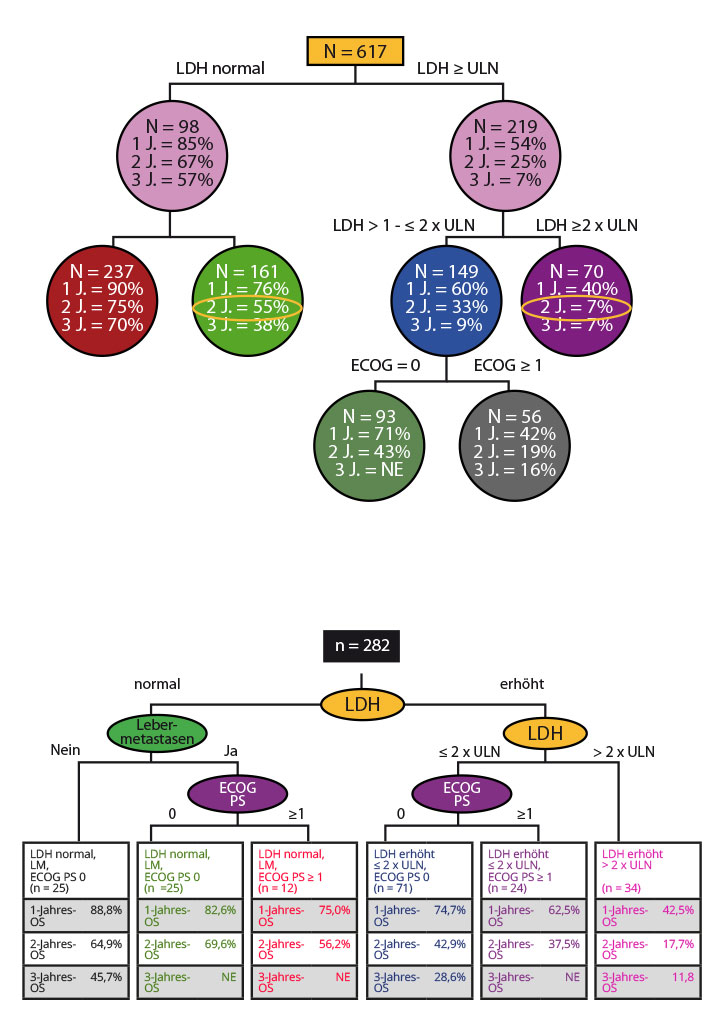
Viele Tumoren, die zunächst auf die BRAF-/MEK-Inhibition ansprechen, werden nach einiger Zeit dagegen resistent. Um prädiktive Faktoren für einen längerfristigen Nutzen der kombinierten Inhibitortherapie zu finden, wurden Subgruppenanalysen der Studien durchgeführt. In einer gepoolten Analyse von 617 mit Dabrafenib und Trametinib behandelten Patienten aus den beiden COMBI-Studien sowie einer entsprechenden Phase-II-Studie erwiesen sich zwei Faktoren als besonders relevant für das Gesamtüberleben (Abb. 2a; [14]): Patienten mit Krankheitsmanifestationen an weniger als drei Stellen hatten, sofern sie LDH-Werte im Normbereich aufwiesen, eine deutlich günstigere Prognose als jene mit drei oder mehr Tumorlokalisationen (Überlebensraten nach zwei Jahren 75% vs. 55%, nach drei Jahren 70% vs. 38%). Bei erhöhten LDH-Werten profitierten die Patienten immerhin mittelfristig, wenn die Konzentrationen das Doppelte des oberen Grenzwertes des Normbereichs nicht überschritten (Überleben nach zwei Jahren 33% vs. 7%, nach drei Jahren ließ sich ein solcher Vorteil mit 9% vs. 7% nicht mehr nachweisen). In diesem Fall spielt auch der ECOG-Performancestatus eine Rolle: Liegt er bei 0, so ist die 2-Jahres-Überlebensrate mit 43% mehr als doppelt so hoch als bei höheren Werten (19%).
In einer ähnlichen Analyse von 282 Patienten, die Vemurafenib und Cobimetinib erhalten hatten (Abb. 2b; [15]), spielte eine Metastasierung des Melanoms in die Leber keine herausragende Rolle für die Prognose, allerdings hatte ein ECOG-Status von 0 bei vorhandenen Leberfiliae einen günstigen Einfluss (2-Jahres-Überleben 69,6% vs. 56,2% bei ECOG ≥ 1). Eine Erhöhung der LDH um mehr als das Doppelte des oberen Grenzwerts des Normbereichs war auch hier mit einer deutlich schlechteren Prognose assoziiert: Das 2-Jahres-Überleben lag dann bei 17,7%, bei niedrigeren LDH-Werten schien auch hier der ECOG-Status von Bedeutung zu sein: Lag er bei 0, so war der 2-Jahres-Wert mit 42,9% etwas höher als bei weniger gutem Zustand der Patienten (37,5%).
Was ist die beste Erstlinien-Strategie?
Wirklich kompliziert wird die Frage nach der besten Erstlinientherapie beim BRAF-mutierten metastasierten Melanom dadurch, dass die Patienten in dieser Subgruppe offenbar auch am meisten von einer Immuntherapie zu profitieren scheinen. Es gibt bisher auch keine direkten Vergleichsstudien in dieser Indikation zwischen zielgerichteten Therapien und Immuncheckpoint-Inhibitoren, und ein Vergleich verschiedener Studien wird dadurch erschwert, dass die Patientenkollektive sehr heterogen waren: In den Studien zur BRAF-MEK-Hemmung wurde diese immer als Erstlinientherapie eingesetzt [5–7, 10–12], während in den Immuntherapie-Studien meist therapienaive ebenso wie vorbehandelte Patienten rekrutiert wurden, diese aber häufig keine BRAF-Mutationen haben durften oder aber bereits mit den entsprechenden Inhibitoren vorbehandelt sein mussten [16–19]. Die Ansprechrate auf den
PD-1-Antikörper Nivolumab war in einer gepoolten Analyse mehrerer Studien bei Patienten mit mutiertem BRAF mit 30% geringfügig niedriger als bei den nicht mutierten mit 35%; eine Vorbehandlung mit BRAF-Inhibitoren oder mit dem CTLA-4-Antikörper Ipilimumab schien keinen Einfluss auf das Ansprechen und seine Dauer zu haben [20]. In der
KEYNOTE-006-Studie war die Ansprechrate auf den PD-1-Inhibitor Pembrolizumab bei Patienten mit BRAF-Wildtyp mit 38% ebenfalls etwas höher als bei denen mit mutiertem BRAF, allerdings hing in letzterer Subgruppe der Wert stark vom Vorbehandlungsstatus ab: Mit BRAF/MEK-Inhibitoren vorbehandelte Patienten sprachen nur zu 22% an, therapienaive hingegen zu 41%.
Einerseits kann es also sein, dass bei Patienten mit Mutation die BRAF/MEK-Inhibition ein besseres Ansprechen garantiert als ein PD-1-Inhibitor, andererseits könnte die Aktivität der Checkpoint-Inhibitoren bei den mit BRAF/MEK-Inhibitor vorbehandelten mutierten Patienten deutlich geringer sein. In Ermangelung eines direkten Vergleichs zwischen den beiden Ansätzen wurde deshalb eine systematische Metaanalyse klinischer Studien zum fortgeschrittenen, therapienaiven, BRAF-mutierten Melanom durchgeführt, in der sich beim Gesamtüberleben kein signifikanter Unterschied zeigte, während BRAF/MEK-Inhibitoren beim progressionsfreien Überleben und beim Ansprechen der Therapie mit
PD-1-Inhibitoren überlegen waren [21].
Auch die Expression des PD-1-Liganden PD-L1 eignet sich nicht zur Stratifizierung von Patienten für oder gegen die Anwendung eines PD-1-Inhibitors: Es gibt zwar eine gewisse Korrelation zwischen PD-L1-Expression und Ansprechen, aber auch Patienten mit PD-L1-negativen Tumoren können von den Antikörpern profitieren [22]; entsprechend ist eine PD-L1-Expression auch keine Voraussetzung für die Anwendung von PD-1-Antikörpern. Ähnlich verhält es sich mit anderen Biomarkern wie zum Beispiel der Infiltration des Tumors mit CD8-positiven T-Lymphozyten: Einerseits korreliert sie mit dem Ansprechen auf PD-1-Antikörper, andererseits können diese aber auch bei Patienten mit geringer Infiltration wirksam sein, sofern es sich um Zellen handelt, deren T-Zell-Rezeptor spezifisch das Tumor-Antigen erkennt [23]. Zahlreiche weitere Marker sind derzeit in aktiver Erforschung wie etwa die Mutationslast des Tumors, die mit einem erhöhten Gehalt an Neoantigenen einhergeht, das Verhältnis von Neutrophilen zu Lymphozyten im peripheren Blut, das mit einem verbesserten Überleben unter Checkpoint-Inhibitoren einhergehen soll, aber noch nicht prospektiv validiert ist, oder Genexpressions-Signaturen.
Derzeit wird das Tumormaterial der Patienten aus den klinischen Studien intensiv auf relevante Veränderungen untersucht, insbesondere auf genetische Alterationen, die möglicherweise mit dem Behandlungsergebnis korrelieren könnten. So waren in der COMBI-d-Studie Mutationen und Deletionen im CDKN2A-Gen unter der Therapie mit Dabrafenib und Trametinib mit einem schlechteren Gesamt- und progressionsfreien Überleben assoziiert [10].
Da sich beim Gesamtüberleben kein nennenswerter Unterschied zwischen beiden Therapiestrategien findet, wird, solange die Erforschung prädiktiver Marker nicht zu validierten, klinisch anwendbaren Ergebnissen geführt hat, die Anwendung der BRAF/MEK-Hemmung insbesondere für Patienten empfohlen, bei denen die Erzielung einer möglichst tiefen Remission im Vordergrund steht, beispielsweise bei Vorliegen einer symptomatischen Erkrankung. In allen anderen Fällen sollte die Entscheidung für BRAF/MEK- oder Checkpoint-Inhibition individuell auf der Basis klinischer Zeichen und prognostischer Faktoren wie der LDH-Konzentration und des Vorliegens von Hirnmetastasen erfolgen.
Als vielversprechend gilt die Kombination der zwei Checkpoint-Inhibitoren Ipilimumab und Nivolumab, die mit einer Ansprechrate von 58% und einem medianen progressionsfreien Überleben von 11,5 Monaten der Aktivität der BRAF/MEK-Inhibition nahekommt ([19]; s. Artikel zu Immuntherapien in diesem Heft, S. 178 ff.).
Hirnmetastasen
Zerebrale Absiedlungen treten beim malignen Melanom häufig auf und sind auch in Zeiten von zielgerichteten und Immuntherapien noch immer mit einer schlechten Prognose assoziiert [24]. Da Patienten mit Hirnmetastasen in den meisten klinischen Studien von der Teilnahme ausgeschlossen oder zumindest deutlich unterrepräsentiert sind, gibt es dazu nicht sehr viele Daten. In einer multizentrischen Phase-II-Studie hatten aber speziell 172 solche Patienten, deren Tumoren eine BRAF-Mutation aufgewiesen hatten, Dabrafenib erhalten [25]: Dort hatten diejenigen, deren Hirnfiliae vorher nicht lokal behandelt worden waren, eine Ansprechrate von 39,2% erzielt, während sie bei den lokal vorbehandelten (mit Operation oder Bestrahlung) und danach wieder progredienten Patienten mit 30,8% etwas niedriger war. Die Patienten mit einer V600K-Mutation von BRAF (in deren Tumoren Valin an Position 600 des BRAF-Proteins durch Lysin ersetzt war) schnitten mit 6,7% (unvorbehandelt) bzw. 22,2% (nach lokaler Vorbehandlung) deutlich schlechter ab. Bei elf der
172 Patienten in dieser Studie wurden unter der Monotherapie mit Dabrafenib Plattenepithelkarzinome beobachtet (bei einem dieser Patienten außerdem ein Keratoakanthom). Derzeit laufen zwei Phase-II-Studien, in denen Patienten mit BRAF-mutiertem Melanom und Hirnmetastasen eine Kombination aus Dabrafenib und Trametinib (ClinicalTrials.gov No. NCT02039947) bzw. aus Vemurafenib und Cobimetinib (ClinicalTrials.gov No. NCT02230306) erhalten. Beide Studien haben die Rekrutierung beendet, aber es gibt noch keine Resultate.
Monotherapie mit MEK-Inhibitoren, NRAS-Mutationen
Eine Monotherapie mit dem MEK-Inhibitor Trametinib konnte zwar progressionsfreies und Gesamtüberleben von Patienten mit BRAF-mutiertem Melanom gegenüber einer Chemotherapie verlängern, bleibt aber mit einem progressionsfreien Überleben von median 4,8 Monaten weit hinter den Ergebnissen einer Kombination aus BRAF- und MEK-Inhibitor zurück [26].
Es gibt neben den BRAF-Mutationen noch eine Reihe weiterer genetischer Defekte, die bei malignen Melanomen gefunden werden: Mutationen oder Amplifikationen des KIT-Rezeptors können bei 10–30% der akralen und Mukosa-Melanome nachgewiesen werden, Mutationen des NRAS-Onkogens bei etwa jedem fünften kutanen Melanom, eine Inaktivierung von PTEN bei 40–60% und eine Aktivierung oder Amplifikation von AKT bei ebenfalls etwa 60% aller Melanome. Das NRAS-Onkoprotein, das am Beginn der RAS-RAF-MEK-ERK-Signaltransduktionskette steht, ist notorisch schlecht pharmakologisch zu hemmen, aber man kann ähnlich wie bei mutiertem BRAF versuchen, die nachgeschalteten MEK-Kinasen zu inhibieren, wie das in der Phase-III-Studie NEMO mit relativ bescheidenem Erfolg versucht wurde [27]: Dort wurden
402 Patienten mit nicht vorbehandeltem oder nach Immuntherapie progredientem Melanom im Verhältnis 2 : 1 randomisiert, den MEK-Inhibitor Binimetinib (45 mg zweimal täglich) oder eine Chemotherapie mit Dacarbazin (1.000 mg/m2 i. v. alle drei Wochen) zu erhalten.
Die Gesamtansprechrate konnte durch den MEK-Inhibitor von 7% auf 15% verdoppelt werden, und beim primären Endpunkt progressionsfreies Überleben war ein Vorteil mit median 2,8 gegenüber 1,5 Monaten unter der Chemotherapie zwar signifikant, aber nicht überwältigend (HR 0,62; p < 0,001). Die gleichen Werte erreichten die nicht vorbehandelten Patienten, während bei denen, die vorher eine Immuntherapie erhalten hatten, überraschenderweise der Medianwert von 1,6 auf 5,5 Monate mehr als verdreifacht wurde. Beim Gesamtüberleben ist bislang mit median 11,0 versus 10,1 Monaten kein Unterschied zu erkennen.
In einer randomisierten Phase-II-Studie erhielten 194 Patienten mit NRAS-mutiertem Melanom im Verhältnis 2 : 1 entweder den MEK-Inhibitor Pimasertib oder Dacarbazin [28]. Hier war ein deutlicher Nutzen sowohl bei der Ansprechrate (23,1% vs. 14,1%) als auch beim progressionsfreien Überleben zu sehen (median 12,7 vs. 6,4 Monate; HR 0,65; p = 0,0195); beim Gesamtüberleben zeigte sich auch hier noch kein Effekt.
Adjuvante Therapie mit BRAF- und MEK-Inhibitoren
Bei Medikamenten, die in der Erstlinientherapie metastasierter Tumoren wirksam sind, liegt es nahe, sie auch in der adjuvanten Situation nach erfolgreicher Resektion nicht metastasierter Malignome zu testen. Tatsächlich wird die Kombination aus Dabrafenib und Trametinib bei Patienten mit operativ entferntem BRAF-mutiertem Hochrisiko-Melanom derzeit in einer Phase-III-Studie getestet (ClinicalTrials.gov No. NCT01682083), deren erste Ergebnisse Ende 2017 erwartet werden.
Toxizität
Dass die Monotherapie mit BRAF-Inhibitoren mit einer erhöhten Inzidenz von „weißem Hautkrebs“ einhergeht, ist bekannt und war der Hauptgrund, diese Substanzen mit Hemmstoffen der in der Signalkette nachgeschalteten MEK-Kinase zu kombinieren. Wie oben gezeigt, haben die beiden zugelassenen Kombinationen (Dabrafenib/Trametinib bzw. Vemurafenib/Cobimetinib) vergleichbare Aktivität und Wirksamkeit. In einem solchen Fall versucht man, sich bei differenzialtherapeutischen Erwägungen überwiegend an möglicherweise unterschiedlichen Toxizitätsprofilen zu orientieren. Zwar zeigen die verfügbaren Phase-III-Daten für beide Kombinationen ähnliche Raten sowohl an Nebenwirkungen vom Grad 3–4 (48–58% für Dabrafenib/Trametinib [10, 11], 60% für Vemurafenib/Cobimetinib [12]) als auch an Therapieabbrüchen (11–16% bzw. 14%; [10–12]), aber für einige der Toxizitäten zeigen sich auffallende Unterschiede bezüglich der Häufigkeit des Auftretens unter den beiden Kombinationen:
Als häufigste Nebenwirkung tritt Fieber bei etwa der Hälfte der Patienten unter einer Behandlung mit Dabrafenib/Trametinib auf, wobei es bei etwa 5% der Patienten vom Grad 3 ist und auch den häufigsten Grund für Dosisreduktionen, Therapieunterbrechungen oder -abbrüche bei dieser Therapie darstellt [6, 7, 10, 11]. Es gibt keine Merkmale, anhand derer sich die Entwicklung von Fieber vorhersagen lässt, und es scheint auch nicht mit der Effektivität der Therapie zu korrelieren. Weitere häufige Nebenwirkungen unter Dabrafenib/Trametinib sind Fatigue (35%), Übelkeit (30–35%), Kopfschmerzen (30%), Schüttelfrost (30–31%), Diarrhö (24–32%), Arthralgien (24%), Hautausschläge (22–23%) und Hypertonus (22%; [6, 7, 10, 11]).
Unter Vemurafenib/Cobimetinib tritt Fieber nur etwa halb so häufig auf wie unter Dabrafenib/Trametinib (26%, bei 2% der Patienten vom Grad 3; [5, 12]). Häufiger sind dagegen Photosensitivitätsreaktionen (28%), Diarrhö (56%, 6% vom Grad 3), Erhöhungen der ALT (22–23%, 8–11% vom Grad 3) und der Kreatinkinase (27%, 7% vom Grad 3). Toxizitäten an den Augen, ein Klasseneffekt von MEK-Inhibitoren, sind unter Vemurafenib/Cobimetinib ebenfalls häufiger, darunter vor allem eine Chorioretinopathie (12%, unter Dabrafenib/Trametinib 1%) sowie Netzhautablösung (8%), aber in den meisten Fällen waren diese Nebenwirkungen von niedrigem Schweregrad und selbstlimitierend, ohne dass sie behandelt oder die Cobimetinib-Therapie reduziert oder unterbrochen werden musste [5, 12].
Die Abbruchraten sind unter den Kombinationen aus BRAF- und MEK-Inhibitor höher als unter einer Monotherapie, obwohl sich die Häufigkeit neuer Hautläsionen deutlich reduziert. Weil die Nebenwirkungen aber durch Dosisreduktionen oder den Verzicht auf eine der Therapiekomponenten gut handhabbar sind, ist die Gabe der Kombinationen bei Patienten mit BRAF-mutiertem Melanom aufgrund ihrer höheren Wirksamkeit auch in der Erstlinie gerechtfertigt.
Unter einer Monotherapie mit Checkpoint-Inhibitoren sind schwere Toxizitäten deutlich seltener als mit der Kombination aus einem BRAF- und einem MEK-Inhibitor. Die Kombination aus Nivolumab und Ipilimumab, die auch für die Erstlinie zugelassen ist, kam in der Zulassungsstudie mit 57% auf einen ähnlichen Wert, doch führten hier diese Toxizitäten deutlich häufiger zu einem Absetzen der Therapie (39% vs. 11–16%; [19]). Die immunologisch vermittelten Nebenwirkungen unter der Behandlung mit CTLA-4- oder PD-1-Antikörpern in Monotherapie sind bei adäquater Behandlung etwa mit Kortikosteroiden in der Regel reversibel, können aber in einigen Fällen lebensbedrohlich (Kolitis, Pneumonitis) oder irreversibel sein (Hypophysitis).
Literatur
1. Korn EL et al. Meta-analysis of phase II cooperative group trials in metastatic stage IV melanoma to determine progression-free and overall survival benchmarks for future phase II trials. J Clin Oncol 2008; 26: 527-34.
2. Davies H et al. Mutations of the BRAF gene in human cancer. Nature 2002 417: 949-54.
3. McArthur GA et al. Safety and efficacy of vemurafenib in BRAFV600E and BRAFV600 K mutation-positive melanoma (BRIM-3): Extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol 2014; 15: 323-32.
4. Hauschild A et al. Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012; 380: 358-65.
5. Ascierto PA et al. Cobimetinib combined with vemurafenib in advanced BRAFV600-mutant melanoma (coBRIM): updated efficacy results from a randomised, doubleblind, phase 3 trial. Lancet Oncol 2016; 17: 1248-60.
6. Long GV et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: A multicentre, double-blind, phase 3 randomised controlled trial. Lancet 2015; 386, 444-51.
7. Robert C et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2014; 372: 30-9.
8. Johnson DB et al. Combined BRAF (dabrafenib) and MEK inhibition (trametinib) in patients with BRAF(V600)-mutant melanoma experiencing progression with single-agent BRAF inhibitor. J Clin Oncol 2014; 32: 3697-704.
9. Long GV et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014; 371: 1877-88.
10. Flaherty K et al. Genomic analysis and 3-y efficacy and safety update of COMBI-d: a phase 3 study of dabrafenib (D) + trametinib (T) vs D monotherapy in patients (pts) with unresectable or metastatic BRAF V600E/K-mutant cutaneous melanoma. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9502.
11. Robert C et al. Three-year estimate of overall survival in COMBI-v, a randomized phase 3 study evaluating first-line dabrafenib + trametinib in patients with unresectable or metastatic BRAF V600E/K–mutant cutaneousmelanoma. Ann Oncol 2016; 27 (Suppl 6): ESMO 2016, Abstract #LBA40.
12. McArthur GA et al. Efficacy of long-term cobimetinib + vemurafenib in advanced brafv600-mutated melanoma: 3-year follow-up of co-BRIM (Phase 3) and 4-year follow-up of BRIM7 (Phase 1b). Society for Melanoma Research 2016 Congress, Late-Breaking Abstract.
13. Dummer R et al. Results of COLUMBUS part 1: A phase 3 trial of encorafenib (ENCO) plus binimetinib (BINI) versus vemurafenib (VEM) or ENCO in BRAF-mutant melanoma. SMR 2016, Late-Breaking Abstract.
14. Long GV et al. Baseline and postbaseline characteristics associated with treatment benefit across dabrafenib and trametinib registration pooled data. Pigment Cell Melanoma Res 2015; 28: 793 (SMR 2015, Abstract).
15. Hauschild A et al. EADO 2016, Abstract.
16. Robert C et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320-30.
17. Weber JS et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015; 16: 375-84.
18. Robert C et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015; 372: 2521-32.
19. Larkin J et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373: 23-34.
20. Larkin J et al. Efficacy and safety of nivolumab in patients with braf v600 mutant and braf wild-type advanced melanoma: A pooled analysis of 4 clinical trials. JAMA Oncol 2015; 1: 433-40.
21. Devji T et al. Systemic therapy for previously untreated advanced braf-mutated melanoma: a systematic review and network meta-analysis of randomized clinical trials. JAMA Oncology 2017; 3: 366-73.
22. Gibney GT et al. Predictive biomarkers for checkpoint inhibitor-based immunotherapy. Lancet Oncol 2016; 17: 542-51.
23. Tumeh PC et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 2014; 515: 568–71.
24. Spagnolo F et al. Survival of patients with metastatic melanoma and brain metastases in the era of MAP-kinase inhibitors and immunologic checkpoint blockade antibodies: a systematic review. Cancer Treat Rev 2016; 45: 38-45.
25. Long GV et al. Dabrafenib in patients with Val600Glu or Val600Lys BRAF-mutant melanoma metastatic to the brain (BREAK-MB): a multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13: 1087-95.
26. Flaherty KT et al. Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 2012; 367: 107-14.
27. Dummer R et al. Results of NEMO: A phase III trial of binimetinib (BINI) vs dacarbazine (DTIC) in NRAS-mutant cutaneous melanoma. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9500.
28. Lebbe C et al. Pimasertib (PIM) versus dacarbazine (DTIC) in patients (pts) with cutaneous NRAS melanoma: a controlled, open-label phase II trial with crossover. Ann Oncol 2016; 27 (Suppl 6): vi391. ESMO 2016, Abstract #1136P.

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstraße 9–11/Thalkirchner Straße 48
80337 München
+49 89 4400 0
+49 89 4400 56226
E-Mail schreiben