Stellenwert der Liquid Biopsy in der Therapiesteuerung des Kolonkarzinoms
Das kolorektale Karzinom (KRK) ist die dritthäufigste Krebserkrankung in Deutschland. Jährlich erkranken über 60.000 Menschen, etwa 30.000 sterben an Darmkrebs, der damit die zweithäufigste krebsbedingte Todesursache in Deutschland ist [1]. Das Risiko, im Laufe des Lebens an Darmkrebs zu erkranken, liegt aktuell bei ca. 5% [2].
Bereits bei der Diagnose des kolorektalen Karzinoms weisen ca. 25% der Patienten Metastasen auf (synchrone Metastasierung). Weitere 25% der Patienten entwickeln metachrone Metastasen, d. h. diese Metastasen kommen erst im Verlauf der Erkrankung zum Vorschein [3]. Bei diesen Patienten ist eine Chemoimmuntherapie in der Regel die einzige Therapieoption. Umso essenzieller ist es bei dieser kritischen Patientengruppe, die optimale, auf den einzelnen Patienten und seine Erkrankung zugeschnittene Therapie auszuwählen.
Eine Therapie mit Antikörpern gegen den Rezeptor für den Epidermal Growth Factor (EGFR) verlängert das Überleben von Patienten, deren Tumoren keine Mutationen im KRAS- und im NRAS-Gen bzw. einen RAS-Wildtyp aufweisen. Insbesondere gilt das für linksseitige Karzinome. Insgesamt findet sich bei ca. 50% aller Patienten mit fortgeschrittenen kolorektalen Karzinomen ein RAS-Wildtyp [4]. Bei mutiertem RAS-Status oder bei nicht durchgeführter Bestimmung des RAS-Status ist die Verabreichung eines Antikörpers gegen den EGFR nicht erfolgreich und daher nicht zugelassen. Laut der aktuellen S3-Leitlinie „Kolorektales Karzinom“ gehört die Bestimmung des RAS-Status zur Standarddiagnostik vor der Einleitung der palliativen Chemotherapie [5].
Der derzeitige Goldstandard ist die Bestimmung des RAS-Mutationsstatus aus dem Gewebe. Dafür ist die Entnahme einer Gewebeprobe/Biopsie z. B. durch einen chirurgischen Eingriff oder durch eine Punktion notwendig. Jedoch ist die Interpretation der Ergebnisse hier durch intra- und interläsionale Heterogenität des Karzinoms limitiert [6, 7]. Durch eine Biopsie kann man sich einen Überblick über einen Ausschnitt des Tumors verschaffen. Jedoch werden die pathologischen Veränderungen bzw. molekulargenetischen Profile in angrenzenden Tumorbereichen oder anderen Tumormanifestationen wie Fernmetastasen, die folgenschwer für die Therapiewahl sein können, nicht erfasst. Bezogen auf den RAS-Status liegt die interläsionale Heterogenität bei ca. 20% [8, 9].
Genomische Instabilität und klonale Selektion begünstigen die Entstehung von Tumorheterogenität. Außerdem gilt, dass die molekulargenetischen Profile der einzelnen Tumormanifestationen desto heterogener sind, je aggressiver die Tumorerkrankung wächst [5]. Insbesondere während der Behandlung kann es durch unterschiedliche Empfindlichkeit der einzelnen Klone gegenüber der Therapie zur klonalen Umverteilung und damit zu Änderungen des molekularen Profils des Tumors kommen. Um die Tumorheterogenität mittels einzelner Biopsien erfassen zu können, müsste man simultan an mehreren Stellen des Tumors biopsieren. Dynamische Veränderungen wären nur mittels der Durchführung von sequenziellen Biopsien zu erfassen. Diese Belastung durch invasive Eingriffe ist dem Patienten nicht zuzumuten, sodass es nicht-invasiver Lösungen bedarf.
Den RAS-Mutationsstatus aus dem Blut bestimmen
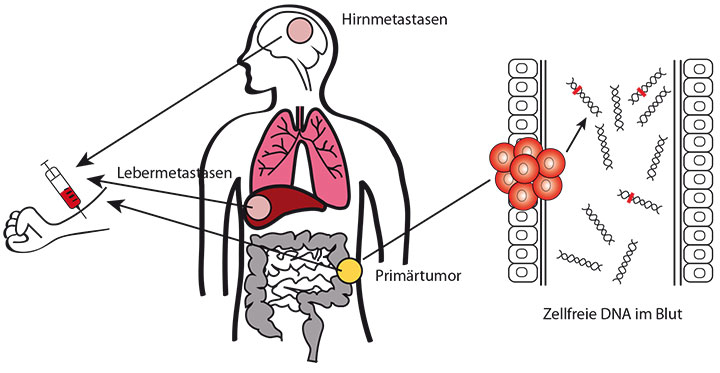
In den letzten Jahren wurden einige Methoden entwickelt, die mit hoher Sensitivität zielgerichtet einzelne Mutationen in der zirkulierenden DNA quantitativ nachweisen und unter anderem auch die Bestimmung des RAS-Mutationsstatus aus dem Blut ermöglichen. Diese Untersuchungen werden unter der Bezeichnung „Liquid Biopsy“ zusammengefasst (Abb. 1). Der Tumor bzw. einzelne Mutationen können mithilfe von aus dem Blut der Patienten isolierten freien zirkulierenden DNA-Abschnitten der Tumorzellen charakterisiert werden [10, 11]. Die Menge an freier DNA, die man aus dem Plasma isolieren kann, ist sehr gering: Ihre Konzentration liegt meist nur zwischen 1 und 100 ng/ml [11]. Methoden, die einen spezifischen Mutationsnachweis im Plasma ermöglichen, sind u. a. BEAMing (Beads, Emulsion PCR, Amplification und Magnetic Beads) und ddPCR (digital droplet PCR) und werden wie im Folgenden beschrieben durchgeführt.
Das entscheidende Merkmal beider Verfahren ist die Verteilung des Reaktionsansatzes auf sehr viele kleine Partitionen/Tröpfchen, in denen die Amplifikation der einzelnen Messsignale unabhängig voneinander stattfindet. Diese Amplifikate, die als spezifische Messsignale erfasst werden, entstammen jeweils einem einzigen DNA-Molekül. Je nach Häufigkeit des Messsignals müssen demzufolge viele Einzelereignisse erzeugt werden. Die Anzahl an mutierten DNA-Kopien, die in der Probe enthalten sind, wird über das Verhältnis der Kompartimente berechnet, die die Mutation tragende bzw. den Wildtyp tragende DNA-Fragmente enthalten.
Das BEAMing-Verfahren
Im ersten Schritt des BEAMing-Verfahrens (Sysmex Inostics) wird zellfreie DNA aus 3 ml Plasma isoliert. Anschließend werden die Zielregionen in einem Multiplex-PCR-Schritt mithilfe von unterschiedlichen Primer-Paaren amplifiziert und in eine wässrige Lösung mit weiteren Primer-Paaren und Öl überführt.
Einer der Primer befindet sich dabei gebunden auf der Oberfläche eines magnetischen Kügelchens mit einem Durchmesser von 1 µm. Durch Auf- und Ab-Pipettieren wird die Suspension aus wässriger Lösung, magnetischen Kügelchen und Öl zu einer Emulsion durchmischt. Diese enthält Millionen von mikroskopisch kleinen Emulsions-Tröpfchen, von denen jedes idealerweise ein magnetisches Kügelchen und ein Fragment der Zielregion (Wildtyp oder Mutante) enthält.
Die Zielsequenzen in den Emulsions-Tröpfchen werden nun in der sogenannten Emulsions-PCR weiter amplifiziert. Die DNA-Fragmente (Wildtyp oder Mutante) binden an die universellen Primer, die an die magnetischen Kügelchen in einem Emulsions-Tröpfchen gekoppelt sind, und werden durch die Polymerase amplifiziert. Dabei werden tausende von Kopien des DNA-Fragments an die Oberfläche der magnetischen Kügelchen gekoppelt. Im Hybridisierungsschritt werden die Kügelchen re-suspendiert und im Falle der Bestimmung des RAS-Mutationsstatus sowohl zwölf basenspezifische, Fluoreszenz-markierte RAS-Wildtyp-Sonden als auch 34 basenspezifische, Fluoreszenz-markierte RAS-Mutations-Sonden mit den DNA-Fragmenten hybridisiert. Die Intensität des Messsignals – eines sequenzspezifischen Fluoreszenzsignals, das mittels FACS-Analyse gemessen wird – korreliert mit der Zahl der Einzelereignisse und damit mit der Konzentration des entsprechenden DNA-Moleküls im Ausgangsmaterial. Mit der BEAMing-Technologie lassen sich Mutationen mit Frequenzen von bis zu 0,01‰ mutierter DNA vor Wildtyp-Hintergrund detektieren [11].
Das Droplet Digital PCR-Verfahren
Auch beim ddPCR-Verfahren wird im ersten Schritt zellfreie DNA aus 3 ml Plasma isoliert. Beim Verfahren des Unternehmens Bio-Rad oder RainDance Technologies werden anschließend die Zielregionen in einer sogenannten Droplet Digital PCR mithilfe spezifischer Primer-Paare in einer Wasser-Öl-Emulsion in kleinste Tröpfchen-Volumina partitioniert. Die Verteilung soll so erfolgen, dass statistisch nur ein Ausgangs-DNA-Fragment in einem Tröpfchen zusammen mit den Primer-Paaren, PCR-Enzymen und sequenzspezifischen Sonden zu finden sind. Die Tröpfchen werden durch ddPCR-Puffersysteme so stabilisiert, dass ein Wiederverschmelzen verhindert wird und eine Homogenität des Tröpfchen-Volumens erreicht werden kann.
Nach Herstellung der Nanoliter-großen Mikrokompartimente erfolgt die Amplifikation des im Tröpfchen eingeschlossenen DNA-Fragments. Dabei werden sequenzspezifisch Fluoreszenzsignale freigesetzt. Jedes der dabei entstehenden Zehntausende fluoreszierender Tröpfchen enthält die vervielfältigte Kopie des Ausgangs-DNA-Fragments und das entstandene sequenzspezifische Fluoreszenzsignal. Enthält das Tröpfchen Fragmente verschiedener Sequenzen, so entsteht ein gemischtes Fluoreszenzsignal. Anzahl und Art der Fluoreszenzsignale der Tröpfchen können mit einem geeigneten Durchflusszytometer erfasst werden. Dass auch bei ungleicher Verteilung der DNA-Fragmente eine Analyse einzelner Fragmente erfolgen kann, stellt eine Software-seitig gesteuerte Korrektur mithilfe einer Poisson-Verteilung sicher.
Woher kommt die zirkulierende Tumor-DNA?
Die aktuellen Messergebnisse zeigen, dass der Mutationsstatus aus dem Blut in über 90% der Fälle mit dem Mutationsstatus, der direkt aus dem Tumorgewebe bestimmt wurde, übereinstimmt [12]. Die Herkunft der zirkulierenden Tumor-DNA ist noch nicht abschließend geklärt. Aggressive, schnell wachsende Tumorzellen zeigen einen hohen Zellumsatz im Sinne von gesteigerter Apoptose und Nekrose. Immer wenn eine Krebszelle durch Apoptose oder Nekrose abstirbt, werden DNA-Fragmente freigesetzt und gelangen so als zirkulierende Tumor-DNA in die Blutbahn [13, 14]. Die Interpretation der Messergebnisse wird durch die ungeklärte Frage erschwert, ob alle Tumorzellen gleich viel Tumor-DNA beisteuern oder ob Klone mit aggressiverem Wachstum mehr DNA freisetzen und dadurch durch die Messungen der zirkulierenden DNA präferenziell erfasst werden.
Die Freisetzung der DNA ins Blut ist ein physiologischer Prozess. Auch bei gesunden Menschen ist zirkulierende DNA im Blut nachweisbar. Seit Jahren ist die Untersuchung der fetalen frei zirkulierenden DNA im Blut schwangerer Frauen im Rahmen der Pränatal-Diagnostik im Einsatz. Bei rheumatischen Erkrankungen oder bei Infektionen wird passager mehr DNA ins Blut freigesetzt. Jedoch sind die DNA-Konzentrationen im Blut von Krebspatienten deutlich höher. Eine mögliche Erklärung dafür ist neben der hohen Teilungsaktivität von Tumorzellen eine erniedrigte DNase-Aktivität bei Tumorpatienten [15].
Im Blut zirkulierende Tumor-DNA findet sich bis auf wenige Ausnahmen bei allen Krebserkrankungen, wobei die Nachweiswahrscheinlichkeit wesentlich von Tumorstadium, Tumorlast, Vaskularisation, Lokalisation und Anzahl der Tumorabsiedlungen abhängt [16]. Bei Patienten mit kolorektalen Karzinomen im metastasierten Stadium lässt sich die zirkulierende DNA bei 100% der Patienten nachweisen, in lokal fortgeschrittenen Stadien jedoch nur bei 73% [16].
Domäne der Liquid Biopsy: Nachweis von Resistenzmutationen
Dadurch, dass DNA-Spuren unterschiedlicher Krebsabsiedlungen sich im Blut nachweisen lassen, ermöglicht die Liquid Biopsy trotz der heterogenen molekularen Profile innerhalb des Tumors oder zwischen unterschiedlichen Tumormanifestations-Orten eine repräsentative Charakterisierung der molekularen Veränderungen des Tumors (Abb. 1).
In den meisten Fällen ist bei der Erstdiagnose des kolorektalen Karzinoms eine ausreichende Menge an Tumor-Primärgewebe vorhanden, um daraus die molekulare Charakterisierung im Sinne der Bestimmung des RAS-Status durchzuführen. Die Bestimmung des RAS-Mutationsstatus aus dem Blut stellt zu diesem Zeitpunkt lediglich eine Ergänzung zum Gewebe-basierten Test dar. Einen deutlich höheren Stellenwert gewinnt die Liquid Biopsy in der späteren Therapiephase, und zwar während der zielgerichteten Therapie durch den Nachweis erworbener Resistenzmutationen. Es gibt drei Hauptmechanismen, durch die kolorektale Tumoren eine sekundäre Resistenz gegenüber der Therapie mit Anti-
EGFR-Antikörpern entwickeln:
• Reaktivierung der nachgeschalteten Signalübertragungswege, z. B. KRAS- oder NRAS-Mutationen,
• Mutation an dem Locus, an den die Antikörper binden, z. B. Mutation der extrazellulären Domäne des EGF-Rezeptors,
• Aktivierung alternativer Signalübertragungswege, z. B. MET-Amplifikation, Aktivierung von ERBB2 und Aktivierung nachgeschalteter, intrazellulärer Signalwege.
Die einzelnen Resistenzmechanismen führen zu verschiedenen Ausprägungen der Resistenz (relative oder absolute Resistenz) und dadurch auch zu verschiedenen klinischen Verläufen. EGFR-Mutationen treten eher bei Patienten auf, die ein Ansprechen auf die Therapie mit Anti-EGFR-Antikörpern zeigen [17]. Die RAS-Mutationen hingegen treten eher bei Patienten auf, die unter der Therapie mit Anti-EGFR-Antikörpern eine lediglich geringgradige Tumorschrumpfung und ein kurzes progressionsfreies Überleben aufweisen [17]. Den häufigsten Resistenzmechanismus stellen die erworbenen RAS-Mutationen dar. 44–96% der Patienten mit RAS-Wildtyp entwickeln unter Therapie mit EGFR-Antagonisten RAS-Mutationen [16, 18]. Beim Auftreten von RAS-Mutationen ist die Therapie mit EGFR-Antagonisten nicht mehr wirksam. Um diese komplexen genomischen Veränderungen detektieren zu können, war bisher die erneute Biopsie des Tumors unerlässlich.
Eine Identifikation neu auftretender RAS-Mutationen würde dem behandelnden Arzt frühzeitig den Hinweis darauf liefern, dass die Therapie an das veränderte Tumorprofil angepasst bzw. umgestellt werden soll. Dadurch können dem Patienten Nebenwirkungen einer nicht mehr wirksamen Therapie erspart werden. Verglichen mit Gewebeentnahmen, die nicht regelmäßig und sequenziell durchgeführt werden können, ist die nicht-invasive Liquid Biopsy hervorragend dafür geeignet, die dynamischen Veränderungen des Tumors zu charakterisieren. Das Fehlen von RAS-Mutationen im Blut kann ein spezifischer Marker für Therapieansprechen sein, denn erste prospektive Daten zeigen, dass Patienten, die ein Langzeit-Ansprechen auf die Anti-EGFR-Therapie zeigen, keine in der Liquid Biopsy nachweisbaren RAS-Mutationen entwickeln [19].
Erst kürzlich wurde gezeigt, dass die Last der unter Anti-EGFR-Therapie erworbenen RAS-Mutationen nach Absetzen dieser Therapie wieder deutlich abnehmen kann [20]. Das gilt insbesondere für eine leichtgradige Mutationslast von ungefähr dem Doppelten des Cut-off-Werts [19]. Dieses Phänomen ist am ehesten darauf zurückzuführen, dass aufgrund der Therapieänderung eine klonale Redistribution stattfindet, weil der Selektionsdruck auf die Zellen ohne RAS-Mutation durch das Fehlen der Anti-EGFR-Therapie wieder abnimmt. Hierdurch eröffnet sich die Perspektive einer erneuten Anti-EGFR-Therapie (Abb. 2): Die sequenzielle Bestimmung der RAS-Mutationslast mittels Liquid Biopsy nach Absetzen der Anti-EGFR-Therapie kann dem behandelnden Arzt Informationen darüber geben, zu welchem Zeitpunkt der Einsatz der Anti-EGFR-Therapie wieder effektiv sein kann. Noch sind allerdings klinische Studien notwendig, um zu demonstrieren, dass dieses Konzept tatsächlich zu einer Überlebensverbesserung führt.
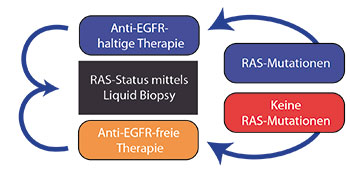
Bei Patienten, die eine hochgradige Mutationslast entwickeln (ca. das Zehnfache des Cut-off-Werts), muss man von einer Persistenz der RAS-Mutation ausgehen. Ein rasanter Anstieg der Mutationslast ist mit einer schlechten Prognose assoziiert [19].
Abschätzung des Rezidivrisikos
Ein weiteres vielversprechendes Einsatzgebiet für die Liquid Biopsy ist die Abschätzung der Rezidiv-Wahrscheinlichkeit beim kolorektalen Karzinom. Kürzlich wurde an einem Kollektiv von 250 Patienten mit kolorektalen Karzinomen des Stadiums II gezeigt, dass nach einer formalen R0-Resektion bei weiterhin nachweisbarer zirkulierender Tumor-DNA und fehlender adjuvanter Therapie das Rezidivrisiko bei 100% liegt. Hingegen rezidivieren Patienten, bei denen postoperativ die zirkulierende Tumor-DNA nicht detektierbar ist, lediglich in 9% der Fälle [21]. Falls diese Daten an einem größeren Kollektiv bestätigt werden, kann diese Methode eine entscheidende Rolle bei der Beurteilung der Indikation zur adjuvanten Chemotherapie spielen. Im Gegensatz zu den bekannten Risikofaktoren für ein Tumorrezidiv im Stadium II, wie der lymphovaskulären Invasion oder der Anzahl der entnommenen Lymphknoten, stellt die zirkulierende DNA gemeinsam mit dem T-Status bei Diagnose (T3 oder T4) auch in der multivariaten Analyse einen signifikanten Risikofaktor für ein Rezidiv dar [21].
Außerdem wurde an einzelnen Fällen gezeigt, dass die postoperativ zunächst nachweisbare zirkulierende Tumor-DNA unter adjuvanter Chemotherapie unter die Nachweisgrenze sinkt. Diese Ergebnisse zeigen eindrucksvoll, dass auch bei Patienten mit einem hohen Rezidivrisiko von 100% Rezidive durch effektive adjuvante Therapie vermeidbar sind und dass die Messung der zirkulierenden Tumor-DNA den Anteil der durch die Operation und eine adjuvante Chemotherapie geheilten Patienten erhöhen könnte [21].
Im Vergleich zum konventionellen Tumormarker CEA zeigt die zirkulierende DNA vor dem Rezidiv mehrere Monate früher auffällige Werte [22].
Fazit
Die Entwicklung hochsensitiver Analyseverfahren ermöglicht den Nachweis von kleinen im Blut zirkulierenden Tumor-DNA-Fragmenten mittels Liquid Biopsy. Durch dieses nicht-invasive Verfahren ist der Arzt jederzeit in der Lage, das genomische Tumorprofil oder die dynamischen klonalen Veränderungen im Tumor zu erfassen, die häufig unter einer gezielten Therapie auftreten und erworbene Resistenzen offenbaren. Der Arzt kann dadurch rasch auf Veränderungen im Tumor reagieren. Für den Patienten bedeutet die Etablierung der Liquid Biopsy einen Meilenstein in der personalisierten Therapie. Es ist davon auszugehen, dass diese Methode in einigen Jahren zur Routinediagnostik bei hämatologisch-onkologischen Erkrankungen gehören wird.
Literatur
1. Robert Koch-Institut, Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V., Hrsg. Krebs in Deutschland 2011/2012. 10. Ausgabe. Berlin 2015.
2. U.S. Preventive Services Task Force et al. Screening for colorectal cancer: U.S. Preventive Services Task Force recommendation statement. J Am Med Ass 2016; 315: 2564-75.
3. Alberts SR. Update on the optimal management of patients with colorectal liver metastases. Crit Rev Oncol Hematol 2012; 84: 59-70.
4. Peeters M et al. Analysis of KRAS/NRAS mutations in phase 3 study 20050181 of panitumumab (pmab) plus FOLFIRI versus FOLFIRI for second-line treatment (tx) of metastatic colorectal cancer (mCRC). J Clin Oncol 2014; 32(S3): ASCO-GI 2014, Abstract #LBA387.
5. Pox C et al. S3-guideline colorectal cancer. Z Gastroenterol 2013; 51: 753-854.
6. Gerlinger M et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 2012; 366: 883-92.
7. Løes IM et al. Impact of KRAS, BRAF, PIK3CA, TP53 status and intraindividual mutation heterogeneity on outcome after liver resection for colorectal cancer metastases. Int J Cancer 2016; 139: 647-56.
8. Siyar Ekinci A et al. KRAS discordance between primary and metastatic tumor in patients with metastatic colorectal carcinoma. J BUON 2015; 20: 128-35.
9. Fedyanin M et al. Factors associated with disconcordance of KRAS, NRAS, BRAF, PIK3CA mutation status in the primary tumor and metastases in patients (pts) with colorectal cancer (CRC). Ann Oncology 2016; 27 (suppl 6): ESMO 2016, Abstract #529P.
10. Dressmann D et al. Transforming single DNA molecules into fluorescent magnetic particles for detection and enumeration of genetic variations. Proc Natl Acad Sci USA 2003; 100: 8817-22.
11. Wan JC et al. Liquid biopsies come of age: Towards implementation of circulating tumour DNA. Nat Rev Cancer 2017; 17: 223-38.
12. Schmiegel W et al. Blood-based detection of RAS mutations to guide anti-EGFR therapy in colorectal cancer patients: concordance of results from circulating tumor DNA and tissue-based RAS testing. Mol Oncol 2017; 11: 208-19.
13. Diehl F et al. Circulating mutant DNA to assess tumor dynamics. Nature Med 2008, 14: 985-90.
14. Schwarzenbach H et al. Cell-free nucleic acids as biomarkers in cancer patients. Nature Rev Cancer 2011; 11: 426-37.
15. Tamkovich SN et al. Deoxyribonuclease activity in biological fluids of healthy donors and cancer patients. Bull Exp Biol Med 2008; 146: 89-91.
16. Bettegowda C et al. Detection of circulating tumor DNA in early- and late-stage human malignancies. Sci Transl Med 2014; 6: 224ra24.
17. Van Emburgh BO et al. Acquired RAS or EGFR mutations and duration of response to EGFR blockade in colorectal cancer. Nat Commun 2016; 7: 13665.
18. Morelli MP et al. Characterizing the patterns of clonal selection in circulating tumor DNA from patients with colorectal cancer refractory to anti-EGFR treatment. Ann Oncol 2015; 26: 731-6.
19. Toledo RA et al. Clinical validation of prospective liquid biopsy monitoring in patients with wild-type RAS metastatic colorectal cancer treated with FOLFIRI-cetuximab. Oncotarget 2016, Nov 11 [Epub ahead of print, DOI 10.18632/oncotarget.13311].
20. Siravegna G et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients. Nature Med 2015; 21: 795-801.
21. Tie J et al. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer. Sci Transl Med 2016; 8: 346ra92.
22. Ng SB et al. Individualised multiplexed circulating tumour DNA assays for monitoring of tumour presence in patients after colorectal cancer surgery. Sci Rep 2017; 7: 40737.

PD Dr. med. Alexander Baraniskin
(korrespondierender Autor)
E-Mail schreiben

Prof. Dr. med. Wolff Schmiegel
Medizinische Klinik, Universitätsklinikum Knappschaftskrankenhaus Bochum
In der Schornau 23–25, 44892 Bochum