Seltene Hauttumoren und Plattenepithelkarzinom
Frustraner Versuch mit Checkpoint-Inhibitoren beim Uvea-Melanom
Das maligne Melanom der Haut ist häufig – in Deutschland der fünfthäufigste maligne Tumor bei Männern ebenso wie bei Frauen [1] – ganz im Gegensatz zu einer Variante, die im Auge vorkommt: Das Uvea- oder Aderhaut-Melanom ist zwar der häufigste intraokuläre maligne Tumor, aber insgesamt mit einer Inzidenz von etwa 1 : 100.000 in Europa eine sehr seltene Entität. Es wird zwar oft früh diagnostiziert, aber zum einen wird durch die lokale Behandlung mit Chirurgie, Laser und Bestrahlung meist die Sehleistung eingeschränkt. Zum anderen metastasiert der Tumor in etwa der Hälfte der Fälle letztlich doch in Lunge, Haut, Weichgewebe und Knochen und am häufigsten in die Leber, wie das dem großen amerikanischen Neurologen Oliver Sacks geschah, der vor zwei Jahren an dieser Erkrankung verstarb. Bei Sacks lagen zwischen der Diagnose des Primärtumors und der Metastasierung neun Jahre; in den meisten Fällen geht es schneller, wie die Überlebensraten zeigen, die fünf Jahre nach Diagnose bei 69% liegen, nach 15 Jahren bei 55% und nach 25 Jahren bei 51%. Ab dem Zeitpunkt der Metastasierung beträgt die mediane Überlebenszeit 13,4 Monate, und nach zwei Jahren sind nur mehr 8% der Patienten am Leben [2].
Das Uvea-Melanom unterscheidet sich bezüglich molekularer Eigenschaften, Pathogenese und klinischer Charakteristika vom kutanen Melanom. Insbesondere zeigt es eine geringere Mutationslast und keine Mutationen im BRAF- und NRAS-Gen. Da es im metastasierten Stadium nur sehr wenige und keine zugelassenen therapeutischen Optionen gibt, werden neuerdings immer wieder Immuncheckpoint-Inhibitoren probatorisch eingesetzt. Weil kontrollierte Studien bei derart seltenen Erkrankungen schwierig durchzuführen sind, wurde beim ASCO-Kongress 2016 eine retrospektive Analyse von 58 Patienten präsentiert, die in neun akademischen Zentren in den USA, Brasilien und Spanien behandelt worden waren [3]:
In 40 Fällen hatten die Patienten Pembrolizumab erhalten (meist mit 2 mg/kg), in 16 Fällen Nivolumab (meist 3 mg/kg) und zwei Patienten waren mit Atezolizumab behandelt worden. 36 Patienten waren vorher mit Ipilimumab behandelt worden. Die Wirkung war enttäuschend: Es gab in zwei Fällen eine partielle Remission und in fünf Fällen eine Krankheitsstabilisierung über mindestens sechs Monate. Die vorherige Gabe von Ipilimumab schien keinen Einfluss auf die Wirkung der PD-1- bzw. PD-L1-Inhibitoren zu haben.
Dieser Therapieansatz ist bisher offenbar nicht besonders erfolgreich, und auch in ersten kleinen Fallserien, in denen die Kombination aus Nivolumab und Ipilimumab eingesetzt wurde, sind die Ergebnisse nicht viel verheißungsvoller. In künftigen Studien wird es notwendig sein, einen Vergleichsarm mitzuführen, in dem die Patienten „best supportive care“ erhalten, um eine mögliche Wirkung der Intervention besser einschätzen zu können.
Merkelzellkarzinom: Ansprechen auf PD-L1-Inhibitor
Das Merkelzellkarzinom ist ein seltener neuroendokriner Tumor der Haut (Inzidenz in Europa ca. 0,13 pro 100.000) und zählt zu den Tumoren, bei denen eine infektiöse Genese (durch das Merkelzell-Polyomavirus) in sehr vielen Fällen vermutet wird. Neben dem Polyomavirus sind UV-Strahlung, Immunsuppression und höheres Alter als Risikofaktoren anerkannt. Die Letalität liegt bei über einem Drittel und damit erheblich höher als beim kutanen Melanom. Die Häufigkeit nimmt seit etwa 30 Jahren zu, aber die 5-Jahres-Überlebensraten bei Patienten mit fortgeschrittener Erkrankung sind mit maximal 18% frustrierend niedrig. Der Tumor spricht zwar auf eine Chemotherapie an, aber das Überleben konnte damit nicht verlängert werden [4].
Die Forschung zum Merkelzellkarzinom ist in den vergangenen Jahren stark intensiviert worden und hat unter anderem eine Reihe von potenziellen Biomarkern gefunden, die möglicherweise mit einem aggressiveren Verlauf assoziiert sein könnten. Dazu zählt etwa die Expression des PD-1-Liganden PD-L1, und das war Anlass für zwei einarmige Phase-II-Studien:
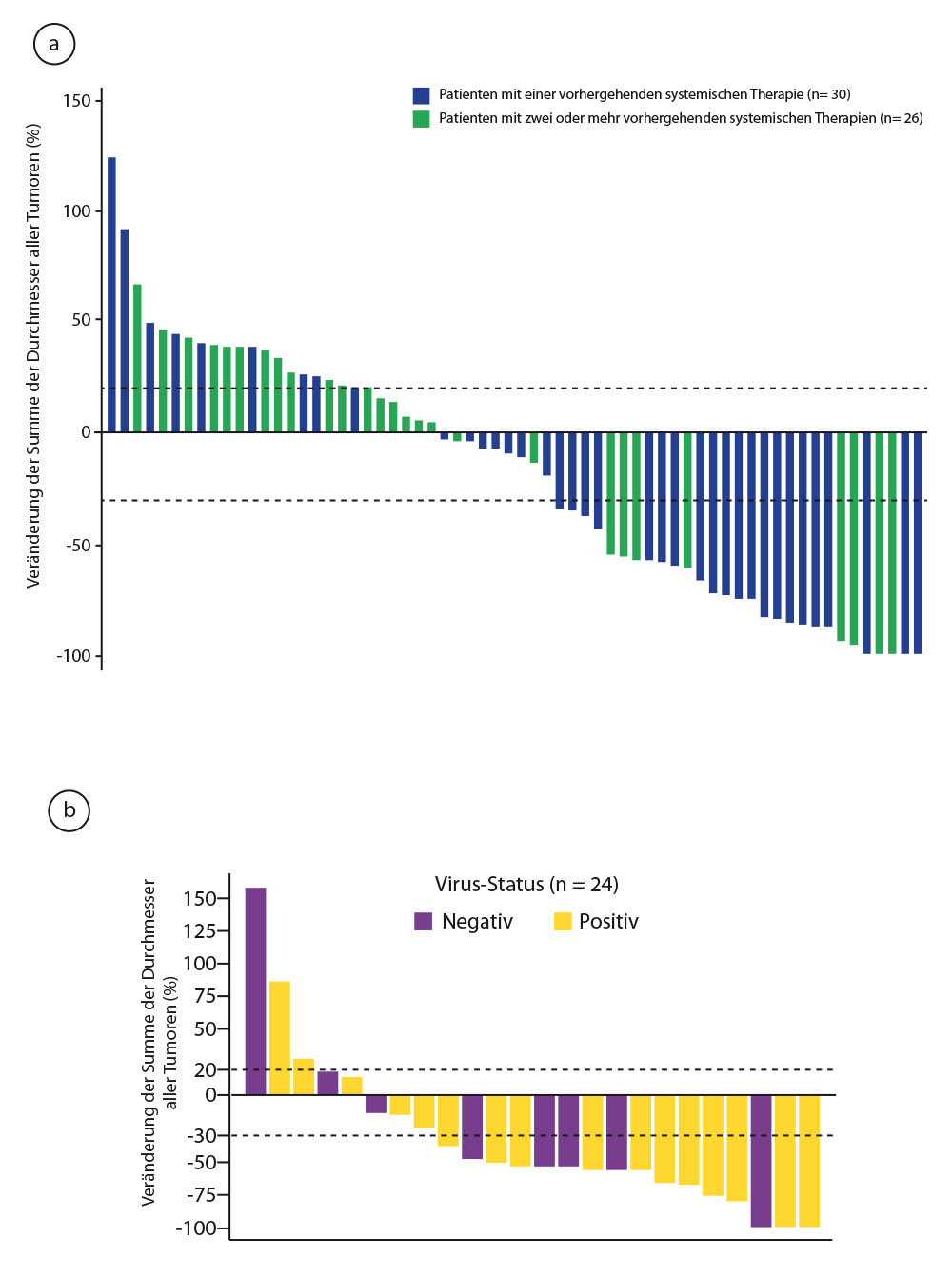
- In die JAVELIN-Studie schlossen 35 Zentren in Nordamerika, Europa, Australien und Asien 88 Patienten mit histologisch gesichertem, Chemotherapie-refraktärem Merkelzellkarzinom im Stadium IV ein [5]. Die PD-L1-Expression und der Polyomavirus-Status spielten bei der Auswahl keine Rolle. Die Patienten erhielten den PD-L1-Inhibitor Avelumab in einer Dosierung von 10 mg/kg i. v. alle zwei Wochen bis zur Progression oder dem Auftreten von Unverträglichkeitszeichen.
Ein Ansprechen war bei 28 Patienten (31,8%) zu beobachten, bei acht davon eine komplette Remission (Abb. 1a). Bei 23 dieser Patienten dauerte die Remission zum Zeitpunkt der Auswertung nach median 10,4 Monaten Behandlungszeit noch an. Neun weitere Patienten erzielten eine Krankheitsstabilisierung. Bei insgesamt vier Patienten traten fünf Grad-3-Nebenwirkungen auf, darunter zweimal eine Lymphopenie und je einmal ein Anstieg der Kreatinphosphokinase, von Aminotransferasen und des Cholesterinspiegels. Bei fünf Patienten wurden außerdem schwere behandlungsbedingte unerwünschte Ereignisse beobachtet: eine Enterokolitis, eine Infusionsreaktion, ein Aminotransferasen-Anstieg, eine Chondrokalzinose, eine Synovitis und eine interstitielle Nephritis.
In einer Anfang April 2017 beim AACR-Kongress vorgestellten aktualisierten Auswertung wurde über mittlerweile 29 Remissionen berichtet [6]. Interessanterweise war die Ansprechrate bei den Patienten, deren Tumoren PD-L1 exprimierten, mit 36,2% doppelt so hoch wie bei den PD-L1-negativen (18,8%). Bei den Patienten mit Polyomavirus-negativen Tumoren war das Ansprechen etwas, aber nicht dramatisch höher als bei den positiven Patienten (35,5% vs. 28,3%). Ein möglichst früher Einsatz von Avelumab scheint sich zu lohnen: Patienten, die vorher lediglich eine Therapielinie erhalten hatten, sprachen zu 40,4% an, die stärker vorbehandelten nur zu 22,2%. Die progressionsfreie 1-Jahres-Überlebensrate liegt bei 30%, die 1-Jahres-Gesamtüberlebensrate bei 52%.
- In einer weiteren nicht-kontrollierten Phase-II-Studie erhielten 26 Patienten mit fortgeschrittenem Merkelzellkarzinom, die zuvor nicht systemisch behandelt worden waren, den PD-1-Inhibitor Pembrolizumab (2 mg/kg alle drei Wochen; [7]). Primärer Endpunkt war auch hier die Ansprechrate, und sie lag bei den 25 auswertbaren Patienten bei 56%
(13 Patienten) mit vier Komplettremissionen (Abb. 1b). Bei zwei der remittierten Patienten war nach median 33 Wochen Nachbeobachtung ein Rezidiv aufgetreten. Nach sechs Monaten waren 67% der Patienten progressionsfrei am Leben. In dieser Studie war die Ansprechrate bei den Virus-positiven Patienten höher (62% vs. 44%), ein Vergleich, der bei der geringen Fallzahl nicht sehr aussagekräftig ist. 15% der Patienten berichteten über behandlungsbedingte Nebenwirkungen vom Grad 3 oder 4.
Diese Daten machen Checkpoint-Inhibitoren zu den künftigen Standards in der Behandlung des Merkelzellkarzinoms. Aufgrund der Ergebnisse der
JAVELIN-Studie wurde Avelumab vor Kurzem in Nordamerika als erste Therapie überhaupt zur Behandlung des metastasierten Merkelzellkarzinoms zugelassen. Für die Europäische Union ist die Zulassung beantragt, Patienten können derzeit ab der Zweitlinie in einem Early-Access-Programm behandelt werden. Außerdem laufen Studien, in denen die adjuvante Gabe von Ipilimumab nach Resektion bei Hochrisiko-Patienten erprobt wird.
Plattenepithelkarzinome der Haut
Wesentlich weniger beachtet für systemtherapeutische Ansätze als das maligne Melanom werden die anderen Hautkrebs-Formen, vor allem Basalzellkarzinom und Plattenepithelkarzinom. Sie treten zwar um ein Vielfaches häufiger auf als das Melanom, haben aber im Allgemeinen eine ausgezeichnete Prognose [1]. Das Plattenepithelkarzinom metastasiert häufiger als das Basalzellkarzinom, hat aber dennoch eine sehr gute Prognose mit einer 5-Jahres-Überlebensrate von 95%. Probleme machen hier vor allem die inoperablen, lokal fortgeschrittenen Tumoren, bei denen eine Immuncheckpoint-Blockade vielversprechend sein könnte: Plattenepithelkarzinome der Haut gehören nämlich zu den Tumoren mit den höchsten Mutationsraten überhaupt [8], was mit der entsprechenden Expression von Neoantigenen einhergehen dürfte, die wiederum Zielstrukturen für das Immunsystem darstellen. Interessanterweise lassen sich bei mehr als 90% der kutanen Plattenepithelkarzinome Tumor-infiltrierende Lymphozyten nachweisen, von denen 60% PD-L1 exprimieren, ebenso wie ein Viertel der Tumorzellen [9]. Außerdem ist eine Immunsuppression, beispielsweise nach Organtransplantation, ein bekannter Risikofaktor für diese Tumoren [10].
Kasuistische Berichte von einem erfolgreichen Einsatz von PD-1- bzw. PD-L1-Inhibitoren [11] haben daher die Planung klinischer Studien getriggert, darunter eine einarmige Phase-II-Studie, in der ein neuer, voll humaner PD-1-Antikörper, RGN 2810, bei Patienten mit metastasiertem oder nicht resezierbarem, lokal fortgeschrittenem kutanem Plattenepithelkarzinom getestet wird (ClinicalTrials.gov No. NCT02760498). Primärer Endpunkt der Studie, an der auch sieben deutsche Zentren beteiligt sind, ist die objektive Ansprechrate. Ergebnisse gibt es noch nicht, aber zwei eindrucksvolle Fallbeschreibungen, in denen ein Patient mit metastasiertem Basalzellkarzinom unter der Antikörpertherapie eine nahezu komplette und ein weiterer mit Plattenepithelkarzinom eine vollständige Remission erzielen konnten [12].
Literatur
1. Robert Koch-Institut/Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V. Krebs in Deutschland 2011/2012. 10. Ausgabe, 2015
2. Kuk D et al. Prognosis of mucosal, uveal, acral, nonacral cutaneous, and unknown primary melanoma from the time of first metastasis. Oncologist. 2016; 21: 848-54.
3. Tsai KK et al. Efficacy and safety of programmed death receptor-1 (PD-1) blockade in metastatic uveal melanoma (UM). J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9507.
4. Schadendorf D et al. Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs. European Journal of Cancer 2017; 71: 53.69.
5. Kaufman HL et al. Avelumab in patients with chemotherapyrefractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol 2016; 17: 1374-85.
6. Kaufman HL et al. Durable responses to avelumab (anti-PD-L1) in patients with Merkel cell carcinoma progressed after chemotherapy: 1-year efficacy update. AACR Annual Meeting 2017, Abstract CT079.
7. Nghiem PT et al. PD-1 blockade with pembrolizumab in advanced Merkel-cell carcinoma. N Engl J Med 2016; 374: 2542-52.
8. Pickering CR et al. Mutational landscape of aggressive cutaneous squamous cell carcinoma. Clin Cancer Res 2014; 20: 6582-92.
9. Schaper K et al. The pattern and clinicopathological correlates of programmed death-ligand 1 expression in cutaneous squamous cell carcinoma. Br J Dermatol 2017; 176: 1354-6..
10. Euvrard S et al. Skin cancers after organ transplantation. N Engl J Med 2003; 348: 1681-91.
11. Lipson EJ et al. Tumor Regression and Allograft Rejection after Administration of Anti-PD-1. N Engl J Med 2016; 374: 896-8..
12. Falchook GS et al. Responses of metastatic basal cell and cutaneous squamous cell carcinomas to anti-PD1 monoclonal antibody REGN2810. J Immunother Cancer 2016; 4: 70.

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstraße 9–11/Thalkirchner Straße 48
80337 München
+49 89 4400 0
+49 89 4400 56226
E-Mail schreiben