Immuntherapien gegen das metastasierte Melanom: Was gibt es Neues?
Das Melanom zählt zu den malignen Tumoren mit den höchsten somatischen Mutationsraten [1]. Das geht mit einer erhöhten Expression von Neoantigenen einher, durch die solche Tumoren für das Immunsystem besser erkennbar werden. Versuche, das Melanom mit immunologisch ausgerichteten Therapien (v. a. Vakzinierungen mit u. a. dendritischen Zellen, Interferone, Interleukin-2) zu behandeln, wurden deshalb bereits früh begonnen – mit allerdings nur mäßigem Erfolg. Mittlerweile sind die Gründe dafür besser bekannt: Die Regulation des immunologischen Geschehens im Körper ist wesentlich komplexer als man früher dachte und basiert unter anderem auf sogenannten Immuncheckpoints, mit denen überschießende Aktivitäten, die beispielsweise zu Autoimmunreaktionen führen können, verhindert werden sollen. Insbesondere zwei von zahlreichen derartigen Mechanismen – die CTLA-4/B7- und die PD-1/PD-L1-Achse – sind in den letzten Jahren intensiv untersucht und für therapeutische Zwecke nutzbar gemacht worden.
Wirkmechanismus von Checkpoint-Inhibitoren
CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) und PD-1 (programmed cell death 1) sind Oberflächenrezeptoren, die auf T-Lymphozyten exprimiert werden und an Liganden wie B7 und PD-L1 auf anderen Körperzellen (z. B. dendritischen und anderen Antigen-präsentierenden Zellen) binden können. Die Interaktionen an diesen Immuncheckpoints gehen mit inhibitorischen Signalen für die T-Zellen einher und dienen unter normalen Umständen dazu, überschießende Aktivitäten des Immunsystems wie Autoimmunreaktionen zu verhindern. Die Zellen vieler maligner Tumoren machen sich diese Mechanismen zunutze, indem sie zum Beispiel ebenfalls PD-L1 exprimieren und die T-Zellen dadurch für sich unschädlich machen. Die Hemmung dieser Interaktionen durch Immuncheckpoint-Inhibitoren wiederum kann diese Blockade aufheben und führt im Idealfall dazu, dass die T-Zellen ihre zytotoxische Aktivität wiederaufnehmen und die Tumorzellen angreifen.
Langzeitüberleben unter Checkpoint-Inhibitoren
Checkpoint-Inhibitoren, die durch Aktivierung tumorspezifischer T-Lymphozyten wirken, gehen zwar mit niedrigeren Ansprechraten und einem kürzeren progressionsfreien Überleben einher als die Behandlung mit BRAF- und MEK-Inhibitoren, erhöhen aber den Anteil der Melanom-Patienten, die langfristig überleben. Das zeigte sich bereits in einer gepoolten Analyse der Studien mit dem am längsten verfügbaren CTLA-4-Antikörper Ipilimumab, wo etwa jeder fünfte Patient nach drei Jahren noch am Leben war [2] und mehr noch bei Gabe der
PD-1-Antikörper Nivolumab [3, 4] und Pembrolizumab [5, 6], wo die 2-Jahres-Überlebensraten zwischen 40% und 50% liegen. Für Nivolumab werden mittlerweile 5-Jahres-Daten von 34% angegeben [7].
Ipilimumab wird lediglich viermal im Abstand von drei Wochen gegeben und zeigt relativ niedrige Ansprechraten von weniger als 20%, führt aber interessanterweise bei etwa einem Fünftel der Patienten mit fortgeschrittenem bzw. metastasiertem Melanom zu einem Langzeitüberleben von bis zu zehn Jahren [2]. Nachteilig ist ein höherer Anteil von Patienten, die potenziell irreversible, immunologisch vermittelte Nebenwirkungen entwickeln. Die PD-1-Inhibitoren Nivolumab und Pembrolizumab zeigen höhere Ansprechraten in der Erstlinie von 30–40% und 2-Jahres-Überlebensraten zwischen 40% und 50% [3–6]. Für Nivolumab werden mittlerweile 5-Jahres-Raten von 34% angegeben [7]. Von Nachteil ist bei diesen Antikörpern, dass man sie alle zwei Wochen (Nivolumab) beziehungsweise alle drei Wochen (Pembrolizumab) als Infusionen kontinuierlich geben muss und dass unklar ist, welche Therapiedauer sinnvoll ist.
Kombination von Checkpoint-Inhibitoren
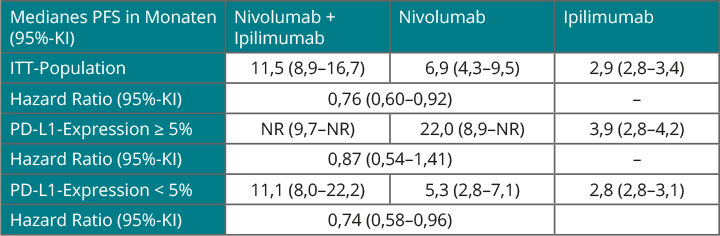
Alle drei Antikörper sind zur Therapie des fortgeschrittenen, nicht resezierbaren oder metastasierten Melanoms zugelassen, ebenso wie mittlerweile auch die Kombination aus Nivolumab und Ipilimumab, die in der CheckMate-067-Studie die jeweiligen Monotherapien hinsichtlich Ansprechen und progressionsfreiem Überleben noch übertraf, auch wenn sie deutlich toxischer war [8]. In einer beim ASCO-Kongress 2016 vorgestellten aktualisierten Auswertung der CheckMate-067-Studie [9] war die Kombination nach mindestens 18-monatiger Nachbeobachtung mit einem progressionsfreien Überleben von median
11,5 Monaten sowohl der Nivolumab-
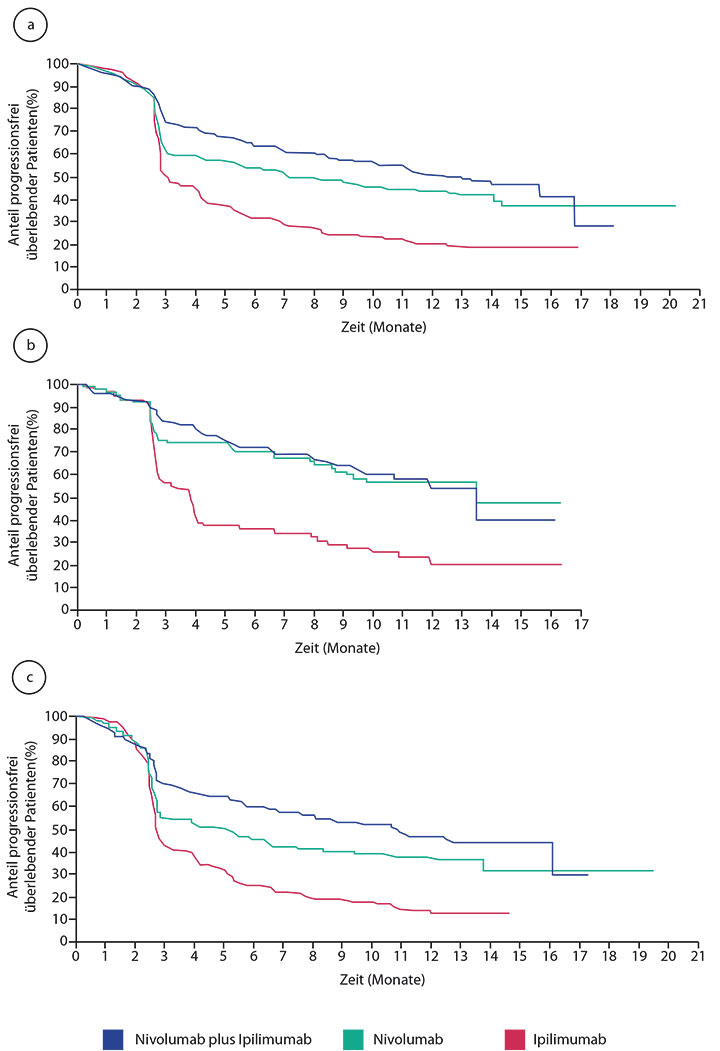
(6,9 Monate) als auch der Ipilimumab-Monotherapie (2,9 Monate) deutlich überlegen (HR 0,76 gegenüber Nivolumab und 0,42 gegenüber Ipilimumab). Eine Überlegenheit der Kombination war unabhängig vom BRAF-Mutationsstatus und von der PD-L1-Expression zu sehen, wenngleich Patienten mit höheren PD-L1-Werten sowohl von Nivolumab alleine als auch von der Kombination erheblich stärker profitierten (Tab. 1). Allerdings lassen die Kurven zum progressionsfreien Überleben die Vermutung zu, dass von der Kombination gegenüber der Nivolumab-Monotherapie langfristig nur Patienten mit PD-L1-negativen Tumoren profitieren, d. h. diejenigen mit einer PD-L1-Expression auf weniger als 5% der Tumorzellen (in dieser Studie ungefähr zwei Drittel der Patienten; Abb. 1; [8]).
Die Sicherheitsdaten entsprechen denen aus der initialen Auswertung, zeigen allerdings auch, dass die Kombination deutlich toxischer ist mit einer Rate an Grad-3/4-Nebenwirkungen von 56,5% gegenüber 19,8% unter Nivolumab und 27,0% unter Ipilimumab und toxizitätsbedingten Therapieabbrüchen in 30,7% versus 7,3% bzw. 13,5% der Fälle. Dennoch erfuhren zwei Drittel der Patienten, die die Kombinationstherapie abbrechen mussten, ein Ansprechen. Die häufigsten therapiebedingten Nebenwirkungen im Kombinationsarm waren gastrointestinaler (15,3% vom Grad 3/4), endokriner (5,8%) und hepatischer Natur (19,8%).
Eine weitere beim ASCO 2016 präsentierte Analyse der CheckMate-067-Daten belegt sogar, dass die Patienten, die Nivolumab plus Ipilimumab wegen Nebenwirkungen abgesetzt hatten, hinsichtlich des Gesamtüberlebens nach zwei Jahren mindestens genauso profitiert haben (71%) wie sämtliche Patienten im Kombinationsarm (64%) und deutlich stärker als die im Ipilimumab-Arm (54%; [10]), obwohl im Ipilimumab-Arm mehr als doppelt so viele Patienten nach einem Therapieabbruch weitere systemische Therapien erhalten hatten als im Kombinationsarm (64% vs. 31%).
In eine ähnliche Richtung deuten die Resultate einer gepoolten Analyse der Daten aus der CheckMate-067-Studie und der Phase-II-Studie CheckMate-069, die beim SMR-Kongress 2016 in Boston präsentiert wurde [11]. Hier zeigte sich, dass Patienten, bei denen die Therapie wegen therapieinduzierter Nebenwirkungen abgebrochen wurde, beim progressionsfreien Überleben (HR 0,74; p < 0,04) ebenso wie bei der Ansprechrate (68% vs. 50%; p = 0,02) signifikant besser abschnitten als solche, deren Therapie nach Protokoll durchgeführt wurde. Eine mögliche Erklärung dafür könnte sein, dass die höhere Toxizität mit einer besseren Wirksamkeit korreliert, aber die Ergebnisse könnten auch dadurch verfälscht sein, dass wichtige Prognosefaktoren wie Tumorstadium und erhöhte LDH-Konzentrationen in den beiden Gruppen nicht gleich verteilt waren. Die häufigsten Gründe für einen Therapieabbruch waren in beiden Studien eine Autoimmunkolitis mit Diarrhö, eine Erhöhung der Leberenzyme sowie eine Pneumonitis gewesen.
Auf dem Kongress der American Association for Cancer Research (AACR) vor wenigen Wochen schließlich wurden die Ergebnisse von CheckMate-067 erneut aktualisiert und die Daten zum Gesamtüberleben veröffentlicht [12]: Gesamt- und progressionsfreies Überleben der Kombination waren gegenüber der Ipilimumab-Monotherapie signifikant (HR 0,55 bzw. 0,42) und gegenüber der Nivolumab-Monotherapie numerisch verlängert; im letzteren Fall war beim Gesamtüberleben keine statistische Signifikanz erreicht worden (HR 0,88; 95%-KI 0,69–1,12), wobei die Studie auf diesen Vergleich mit Nivolumab auch nicht gepowert war. Wiederum schnitten die Patienten mit PD-L1-negativen Tumoren bei den Überlebensdaten schlechter ab als die mit einer PD-L1-Expression von ≥ 5%. Beim Ansprechen war allerdings auch in dieser Subgruppe die Kombination überlegen mit einer Gesamtansprechrate von 73,5% gegenüber 58,8% unter Nivolumab alleine. Ganz ähnliche Ergebnisse zeigten sich auch, wenn der Cut-off-Wert nicht bei 5%, sondern bei 1% gesetzt wurde. Die mediane Dauer der Remissionen und die mediane Zeit bis zur Einleitung einer Folgetherapie sind im Kombinationsarm noch nicht erreicht, im Nivolumab-Arm liegen sie bei 31,1 bzw. 26,8 Monaten.
Auf der Grundlage der CheckMate-067-Daten wurde die Kombination aus Ipilimumab und Nivolumab im Mai 2016 von der Europäischen Kommission zur Therapie des nicht resektablen oder metastasierten Melanoms zugelassen. Die Behandlung wird begonnen mit einer Induktionstherapie aus vier dreiwöchigen Infusionszyklen, bei denen Ipilimumab in einer Dosierung von 3 mg/kg KG und Nivolumab in einer reduzierten Dosis von 1 mg/kg gegeben wird. Lässt sich ein Ansprechen nachweisen und ist die Behandlung gut verträglich, so wird sie als Monotherapie mit Nivolumab in einer Dosierung von 3 mg/kg KG alle zwei Wochen fortgesetzt.
Pembrolizumab in Kombination mit Ipilimumab
Die Kombination aus Ipilimumab und dem PD-1-Inhibitor Pembrolizumab, die bisher nicht zugelassen ist, scheint ähnlich verträglich und effektiv zu sein wie die aus Ipilimumab und Nivolumab: In der Phase-I/II-Studie KEYNOTE-029 wurden in einer Dosisexpansions-Kohorte Ipilimumab mit 1 mg/kg KG alle drei Wochen über vier Zyklen und Pembrolizumab mit 2 mg/kg KG alle drei Wochen über bis zu zwei Jahre dosiert mit einer objektiven Ansprechrate von 57% (mit 5% Komplettremissionen) und einer Rate an schweren Nebenwirkungen von 42% [13].
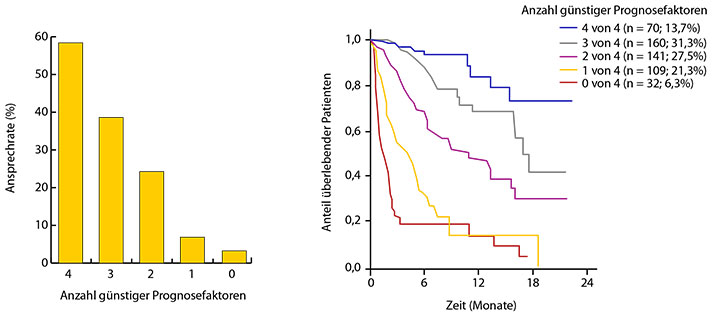
Für Pembrolizumab konnten überdies vier Biomarker identifiziert werden, mit deren Hilfe sich eine gute Prognose vorhersagen lässt: LDH-Konzentrationen, die höchstens dem Zweieinhalbfachen des oberen Grenzwerts des Normbereichs entsprechen, ein relativer Lymphozyten-Anteil von 17,5% oder mehr, ein Eosinophilen-Anteil von 1,5% oder mehr sowie das Fehlen viszeraler Metastasen (ausgenommen in der Lunge). In drei verschiedenen Subgruppen einer Kohorte von insgesamt 616 Patienten konnte ein signifikanter positiver prognostischer Einfluss dieser vier Faktoren bestätigt werden [14]: Sowohl bei der Ansprechrate als auch beim Gesamtüberleben fielen die Ergebnisse umso besser aus, je mehr dieser vier Faktoren vorhanden waren (Abb. 2).
Fazit Immuntherapie
Die Therapie mit einem gegen PD-1 gerichteten Antikörper mit oder ohne Zugabe von Ipilimumab ist heute die Standardtherapie zumindest beim fortgeschrittenen Melanom ohne BRAF-Mutation. Die Ipilimumab-Monotherapie bietet sich für spätere Therapielinien an. Ob man in der Erstlinie eine Monotherapie mit einem PD1-Antikörper oder die Kombination mit Ipilimumab gibt, ist eine Frage, für deren Beantwortung in vielen Fällen nicht zuletzt die Akzeptabilität der schwereren Toxizität entscheidend sein wird, die man sich mit der Kombination einhandelt. Zu bedenken ist hierbei, dass auch dann, wenn man wegen dieser Nebenwirkungen die Therapie abbrechen muss, ein gutes Ansprechen möglich bleibt. Unklar ist außerdem weiterhin die optimale Dauer der Therapie: In einer Analyse von 655 Patienten aus der KEYNOTE-001-Studie waren nach drei Jahren noch 40% am Leben [15]. Insbesondere wurden 61 Patienten nachbeobachtet, die nach Erreichen einer kompletten Remission die Therapie beendet hatten. Von ihnen waren zum Zeitpunkt der Analyse 97% weiter in Remission, und zwar für bislang median zehn Monate. Diese Daten sind eindrucksvoll, auch wenn sie aus einer frühen Phase der klinischen Entwicklung stammen und deshalb nicht überbewertet werden sollten.
Immun- und zielgerichtete Therapien: Kombiniert oder in Sequenz?
Neben Kombinationen von mehreren Immuntherapien sind bei Patienten mit BRAF-mutiertem Melanom auch Kombinationen aus Checkpoint-Inhibitor und BRAF-/MEK-Inhibitoren denkbar, wenngleich bislang nicht zugelassen.
Die Kombination von BRAF- und MEK-Inhibitor zeigt die höchsten Ansprechraten aller Melanomtherapien. Weil das Ansprechen außerdem sehr schnell erfolgt, eignet sich diese Behandlung insbesondere als Erstlinientherapie für Patienten mit symptomatischem BRAF-mutiertem Melanom mit schneller Progression, bei denen ein hoher Therapiedruck besteht. Die Therapiedauer wird jedoch meist durch die Entwicklung von Resistenzen limitiert: In der co-BRIM-Studie etwa (Vemurafenib plus Cobimetinib versus Vemurafenib plus Placebo) hatte sich der Anteil an progredienten Patienten von 32% bei der ersten Auswertung nach median 7,3 Monaten [16] bis zur endgültigen Analyse nach median 14,3 Monaten auf 58% beinahe verdoppelt [17]. Bisher gibt es keine Marker, mit denen sich diejenigen Patienten vorab identifizieren lassen, die kein optimales Langzeit-Ansprechen auf BRAF- und MEK-Inhibition zeigen, abgesehen von der Tatsache, dass in allen klinischen Studien die Ergebnisse bei Patienten mit hohen LDH-Konzentrationen schlechter ausgefallen waren.
Präklinische Befunde zeigen, dass BRAF- und MEK-Inhibitoren immunologische Funktionen keinesfalls hemmen, sondern möglicherweise sogar immunmodulierend und -aktivierend wirken könnten. Der Gedanke, zielgerichtete und Immuntherapien miteinander zu kombinieren, liegt deshalb nahe. Ein solcher Ansatz dürfte allerdings nicht für alle Patienten praktikabel sein, weil die sicherlich höhere klinische Aktivität von drei oder sogar vier Medikamenten vermutlich mit deutlich schwererer Toxizität und außerdem höheren Kosten einherginge. In künftigen Studien zu diesem Thema müssen deshalb auf jeden Fall prognostische und besser noch prädiktive Faktoren identifiziert werden, mit denen man die Patienten, bei denen der hohe Therapiedruck die stärkere Toxizität einer Kombination rechtfertigt, von denjenigen differenzieren kann, für die ein langfristiger Nutzen eher durch eine sequenzielle Behandlung – zuerst mit BRAF-/MEK-Inhibitoren und bei Entwicklung einer Resistenz mit anschließender Immuntherapie – zu erzielen ist.
Sequenztherapien
Ist die Toxizität ein limitierender Faktor oder weist der Patient eine günstige Prognose auf, ist die Sequenztherapie sicherlich eine gute Option. Die optimale Sequenz der beiden Modalitäten wird zurzeit in einer ganzen Reihe klinischer Studien untersucht:
In einer US-amerikanischen Phase-III-Studie (ECOG/ACRIN 6134; ClinicalTrials.gov No. NCT02224781) erhalten die Patienten entweder zunächst eine Immuntherapie mit Ipilimumab (vier Dosen) und Nivolumab (bis zur Progression) und wechseln im Falle einer Progression auf die Kombination aus Dabrafenib und Trametinib oder sie werden in der umgekehrten Reihenfolge mit den beiden Kombinationen behandelt.
In einer europäischen Phase-III-Studie, an der sich in Deutschland die Universitäts-Hautklinik Tübingen beteiligt, werden der BRAF-Inhibitor Encorafenib und der MEK-Inhibitor Binimetinib einerseits sowie der CTLA-4-Inhibitor Ipilimumab und der PD-1-Inhibitor Nivolumab andererseits miteinander kombiniert. In drei randomisierten Armen werden die Sequenz aus BRAF-/MEK-Inhibition, bei Progression gefolgt von der Immuntherapie, die umgekehrte Sequenz sowie im dritten Arm eine „Sandwich“-Option getestet, bei der auf eine achtwöchige Induktion mit der zielgerichteten Therapie die Immuntherapie folgt, die bei Progression wiederum durch die BRAF-/MEK-Inhibition ersetzt wird (ClinicalTrials.gov No. NCT02631447).
In eine deutsche Phase-II-Studie sollen 176 Patienten eingeschlossen werden, die zunächst für drei Monate Vemurafenib und Cobimetinib erhalten werden (ClinicalTrials.gov No. NCT02902029). Nach der darauffolgenden Biomarker-Auswertung werden sie randomisiert, entweder weiter die BRAF-/MEK-Inhibitor-Kombination oder den PD-L1-Inhibitor Atezolizumab zu bekommen. Stellt sich eine Progression ein, so wird auf die jeweils andere Therapie gewechselt, die wiederum bis zum Auftreten einer Progression gegeben wird. Primärer Endpunkt ist das Überleben ohne eine solche zweite Progression (PFS2).
Simultane Gabe von BRAF-/MEK- und Checkpoint-Inhibitoren
In der internationalen Phase-I/II-Studie KEYNOTE-022 wird die Erstlinientherapie mit einer direkten Kombination von BRAF-/MEK- und dem
PD-1-Inhibitor Pembrolizumab getestet (ClinicalTrials.gov No. NCT02130466): In einer ersten Phase erhielten bisher 15 nicht vorbehandelte Patienten Dabrafenib (150 mg zweimal täglich), Trametinib (2 mg täglich) und Pembrolizumab (2 mg/kg KG alle drei Wochen). Bei Auftreten von ernsthaften Nebenwirkungen waren Dosisreduktionen erlaubt. Drei Fälle von dosislimitierender Toxizität waren nach Unterbrechung oder Abbruch der Behandlung reversibel und gestatten derzeit die Fortführung der Studie in einer zweiten Phase mit den genannten Dosierungen [18]. Die Ansprechrate unter den 15 Patienten lag bei 60% (neun partielle Remissionen) und rechtfertigt damit die weitere Erprobung dieser Kombination in der Erstlinie.
In der globalen Phase-III-Studie
TRILOGY, an der sich auch 20 deutsche Zentren beteiligen, wird bei Patienten mit fortgeschrittenem bzw. metastasiertem, nicht vorbehandeltem, BRAF-V600-mutiertem Melanom die Kombination aus Atezolizumab, Vemurafenib und Cobimetinib randomisiert gegen die einfache BRAF-/MEK-Inhibitor-Kombination getestet (ClinicalTrials.gov No. NCT02908672). Primärer Endpunkt wird das progressionsfreie Überleben sein.
Therapie in der adjuvanten Situation
Zur adjuvanten Therapie des resezierten, nicht metastasierten Melanoms ist derzeit in Europa lediglich Interferon a zugelassen, das bei häufigen und teilweise starken Nebenwirkungen einen begrenzten Nutzen gezeigt hat. Zur adjuvanten Therapie mit Checkpoint-Inhibitoren gibt es bisher nur aussagekräftige Daten aus einer Phase-III-Studie, in der 951 Patienten mit Melanom im Stadium III mit hohem Rezidivrisiko auf Ipilimumab oder Placebo randomisiert worden waren [19]. Ipilimumab wurde hier zunächst viermal im Abstand von jeweils drei Wochen mit 10 mg/kg KG und dann im 3-Monats-Abstand für bis zu drei Jahre gegeben. Nach median 2,7 Jahren war der Checkpoint-Inhibitor beim progressionsfreien Überleben mit median 26,1 versus 17,1 Monaten signifikant überlegen gewesen (HR für Progress oder Tod 0,75; 95%-KI 0,64–0,90; p = 0,0013).
In einer aktualisierten Analyse mit einer Nachbeobachtungszeit von median 5,3 Jahren war der Vorteil beim rezidivfreien Überleben mit median 27,6 versus 17,1 Monaten weitgehend konstant geblieben (HR 0,76; p = 0,0008). Es zeigte sich auch eine deutliche Überlegenheit für Ipilimumab beim Gesamtüberleben mit einer 5-Jahres-Überlebensrate von 65,4% gegenüber 54,4% im Placeboarm (HR 0,72; 95%-KI 0,58–0,88; p = 0,001; [20]). Diese Überlegenheit von Ipilimumab konnte auch für das fernmetastasenfreie Überleben nachgewiesen werden mit median 48,3 versus 27,5 Monaten (HR 0,76; p = 0,002). Allerdings traten bei 54,1% dieser Patienten und damit bei doppelt so vielen wie im Placeboarm (26,2%) Nebenwirkungen vom Grad 3 oder 4 auf; bei 41,6% versus 2,7% der Patienten waren diese schweren Toxizitäten immunologisch bedingt, und im Ipilimumab-Arm waren sie für fünf Todesfälle verantwortlich, die in drei Fällen auf eine Kolitis zurückgingen.
Die adjuvante Therapie mit Ipilimumab zeigt damit zweifellos Vorteile, vor allem beim rezidivfreien und beim Gesamtüberleben: Immerhin sind nach fünf Jahren 11% mehr Patienten als im Placeboarm am Leben. Nachteile sind die hohe Dosierung von 10 mg/kg, die in dieser Studie (im Gegensatz zu 3 mg/kg in der metastasierten Situation) verwendet wurde, und die lange Therapiedauer von drei Jahren. Abgesehen von den Kosten führt das zu zahlreichen und schweren Nebenwirkungen, die zum Teil nicht reversibel sind und in Einzelfällen sogar einen letalen Ausgang hatten. In den USA ist Ipilimumab in dieser Indikation bereits zugelassen.
Spielt die Dosis eine Rolle?
Ob die Dosierung von Ipilimumab eine Rolle spielt, wurde in der fortgeschrittenen Situation in einer Phase-III-Studie untersucht, deren erste Resultate beim ESMO-Kongress 2016 in Kopenhagen präsentiert wurden [21]: Darin waren
727 Patienten mit nicht resezierbarem oder metastasiertem Melanom, die noch keine Vorbehandlung erhalten hatten, randomisiert mit entweder 3 oder mit 10 mg/kg KG Ipilimumab (viermal im Abstand von je drei Wochen) behandelt worden. Wenn sie ansprachen und danach wieder progredient waren, konnte nach 24 Wochen ein weiterer derartiger Zyklus gegeben werden; das war bei 23 Patienten im 10 mg-Arm und bei 32 im 3 mg-Arm der Fall.
Beim Gesamtüberleben schien die höhere Dosis tatsächlich signifikant überlegen mit einer Medianzeit von 15,7 gegenüber 11,5 Monaten unter der niedrigeren Dosierung (HR 0,84; p = 0,04). Die Überlebenskurven begannen sich nach etwa neun Monaten zu trennen und zeigten bereits nach einem Jahr einen sichtbaren Abstand (54% vs. 48%), der sich nach zwei und nach drei Jahren noch vergrößert hatte (nach zwei Jahren 38% vs. 31%, nach drei Jahren 31% vs. 23%). Jenseits von drei Jahren scheinen die Kurven ein Plateau zu erreichen, das für den 3 mg-Arm mit rund 20% auf einem ähnlichen Niveau liegt wie es für die älteren Studien mit Ipilimumab gefunden wurde [2].
Weitere adjuvante Regimes im Test
Neben Ipilimumab werden weitere Immuntherapien in der adjuvanten Situation getestet:
In der CheckMate-238-Studie, die die Rekrutierung bereits abgeschlossen hat, wurden Patienten mit komplett resezierten Melanomen im Stadium IIIB/C oder IV auf Nivolumab versus Ipilimumab randomisiert (ClinicalTrials.gov No. NCT02388906).
In der randomisierten, unabhängigen deutschen Phase-II-Studie IMMUNED, die im Jahr 2015 mit der Rekrutierung startete, werden der PD-1-Inhibitor Nivolumab alleine und in Kombination mit Ipilimumab mit Placebo bei Melanom-Patienten im komplett resezierten Stadium IV verglichen (ClinicalTrials.gov No. NCT02523313).
Die internationale Firmen-gesponserte Phase-III-Studie CA-209-915 prüft außerdem bei über 1.100 Patienten mit reseziertem Hochrisiko-Melanom im Stadium III oder IV in drei Armen die gleiche Kombination randomisiert gegen die beiden Einzelsubstanzen (ClinicalTrials.gov No. NCT03068455).
Bereits abgeschlossen ist die Rekrutierung schließlich in einer Phase-III-Studie der European Organization for Research and Treatment in Oncology (EORTC 1325), die bei Hochrisiko-Patienten mit Melanom im Stadium III randomisiert den PD-1-Antikörper Pembrolizumab mit Placebo vergleicht (ClinicalTrials.gov No. NCT02362594).
Virale Impfstoffe gegen das Melanom
Ebenfalls zu den Immuntherapien im weiteren Sinn lassen sich attenuierte Viren zählen, die Tumorzellen infizieren und sie zum einen zerstören, zum anderen eine mehr oder weniger starke Immunreaktion gegen sie hervorrufen können. Das erste zugelassene derartige therapeutische Virus, Talimogene Laherparepvec, ist ein modifiziertes Herpes-simplex-Virus vom Typ 1, das anstelle von Genen, die für die Pathogenität des Herpes-Virus verantwortlich sind, mehrere rekombinante Gene trägt, die die Expression von Granulozyten-Makrophagen-Kolonie-stimulierendem Faktor (GM-CSF) sowie eine starke Präsentation von Antigenen der Tumorzellen bewirken.
Wirkmechanismus
Wird das Virus in den Tumor appliziert, infiziert es zunächst Tumorzellen, in denen es sich vermehrt und aus denen es in größerer Zahl wieder ausgeschüttet wird. Die Tumorzellen werden dabei zerstört und durch die Vermehrung der Viren, die neue Tumorzellen infizieren, wird der Effekt verstärkt. Zugleich werden beim Zerfall der Zellen tumorassoziierte Antigene sowie Signalmoleküle ausgeschüttet, die Immunzellen anlocken und aktivieren. Der gleichzeitig ausgeschüttete GM-CSF unterstützt diese Reaktionen, indem er Reifung und Funktion von dendritischen Zellen unterstützt, die wiederum gegen den Tumor gerichteten T-Lymphozyten die tumorassoziierten Antigene präsentieren. Das hat auch einen systemischen Effekt, weil diese aktivierten T-Zellen proliferieren und zu anderen Tumorlokalisationen im Körper wandern, wo sie Tumorzellen mit ähnlichen Antigenprofilen erkennen und angreifen können.
Klinische Daten
Nach vielversprechenden Phase-II-Ergebnissen wurde Talimogene Laherparepvec in der Phase-III-Studie OPTiM (Oncovex (GM-CSF) Pivotal Trial in Melanoma) getestet, in der 436 therapienaive oder vorbehandelte Patienten mit nicht resezierbaren Melanomen der Stadien IIIB–IVM1c im Verhältnis 2 : 1 randomisiert wurden, intraläsional das Virus oder subkutan rekombinantes GM-CSF zu erhalten [22]. Primärer Endpunkt war die Rate an anhaltenden Remissionen, d. h. an kompletten und partiellen Remissionen, die innerhalb eines Jahres nach Start der Therapie begannen und mindestens sechs Monate lang anhielten. In der Gesamtpopulation war die Rate unter der viralen Therapie mit 16% erheblich höher als im Kontrollarm (2%), insbesondere bei Patienten in früheren Stadien der Erkrankung (Stadium IIIB/C 33% vs. 0%, Stadium IVM1a 16% vs. 2%, Stadium IVM1b 3,1% vs. 3,8%, Stadium IVM1c 7,5% vs. 3,4%). Ähnliches galt für das Gesamtüberleben, das im Gesamtkollektiv grenzwertig signifikant verbessert wurde (median 23 vs. 19 Monate; HR 0,79; p = 0,051), wo aber insbesondere für Patienten im Stadium IIIB/C das Risiko halbiert werden konnte (HR 0,48; 95%-KI 0,29–0,80).
Die Wirksamkeit von Talimogene Laherparepvec geht mit einer ausgezeichneten Verträglichkeit einher: Nebenwirkungen bestanden vor allem in Fatigue, Schüttelfrost und Fieber, waren aber in 89% der Fälle vom Grad 1 oder 2. Die einzige Toxizität, die bei mehr als 2% der Patienten auftrat, war eine Cellulitis.
Viren und Checkpoint-Inhibitoren kombinieren
Der skizzierte Wirkmechanismus legt die Vermutung nahe, dass eine Kombination von Talimogene laherparepvec mit systemischen Immuntherapien, insbesondere mit Immuncheckpoint-Inhibitoren, zwei komplementäre Therapieprinzipien zusammenbringen und dadurch ihre Wirkung verstärken könnte. Erste Ergebnisse für Kombinationen des Virus mit Ipilimumab und Pembrolizumab scheinen diese Vermutung zu bestätigen, und derzeit ist eine Reihe von Studien angelaufen oder geplant, um diesen Ansatz weiterzuentwickeln [23].
Literatur
1. Hodis E et al. A landscape of driver mutations in melanoma. Cell 2012; 150: 251-63.
2. Schadendorf D et al. Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in unresectable or metastatic melanoma. J Clin Oncol 2015; 33: 1889-94.
3. Robert C et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320-30.
4. Weber JS et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): A randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015; 16: 375-84.
5. Robert C et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: A randomised dose-comparison cohort of a phase 1 trial. Lancet 2014; 384: 1109-17.
6. Robert C et al. Pembrolizumab versus Ipilimumab in advanced melanoma. N Engl J Med 2015; 372: 2521-32.
7. Hodi S et al. Durable, long-term survival in previously treated patients with advanced melanoma (MEL) who received nivolumab (NIVO) monotherapy in a phase I trial. AACR 2016, Abstract #CT001.
8. Larkin J et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373: 23-34.
9. Wolchok JD et al. Updated results from a phase III trial of nivolumab (NIVO) combined with ipilimumab (IPI) in treatment-naive patients (pts) with advanced melanoma (MEL) (CheckMate 067). J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9505.
10. Hodi FS et al. Overall survival in patients with advanced melanoma (MEL) who discontinued treatment with nivolumab (NIVO) plus ipilimumab (IPI) due to toxicity in a phase II trial (CheckMate 069). J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9518.
11. Larkin J et al. Efficacy of nivolumab (NIVO) plus ipilimumab (IPI) combination in patients with advanced melanoma (MEL) and elevated serum lactate dehydrogenase (LDH): A pooled analysis. SMR 2016, Abstract.
12. Larkin et al. Overall Survival Results From a Phase III Trial of Nivolumab Combined With Ipilimumab in Treatment-naïve Patients With Advanced Melanoma (CheckMate 067). AACR 2017, Abstract #CT075. 12.
13. Long GV et al. Pembrolizumab (pembro) plus ipilimumab (ipi) for advanced melanoma: Results of the KEYNOTE-029 expansion cohort. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9506.
14. Weide B et al. Baseline biomarkers for outcome of melanoma patients treated with pembrolizumab. Clin Cancer Res 2016; 22: 5487-96.
15. Robert C et al. Three-year overall survival for patients with advanced melanoma treated with pembrolizumab in KEYNOTE-001. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #9503.
16. Larkin J et al. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med 2014; 371: 1867-76.
17. Ascierto PA et al. Cobimetinib combined with vemurafenib in advanced BRAFV600-mutant melanoma (coBRIM): updated efficacy results from a randomised, doubleblind, phase 3 trial. Lancet Oncol 2016; 17: 1248-60.
18. Ribas A et al. Pembrolizumab (pembro) in combination with dabrafenib (D) and trametinib (T) for BRAF-mutant advanced melanoma: Phase 1 KEYNOTE-022 study. J Clin Oncol 2016; 34 (15S): ASCO 2016, Abstract #3014.
19. Eggermont AM et al. Adjuvant Ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): A randomised, double-blind, phase 3 trial. Lancet Oncol 2015; 16: 522-30.
20. Eggermont AM et al. Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. N Engl J Med 2016; 375: 1845-55.
21. Ascierto PA et al. Overall survival (OS) and safety results from a phase 3 trial of ipilimumab (IPI) at 3 mg/kg vs 10 mg/kg in patients with metastatic melanoma (MEL). ESMO 2016, Abstract #1106O.
22. Andtbacka RH et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J Clin Oncol 2015; 33: 2780-8.
23. Dummer R et al. Combining talimogene laherparepvec with immunotherapies in melanoma and other solid tumors. Cancer Immunol Immunother 2017, Feb 25 [Epub ahead of print DOI 10.1007/s00262-017-1967-1.

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstraße 9–11/Thalkirchner Straße 48
80337 München
+49 89 4400 0
+49 89 4400 56226
E-Mail schreiben

