Grenzen der lokalen Tumortherapie beim fortgeschrittenen Prostatakarzinom
Das Prostatakarzinom ist weltweit die häufigste Tumorerkrankung beim Mann und die dritthäufigste tumorbedingte Todesursache. In Deutschland wurden nach Angeben des Robert Koch-Instituts im Jahr 2012 insgesamt 63.710 Neuerkrankungen registriert [1]. Dabei gelang es, drei Viertel aller Tumoren in einem frühen Stadium (T1 oder T2) zu diagnostizieren.
Diagnostik und klinische Manifestationen
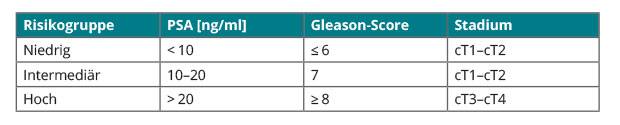
Durch die systematische transrektale ultraschallgesteuerte Prostata-Stanzbiopsie mit der Entnahme von 10 bis 12 Stanz-Zylindern wird die Diagnose eines Prostatakarzinoms gesichert. Anhand des digital rektalen Tastbefundes und des PSA-Wertes bei Diagnosestellung wird das Prostatakarzinom in unterschiedliche Risikogruppen eingeteilt. Die gängigste Einteilung in drei Risikogruppen erfolgt nach D'Amico ([2]; Tab. 1).
Die klinische Manifestation eines Prostatakarzinoms im fortgeschrittenen Stadium ist abhängig von der Beteiligung anderer Organsysteme. So können Prostatakarzinome die Rektumwand infiltrieren, in das Lumen einbrechen und verschiedene klinische Erkrankungsbilder des unteren Gastrointestinaltraktes verursachen. Eine Blasenboden-Infiltration kann irritative Miktionsbeschwerden, Hämaturie sowie eine bilaterale, meist jedoch unilaterale Harnstauungsniere zur Folge haben.
Neuerdings spielt auch die Bildgebung, insbesondere die multiparametrische Kernspintomografie eine zunehmend wichtigere Rolle in der Diagnostik des Prostatakarzinoms (siehe dazu den Beitrag von Tiemeyer und Peters in diesem Heft S. 98).
Behandlungsstrategien beim lokal fortgeschrittenen und/oder lymphogen metastasierten Prostatakarzinom
Patienten mit einem lokal fortgeschrittenen Prostatakarzinom (pT3a, pT3b und pT4), oder einem lymphogen metastasierten Prostatakarzinom gehören zur Hochrisikogruppe, bei der mit einem hohen Progressionsrisiko zu rechnen ist. Zu den primären Behandlungsmöglichkeiten zählt die radikale Prostatektomie, aber auch die Strahlentherapie in Kombination mit einer Androgendeprivation.
Stellenwert der radikalen Prostatektomie beim lokal fortgeschrittenen Prostatakarzinom
Der Vorteil der radikalen Prostatektomie gegenüber anderen Therapieoptionen liegt darin, dass dabei das Tumorstadium und der Lymphknotenstatus exakt bestimmt werden, was von grundlegender Bedeutung für die Entscheidung über die Notwendigkeit einer adjuvanten Therapie ist. Darüber hinaus wird ein signifikanter Anteil der klinisch als cT3 diagnostizierten Tumoren nach radikaler Prostatektomie als pT2-Tumor eingestuft (Downstaging; [3]) und kann in der Folge kurativ behandelt werden. Entscheidend für die langfristige Prognose ist auch, dass durch die radikale Prostatektomie ein negativer Schnittrand (R0) erreicht wird. Hier kann durch die systematische Anwendung der intraoperativen Schnellschnitt-Diagnostik die Rate an R1-Befunden signifikant gesenkt werden [4].
Wie in verschiedenen Studien dargelegt wird [5], findet sich ein direkter Zusammenhang von positivem Schnittrand und lokal fortgeschrittenem Tumor. Das Risiko für ein Rezidiv ist allerdings nicht nur bei einem R1-Befund oder bei lokal fortgeschrittenen Tumoren (> T3) erhöht, sondern auch bei Tumoren mit einem hohen Risiko aufgrund von Gleason-Score oder PSA-Wert (siehe oben). Um das Risiko für ein Rezidiv bei Patienten mit positiven Schnitträndern zu minimieren, sollte bei T3-Tumoren eine lokale perkutane Strahlentherapie durchgeführt werden. Diese Empfehlung basiert auf Ergebnissen verschiedener Studien, in denen nachgewiesen werden konnte, dass die adjuvante Strahlentherapie nach radikaler Prostatektomie das Risiko eines PSA-Rezidives signifikant reduziert und somit das tumorspezifische Überleben verbessert. [6,7].
Bei pT2-Tumoren mit positivem Schnittrand oder hohem Progressionsrisiko aufgrund von Gleason Score (> 8) oder PSA-Wert (> 20 ng/ml) kann ebenfalls eine adjuvante Strahlentherapie durchgeführt werden [8]. Bei Patienten mit pT2-Tumoren mit R1-Befund und niedrigem Progressionsrisiko kann die lokale Strahlentherapie allerdings selbst nach nervenschonender Operation eine Verschlechterung der erektilen Funktion bewirken. Hier kann eine Surveillance-Strategie mit regelmäßiger PSA-Verlaufskontrolle eine gute Alternative vor allem für Patienten, die die Nebenwirkungen und das Risiko einer Übertherapie nicht wünschen, darstellen.
Stellenwert einer extendierten pelvinen Lymphadenektomie
Eine weitere wichtige therapeutische Option stellt die extendierte pelvine Lymphadenektomie bei lokal fortgeschrittenem Tumor dar. Sie schafft durch die Möglichkeit einer präzisen Diagnose regionaler Lymphknotenmetastasen Klarheit vor allem im Hinblick auf die Notwendigkeit von adjuvanten Therapiemaßnahmen.
Die Entfernung der Lymphknotenmetastasen im Rahmen der radikalen Prostatektomie bringt einen Überlebensvorteil gegenüber der Lymphadenektomie ohne radikale Prostatektomie. In der Studie von Engel J. et al. wurden 938 Patienten mit Lymphknotenmetastasen identifiziert, von denen 688 radikal operiert wurden, während bei den übrigen 250 Patienten aufgrund der Lymphknotenmetastasen auf die radikale Prostatektomie verzichtet wurde. Die Gesamtüberlebensraten nach fünf und zehn Jahren betrugen bei den radikal operierten Patienten 84% und 64%, bei denen ohne radikalen Eingriff 60% und 28% [9]. Die radikale Prostatektomie hat damit einen Überlebensvorteil bewiesen, sodass der Verzicht auf die Tumorentfernung bei positiven Lymphknotenmetastasen nicht gerechtfertigt werden kann.
Obwohl bei Patienten mit Hochrisiko-Prostatakarzinom ein Staging mittels MRT/CT empfohlen wird, haben diese Verfahren eine begrenzte Sensitivität und Spezifität bezüglich des Nodalstatus gezeigt. Dagegen hat in der Studie von Maurer et al. die Positronenemissionstomografie mithilfe des prostataspezifischen Membranantigens (PSMA) sich hinsichtlich der Identifizierung von Lymphknotenmetastasen als sehr sensitiv und spezifisch erwiesen ([10]; siehe dazu den Beitrag von Maurer in diesem Heft, S. 105). Dieses Verfahren gestattet zudem bei einem PSA-Rezidiv nach primärer Therapie eine präzise Lokalisation von Tumorherden/Rezidiven. Derzeit sind Verbreitung und Verfügbarkeit des PSMA-PET/CT für das Prostatakarzinom-Staging limitiert; in künftigen Studien wird die Überlegenheit im Vergleich zu anderen diagnostischen Verfahren bestätigt werden müssen.
Lymphknotenmetastasen
Bei Vorliegen von lokoregionären Lymphknotenmetastasen kann analog der Therapie des Hochrisiko-Karzinoms eine Strahlentherapie in Kombination mit einer hormonablativen Therapie über drei Jahre durchgeführt werden [11, 12]. Die Wirksamkeit der kombinierten Strahlen- und Hormontherapie beim lokal fortgeschrittenen (> pT3), nodal positiven und/oder R1-resezierten Prostatakarzinom konnte im Vergleich zur alleinigen Hormontherapie nachgewiesen werden [13].
Die EAU-Leitlinie empfiehlt bei Lymphknotenmetastasen eine Lymphadenektomie mit anschließender Bestrahlung der pelvinen Lymphabflusswege in Kombination mit einer Langzeit-Hormonbehandlung. In Deutschland wird aufgrund der unklaren Datenlage noch keine Empfehlung ausgesprochen. ART-2 ist eine von der Deutschen Krebsgesellschaft (Arbeitsgemeinschaften Radiologische Onkologie (ARO) und Urologische Onkologie (AUO)) initiierte multizentrische, randomisierte Phase-III-Studie, die den Nutzen einer adjuvanten Strahlentherapie bei Patienten mit Prostatakarzinom mit oder ohne positivem Schnittrand nach radikaler Prostatektomie und mit gering ausgeprägter Lymphknotenmetastasierung (Mikrometastasen oder maximal zwei Makrometastasen) evaluiert [14]. An der Studie sind 22 medizinische Zentren beteiligt und sie ist auf eine Dauer von neun Jahren angelegt. Ein Arm wird nach der Operation nur beobachtet, im zweiten Arm erhalten die Patienten eine Radiatio der pelvinen Lymphabflusswege unter Einschluss der Prostata-Region mit einer Gesamtdosis von 50,4 Gy; bei positivem Schnittrand wird die Dosis der lokalen Radiatio auf die Prostataloge auf bis zu 64,8 Gy erhöht. ART-2 evaluiert beide Strategien in Bezug auf das biochemisch rezidivfreie Überleben. Zudem sollen Auswirkungen auf die Lebensqualität der Patienten sowie auf die erektile Dysfunktion überprüft werden.
Die die Strahlentherapie begleitende hormonablative Therapie wird beim nodal metastasierten Prostatakarzinom kontinuierlich mit einem LH-RH-Analogon durchgeführt. Tritt darunter ein PSA-Rezidiv auf, so kann eine maximale Androgenblockade mit einem Androgen-Rezeptorantagonisten eingesetzt werden. Unter hormonablativer Therapie können erhebliche Nebenwirkungen auftreten (Hitzewallungen, Gynäkomastie, Depression sowie ein erhöhtes Risiko für kardiovaskuläre Erkrankungen), die sich durch eine intermittierende Durchführung der Therapie minimieren lassen.
Die aktuelle Datenlage rechtfertigt keine Empfehlung für eine alleinige adjuvante hormonablative Therapie beim lokal fortgeschrittenen Prostatakarzinom. Dieser Tumor spricht zwar initial auf eine hormonablative Therapie an, im Verlauf kommt es jedoch vor allem bei schlecht differenzierten Tumoren (Gleason-Score > 8) zu einer Hormonresistenz und es zeigt sich keine statistisch signifikante Verbesserung des Gesamtüberlebens [15]. Die adjuvante Behandlung mit Bicalutamid (150 mg) zeigte jedoch eine Verbesserung des klinisch progressionsfreien Überlebens bei Hochrisiko-Patienten mit lokal fortgeschrittenem Karzinom, unabhängig von der primären Therapie [16]. Wenn unter einer suffizienten antiandrogenen Therapie der PSA-Wert steigt, spricht man von einem kastrationsresistenten Prostatakarzinom (CRPC).
PSA-Rezidiv/PSA-Progression
Bei Anstieg des PSA-Wertes nach radikaler Prostatektomie (in mindestens zwei Messungen im Abstand von mindestens zwei Wochen bestätigter PSA-Wert > 0,2 ng/ml) spricht man von einem biochemischen Rezidiv, das durch ein Lokalrezidiv oder durch Metastasen bedingt sein kann. Eine kurze PSA-Verdopplungszeit (weniger als drei Monate) weist auf eine systemische Progression hin, während eine längere Verdopplungszeit eher auf ein lokales Rezidiv zurückgeht. Patienten mit einem biochemischen oder lokalen Rezidiv zeigen im Allgemeinen keine klinisch relevanten Symptome. Eine systemische Erkrankung hingegen kann symptomatisch oder asymptomatisch verlaufen.
Die perkutane Salvage-Radiotherapie (mit mindestens 66 Gy) stellt eine Therapieoption dar bei Patienten mit niedrigen PSA-Werten und/oder Lokalrezidiven. Das gilt sowohl, wenn nach radikaler Prostatektomie bei pN0-Status das vorher nicht messbares PSA positiv wird, als auch wenn es positiv war und nach radikaler Prostatektomie persistiert. Die Lymphabflusswege müssen hier nicht mitbestrahlt werden.
Die Zystoprostatektomie beim lokal fortgeschrittenen Prostatakarzinom
Patienten mit lokal fortgeschrittenem Prostatakarzinom und Infiltration des Blasenbodens mit oder ohne lokale Symptome können möglicherweise von der Durchführung einer Zystoprostatektomie profitieren. Sie kann in kurativer oder palliativer Intention erfolgen. Dadurch kann sich die Lebensqualität der Patienten verbessern, und die lokale Symptomatik kann gelindert oder sogar beseitigt werden. Die am häufigsten verwendete Harnableitung für ein lokal fortgeschrittenes Prostatakarzinom ist das Ileum-Conduit [21].
Salvage-Prostatektomie
Die radikale Prostatektomie stellt eine potenziell kurative Therapieoption für Patienten mit einem Lokalrezidiv dar, die primär eine perkutane Strahlentherapie oder Brachytherapie erhalten haben. Die Salvage-Prostatektomie ist ein komplexer Eingriff, da die intra- und postoperativen Komplikationen durch die Vorbestrahlung deutlich ausgeprägter sind als wenn eine radikale Prostatektomie als Primärtherapie durchgeführt wird.
Vor einer Salvage-Prostatektomie muss ein Lokalrezidiv mittels transrektaler oder transperinealer Stanzbiopsie nachgewiesen werden. Gleichzeitig muss eine systemische Erkrankung bzw. Metastasierung ausgeschlossen sein. Die PSMA-PET/CT hat im Vergleich zur Cholin-PET/CT eine höhere Detektionsrate beim Lokalrezidiv gezeigt.
Sowohl die Salvage-Strahlentherapie als auch die Salvage-Prostatektomie stellen Therapieoptionen mit kurativer Intention bei Patienten mit Lokalrezidiv dar: Die Folgen eines nicht behandelten Lokalrezidivs können nicht nur lokale Probleme, sondern auch eine Tumorprogression und die Entstehung von Fernmetastasen sein.
Eine Therapieoption für Patienten mit schwerwiegenden Begleiterkrankungen ist die „Watch-and-wait“-Strategie: Die Entscheidung über die anzuwendende Therapie wird hierbei immer unter Abwägung von Nutzen, Risiko und Patientenwunsch getroffen. Die alleinige hormonablative Therapie ist bei einem PSA-Rezidiv oder einer PSA-Progression keine Standardtherapie.
Lokale Therapien beim metastasierten Prostatakarzinom
Neuere Studien [17, 18] belegen einen Überlebensvorteil für Patienten, die nach der Diagnose eines metastasierten Prostatakarzinoms (M1a, M1b und M1c) eine lokale Therapie (radikale Prostatektomie mit pelviner Lymphadenektomie oder Strahlentherapie) erhalten, gegenüber Patienten ohne eine solche lokale Behandlung des Primärtumors (lediglich Androgendeprivation oder Beobachtung). Die lokale Behandlung des Primärtumors führte zu einer Verbesserung des tumorspezifischen Überlebens. Die Behandlung dieser primären Prostatatumoren bildet somit die Basistherapie, um eine eventuelle lokale symptomatische Progression zu vermeiden. Die Wirksamkeit der nachfolgenden systemischen Therapie muss prospektiv geprüft werden.
Auch Patienten, deren Prostatakarzinom später kastrationsresistent wird, profitieren davon, wenn ihr Tumor primär, d. h. vor Entwicklung der Resistenz lokal therapiert wurde, weil sich dadurch die Häufigkeit lokaler Komplikationen (z. B. Blasenhals-Obstruktion, Urethra-Striktur) deutlich reduziert. Die retrospektive Analyse von Won et al. [19] belegt, dass die palliative lokale Behandlung eine niedrigere Komplikationsrate im Stadium der Kastrationsresistenz nach sich zieht. Das gilt insbesondere für eine operative Therapie: In dieser Studie war die spätere Komplikationsrate nach einer radikalen Prostatektomie (hier retropubisch durchgeführt) weniger als halb so hoch wie nach einer externen Bestrahlung (20% vs. 46,7%; p = 0,007). Auch stationäre Aufnahmen sowie palliative Maßnahmen sind häufiger erforderlich, wenn die Patienten vorher keine lokale Therapie erhalten haben [20].
Studien zur lokalen Therapie des metastasierten Prostatakarzinoms
STAMPEDE (Systemic Therapy in Advancing or Metastatic Prostate cancer: Evaluation of Drug Efficacy) ist eine multizentrische, randomisierte, kontrollierte Studie, die den Nutzen einer multimodalen Therapie bei Patienten mit neu diagnostiziertem lokal fortgeschrittenem oder metastasiertem Prostatakarzinom sowie bei Patienten mit PSA-Progression nach radikaler Prostatektomie oder Strahlentherapie evaluiert [22]. In der mehrarmigen Studie werden die Auswirkungen von Behandlungen mit unterschiedlichen Agenzien und lokaler Therapie, sowohl als Monotherapie als auch in Kombination mit Androgenentzugs-Therapie untersucht [23]. Im Arm H erhalten die Patienten eine Hormon- in Kombination mit einer Strahlentherapie, in Arm J die Hormontherapie in Kombination mit Abirateronacetat und Enzalutamid. Eine ähnliche multizentrische randomisierte niederländische Studie (HORRAD) bewertet die Auswirkungen der alleinigen Hormontherapie im Unterschied zur Hormontherapie in Kombination mit einer lokalen Strahlentherapie [24].
Während diese Studien eine Bestrahlung als lokale Therapie in die multimodale Therapie des metastasierten Prostatakarzinoms integriert haben, untersuchen mehrere andere Studien die radikale Prostatektomie als Ergänzung der systemischen Therapie. So hat die multizentrische, prospektive, randomisierte g-RAMPP-Studie (A randomized controlled trial comparing Radical prostatectomy plus neoadjuvant hormones with Androgen deprivation therapy alone in the Management of men with Pauci-metastatic Prostate cancer; „g“ steht für „german“) zwei primäre Ziele: die Evaluierung des Effekts der medikamentösen Standardtherapie mit oder ohne radikale Prostatektomie bei Patienten mit einem begrenzt ossär metastasierten Prostatakarzinom auf den Krankheitsverlauf sowie den Einfluss der radikalen Prostatektomie auf die Lebensqualität [25]. Eingeschlossen werden Patienten mit mindestens einer und maximal fünf ossären Metastasen in Knochenszintigramm/MRT/CT/PET zum Zeitpunkt der Diagnose, mit lokal resektablem Tumorstadium, einem PSA-Wert ≤ 200 ng/ml und einer asymptomatischen oder gering symptomatischen Erkrankung.
Lokale palliative Therapiemöglichkeiten beim metastasierten Prostatakarzinom
Bei lokaler Progression der Erkrankung unter/ohne hormonablative Therapie und Chemotherapie, können Symptome des unteren und oberen Harntrakts, sowie tumorbedingte Harnblasenblutungen auftreten. Hauptziele der Therapie hier sind im Sinne einer Palliation die Behandlung von lokalen Komplikationen wie Blasenentleerungsstörung, Harnstauungsnieren und Makrohämaturie und die Verbesserung der Lebensqualität.
Beim lokal fortgeschrittenen Prostatakarzinom kann der Tumor die prostatische Urethra und den Blasenhals obstruieren, sodass die daraus resultierende subvesikale Obstruktion zur Blasenentleerungsstörung mit obstruktiven Miktionsbeschwerden führt. Anderseits kann der Tumor den Blasenboden und die Harnleitermündung infiltrieren mit konsekutiv rezidivierenden Makrohämaturien und der Entstehung einer Harnstauung. Die Anlage von perkutanen Nephrostomien gilt als notwendige palliative Maßnahme bei Patienten mit symptomatischer Harnstauungsniere infolge einer lokalen Tumorprogression mit Blasenbodeninfiltration.
Patienten mit symptomatischer tumorbedingter Obstruktion des unteren Harntrakts und gutem Allgemeinzustand sollten neben der primären hormonablativen Therapie desobstruiert werden. Die palliative transurethrale Resektion der Prostata (TUR-P) ist eine lokale Therapieoption mit dem Ziel, die spontane Miktion wiederherzustellen und die Lebensqualität dadurch zu verbessern. Andere sinnvolle Therapieoptionen bei geeigneten Patienten sind die radikale Prostatektomie und die Zystektomie.
Fazit
Die radikale Prostatektomie ist eine primäre Therapieoption bei lokal fortgeschrittenem Prostatakarzinom. Patienten mit Tumoren im Stadium cT3 und Lymphknotenmetastasen sollten nicht von einer operativen Therapie ausgeschlossen werden. Die extendierte Lymphadenektomie ermöglicht neben dem exakten Staging eine schnelle Entscheidung über die Notwendigkeit bzw. den Verzicht auf eine adjuvante Therapie und hat zudem bei Lymphknotenmetastasen eine zytoreduktive Wirkung. Die Kombination der primären lokoregionären Tumortherapie mit der postoperativen adjuvanten Therapie bei Hochrisiko-Patienten verbessert tumorspezifisches und Gesamtüberleben. Der Nutzen der zytoreduktiven Prostatektomie beim metastasierten Prostatakarzinom mit minimaler ossärer Metastasierung wird in prospektiven Studien evaluiert. Durch die Behandlung des Primärtumors, wenn eine lokale Resektabilität möglich ist, kann der Krankheitsverlauf positiv beeinflusst werden. Wir halten dieses Therapiekonzept für vielversprechend, da durch die Kontrolle des Primärtumors bzw. der lokalen und regionalen Tumorsituation die Lebensqualität, die Prognose und das tumorspezifische Überleben deutlich verbessert werden können. Multimodale Therapiekonzepte wie die induktive Hormonchemotherapie, die additive bzw. lokale Therapie von Metastasen werden evaluiert. Die Behandlung von Oligometastasen kann von Vorteil sein, wird aber derzeit nur im Rahmen von klinischen Studien durchgeführt.
Literatur
1. www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2015/kid_2015_c61_prostata.pdf.
2. D'Amico et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. J Am Med Ass 1998; 280: 969-74.
3. Ward JF et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU 2005; 95: 751-6.
4. Hatzichristodoulou G et al. Intraoperative frozen section monitoring during nerve-sparing radical prostatectomy: evaluation of partial secondary resection of neurovascular bundles and its effect on oncologic and functional outcome. World J Urol 2016; 34: 229-36.
5. Van Poppel H et al. Radical prostatectomy can provide a cure for well-selected clinical stage T3 prostate cancer. Eur Urol 2000; 38: 372-9.
6. Thompson IM et al. Adjuvant radiotherapy for pathologic T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: Long-term follow-up of a randomized clinical trial. J Urol 2009; 181: 956-62.
7. Wiegel T et al. Adjuvant radiotherapy versus wait-and-see after radical prostatectomy: 10-year follow-up of the ARO 96-02/AUO AP 09/95 trial. Eur Urol 2014; 66: 243-50.
8. Van der Kwast et al. Identification of patients with prostate cancer who benefit from immediate postoperative radiotherapy. J Clin Oncol 2007; 25: 4178-86.
9. Engel J et al. Survival benefit of radical prostatectomy in lymph node-positive patients with prostate cancer. Eur Urol 2010; 57: 754-61.
10. Maurer T et al. Diagnostic efficacy of (68)Gallium-PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer. J Urol 2016; 195: 1436-43.
11. Abdollah F et al. Impact of adjuvant radiotherapy on survival of patients with node-positive prostate cancer. J Clin Oncol 2014; 32: 3939-47.
12. Bolla M et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360: 2516-27.
13. Lawton CA et al. Androgen suppression plus radiation versus radiation alone for patients with stage D1/pathologic node-positive adenocarcinoma of the prostate: Updated results based on national prospective randomized trial Radiation Therapy Oncology Group 85-31. J Clin Oncol 2005; 23: 800-7.
14. DRKS-ID: DRKS00004733
15. Wirth MP et al. Prospective randomized trial comparing flutamide as adjuvant treatment versus observation after radical prostatectomy for locally advanced, lymph node-negative prostate cancer. Eur Urol 2004; 45:267-70.
16. McLeod DG et al. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU 2006; 97: 247-54.
17. Fossati N et al., Identifying optimal candidates for local treatment of the primary tumor among patients diagnosed with metastatic prostate cancer: A SEER-based study. Eur Urol 2015; 67: 3-6.
18. Satkunasivam R et al. Radical prostatectomy or external beam radiation therapy vs no local therapy for survival benefit in metastatic prostate cancer: A SEER-Medicare analysis. J Urol 2015; 3194: 378-85.
19. Won AC et al. Primary treatment of the prostate improves local palliation in men who ultimately develop castrate-resistant prostate cancer. BJU 2013; 112: 250-5.
20. Aus G et al. Need for hospital care and palliative treatment for prostate cancer treated with noncurative intent. J Urol 1995; 154: 466-9.
21. Zantl N et al. Value of cystoprostatectomy in locally advanced prostate carcinoma. Urologe 2008; 47: 1447-52.
22. James N et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): Survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387: 1163-77.
23. ClincalTrials.gov NCT00268476.
24. www.trialregister.nl/trialreg/admin/rctview.asp.
25. DRKS-ID: DRKS00008770.

Karen Sarmiento
Fachärztin für Urologie
Klinik und Poliklinik für Urologie und
Kinderurologie
Universitätsklinikum Würzburg
Oberdürrbacher Str. 6, 97080 Würzburg
+49 931 201 32001
+49 931 201 32009


