Die MRD-Bestimmung gewinnt bei akuten Leukämien immer mehr an Bedeutung
International Symposium Acute Leukemias XVI 2017, München
Bei der akuten lymphatischen Leukämie (ALL) sowohl von Erwachsenen als auch von Kindern ist die Bestimmung der minimalen Resterkrankung (MRD) bereits Bestandteil der Routine, um Aussagen zur Prognose zu treffen und die Therapie zu steuern [1, 2]. Bei der akuten myeloischen Leukämie (AML) nimmt die molekulare Heterogenität immer stärker zu, jedoch beeinflussen nur wenige der gefundenen genetischen Marker bisher bei Patienten mit Standardrisiko die Art der Therapie. Immer mehr an Bedeutung für das Monitoring der Wirksamkeit der Therapie scheint aber der Nachweis der MRD zu gewinnen: Die Daten häufen sich, dass auch hier das Erreichen von MRD-Negativität eine wesentliche Voraussetzung für eine langfristig günstige Prognose ist.
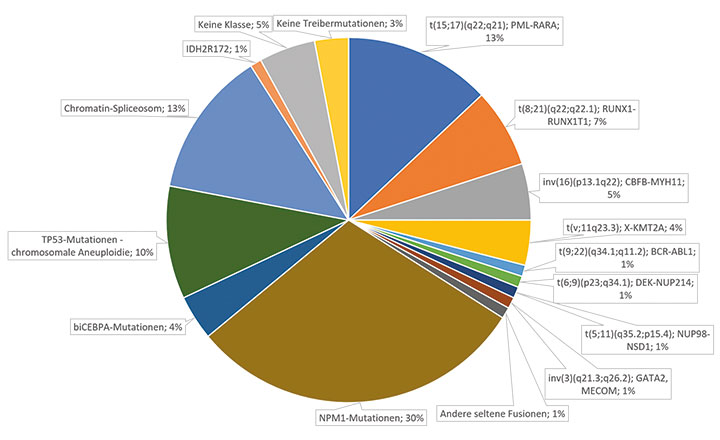
AML-Erkrankungen mit Mutationen im Gen für Nucleophosmin (NPM1) machen mit einem Anteil von rund 30% die größte molekulare Subgruppe bei erwachsenen AML-Patienten aus (Abb. 1; [3]). Eine Auswertung der britischen NCRI-AML17-Studie mit 346 solchen Patienten liefert eine Bestätigung für die Rolle der MRD, so Adam Ivey, Melbourne [4]: Mutierte NPM1-Transkripte wurden hier mithilfe einer quantitativen Polymerasekettenreaktion (RT-qPCR) mit einer Sensitivität von median 10-5 nachgewiesen, und die Autoren suchten überdies bei 223 der Patienten gezielt nach zusätzlichen Mutationen in 51 Genen, die bei der AML eine Rolle spielen sollen. Aus diesen Sequenzierungsstudien resultierten, wenn man die Patienten anhand von Kombinationen dieser Mutationen zu stratifizieren versuchte, mehr als 150 sehr kleine Subgruppen, in denen sich der Einfluss der Mutationen auf die Prognose nicht sinnvoll analysieren ließ.
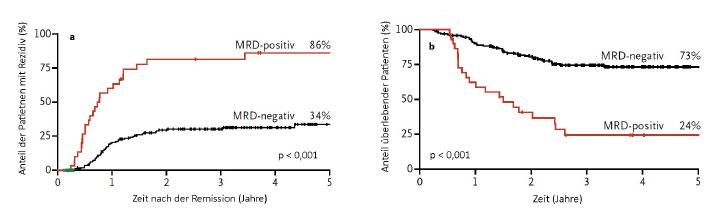
Die MRD-Bestimmungen erwiesen sich hingegen als ergiebiger: Patienten, in deren peripherem Blut man nach dem zweiten Chemotherapie-Zyklus noch Zellen mit NPM1-Mutationen detektieren konnte, hatten in den folgenden fünf Jahren mit 86% ein mehr als doppelt so hohes Rezidivrisiko wie Patienten mit MRD-negativem Befund (34%; p < 0,001; Abb. 2a). Das war von erheblichem Einfluss auf die Gesamtüberlebensrate, die sich nach drei Jahren bei MRD-negativen gegenüber den MRD-positiven Patienten verdreifacht hatte (73% vs. 24%; p < 0,001; Abb. 2b).
Der MRD-Status erwies sich in einer multivariaten Analyse als der einzige signifikante von allen untersuchten Prognosefaktoren (Hazard Ratio 4,84; p < 0,001). Seine Bedeutung übertraf die von Flt3-ITD- und DNMT3A-Mutationen bei Weitem: Das zusätzliche Vorliegen oder Fehlen dieser Mutationen hatte keinen Einfluss auf die prognostische Bedeutung des MRD-Status. Bei sequenzieller Bestimmung korrelierten ansteigende Titer von NPM1-Mutationen mit dem Auftreten von Rezidiven. Umgekehrt konnten in 98 von 100 Rezidivfällen NPM1-Mutationen gefunden werden – und zwar die gleichen wie vor der Therapie.
Außerdem war die Geschwindigkeit des Anstiegs der MRD im peripheren Blut ebenso wie im Knochenmark gut mit der Dauer bis zu einem hämatologischen Rezidiv assoziiert. Aufgrund der Stabilität der NPM1-Mutationen eignet sich ihre hochsensitive Bestimmung auch als Monitoring-Methode, um auf einen Anstieg sofort mit einer präemptiven Therapie beginnen zu können: So konnte eine zunehmende MRD in der britischen Studie in zehn von 63 Fällen durch die Gabe einer FLAG-Idarubicin-Chemotherapie wieder eliminiert werden.
Die prognostische Bedeutung der MRD-Bestimmung wurde in einer unabhängigen Validierungskohorte von
91 Patienten mit NPM1-Mutationen bestätigt. Bei AML mit Standardrisiko und solchen Mutationen ist die Bestimmung der MRD also ein wertvoller prognostischer Faktor, mit dem sich das Ansprechen beurteilen und die weitere Therapie steuern lässt. Im Knochenmark ist die Messung während der ersten Zyklen sensitiver, so Ivey, erst ab dem dritten Zyklus gleichen sich die Werte aus Knochenmark und Blut an.
MRD und Stammzelltransplantation: die Situation bei der ALL
Mit der Rolle der MRD-Bestimmung als Stratifizierungs-Werkzeug bei der Entscheidung für oder gegen eine Stammzelltransplantation beschäftigte sich Roland Walter, Seattle: Bei der ALL ist die Intensivierung der Chemotherapie bei verbleibender minimaler Resterkrankung mittlerweile Routine und durch mehrere Studien, darunter mindestens eine randomisierte aus Großbritannien, belegt.
Keine randomisierten Vergleiche gibt es hingegen für die Anwendung bzw. Nicht-Anwendung einer Stammzelltransplantation in Abhängigkeit vom MRD-Status. Für Patienten mit neu diagnostizierter ALL mit Standardrisiko scheint eine molekulare Komplettremission (MRD-negativ) nach Ende der Induktionstherapie und vier bis fünf Monate nach Beginn der Konsolidierung mit einer guten Prognose assoziiert zu sein, sodass eine allogene Stammzelltransplantation hier wenig Sinn machen dürfte. Ob eine solche Strategie auch für Patienten mit hohem oder sehr hohem Risiko übernommen werden kann, ist unklar.
Für Patienten mit Philadelphia-Chromosom-positiver ALL, die nach einer Kombination aus Chemotherapie und Tyrosinkinaseinhibitor in einer ersten MRD-negativen Remission sind, gibt es eine retrospektive Registeranalyse der European Group for Blood and Marrow Transplantation (EBMT; [5]). Danach unterscheiden sich rezidivfreies und Gesamtüberleben nicht zwischen einer autologen und einer allogenen Transplantationsstrategie: Zwar ist nach autologer Transplantation das Rezidivrisiko erheblich höher, aber das wird durch die geringere therapiebedingte Mortalität wieder aufgewogen. Für erwachsene Patienten, die die molekulare Komplettremission sehr früh erreichen, könnte sogar die alleinige Chemotherapie eine Alternative zur Transplantation darstellen [6].
Bei Patienten, die in der Erstlinie nur eine MRD-positive Remission erzielen, ist die Prognose hingegen mit einer Chemotherapie alleine schlecht, sodass hier eine Stammzelltransplantation angestrebt werden sollte [7]. Bei einer autologen Transplantation nähern sich die Rezidivraten 100%, weshalb eine allogene Strategie vorzuziehen ist – obwohl das Rezidivrisiko auch hier hoch ist. Trotzdem sind die Ergebnisse ausweislich nicht-randomisierter Studien besser als mit anderen Therapieansätzen, und MRD-Positivität sollte deshalb kein Ausschlusskriterium für eine allogene Transplantation sein.
Zur rezidivierten Situation gibt es bei der ALL vor allem Daten aus pädiatrischen Studien, vor allem von der ALL-REZ BMF 2002-Studie, in der Patienten mit intermediärem Risiko und hohen MRD-Titern einen Nutzen von einer allogenen Transplantation zu haben schienen, nicht hingegen jene mit niedrigen Konzentrationen [8].
MRD und Stammzelltransplantation: die Situation bei der AML
Bei der AML ist die Therapiesteuerung durch den MRD-Status noch weniger gut etabliert als bei der ALL. Bisher gibt es lediglich aus einer pädiatrischen Studie (AML02) Hinweise darauf, dass es Sinn machen könnte, die Intensivierung der Therapie im zweiten Induktions-Zyklus und die Art der Post-Remissionstherapie (allogene Stammzelltransplantation oder konsolidierende Chemotherapie) von der MRD-Bestimmung abhängig zu machen [9]. Im Großen und Ganzen basiert aber die Entscheidung für oder gegen eine Transplantation derzeit noch weitgehend auf der zytogenetischen und molekulargenetischen Risikoabschätzung. Die Studien dazu folgen meist dem Design der „genetischen Randomisierung“, d. h. verglichen werden Patienten, für die sich ein passender Spender findet, mit solchen ohne einen derartigen Spender [10].
Patienten mit niedrigem Risiko
Patienten mit niedrigem Risiko werden aufgrund solcher Untersuchungen nicht routinemäßig für eine allogene Transplantation in der ersten Komplettremission empfohlen. Mehr und mehr zeigt sich jedoch, dass zum Beispiel Patienten mit Core-Binding-Factor-Leukämie oder mit NPM1-Mutationen ein hohes Rezidivrisiko haben, wenn sie keine MRD-Negativität erreichen [4, 11]. In der AML05-Studie haben etwa solche Patienten im Alter zwischen 15 und 60 Jahren mit AML und Translokation (8;21)(q22;q22) von einer allogenen Transplantation in der ersten kompletten Remission profitiert, nicht jedoch jene, die mit der initialen Chemotherapie MRD-negativ geworden waren [12]. Sie schnitten sogar unter der allogenen Transplantation bezüglich rezidivfreiem und Gesamtüberleben schlechter ab als unter Chemotherapie bzw. autologer Transplantation – vor allem wegen einer höheren transplantationsbedingten Mortalität.
Wirklich klar ist noch nicht, ob die autologe Transplantation der Chemotherapie in dieser Situation eines niedrigen Risikos überlegen ist; sie könnte ein auch bei diesen Patienten noch bestehendes Rezidivrisiko minimieren, aber das sollte in weiteren Studien geklärt werden, so Walter.
Patienten mit intermediärem und hohem Risiko
Bei Patienten mit intermediärem oder hohem Risiko nach den zytogenetischen bzw. molekularen Kriterien ist die MRD-Bestimmung mittlerweile ein wichtiges Instrument der Risikostratifizierung. MRD-Negativität steht in jedem Fall für ein wesentlich erniedrigtes Rezidivrisiko nach einer Transplantation. Bei Patienten, die früh im Verlauf, womöglich sogar nach dem ersten Induktions-Zyklus einen MRD-negativen Status erzielt haben, wird sogar diskutiert, ob hier eine autologe Transplantation die ideale Post-Remissions-Strategie sein könnte, weil damit das hohe transplantationsabhängige Mortalitätsrisiko vermieden wird.
Bei MRD-positiven Patienten hingegen lagen die Rezidivraten nach einer autologen Transplantation in mehreren Studien bei 80% oder höher [13]. Nach allogener Transplantation sind die Ergebnisse für Patienten, die zuvor MRD-positiv waren, zwar auch nicht überwältigend, aber in einigen nicht-randomisierten Studien waren die Rezidivraten niedriger und die Überlebenszeiten länger als nach einer Chemotherapie oder einer autologen Transplantation.
Gute, strikt kontrollierte Studien werden notwendig sein, um zu klären, ob und in welchem Ausmaß sich die Ergebnisse durch zusätzliche Therapien verbessern lassen, die durch den MRD-Status beeinflusst werden. Die allogene Stammzelltransplantation ist ein klassisches Beispiel für eine Therapie mit hoher Wirksamkeit, aber zugleich so starker Toxizität, dass ein therapeutischer Nutzen dadurch wieder zunichte gemacht werden könnte. Aber auch an andere Strategien wäre zu denken, so Walter:
Beispielsweise könnte man durch zusätzliche Behandlungen versuchen, noch vor der Transplantation einen MRD-negativen Zustand zu erreichen. Die Konditionierung ließe sich – bei Patienten, die das tolerieren können – noch intensiver gestalten, und auch die Wahl der Stammzell-Quelle scheint nicht ganz unwichtig zu sein: Es gibt Hinweise darauf, dass Stammzellen aus Nabelschnurblut nach einer myeloablativen Konditionierung die negativen Auswirkungen einer MRD vor Transplantation stärker kompensieren könnten als Stammzellen anderer Herkunft [14, 15] – wenngleich noch unklar ist, ob das an dem intensiveren präparativen Regime liegt oder ob intrinsische Eigenschaften der Nabelschnurblut-Zellen dafür verantwortlich sind. Und schließlich wäre an Post-Transplantations-Strategien zu denken, die sich gegen die MRD richten, ob das nun eine Minimierung der Immunsuppression ist und/oder die präemptive Anwendung von zielgerichteten Therapien gegen die leukämischen Zellen (z. B. Flt3-Inhibitoren oder Immunmodulatoren).
MRD-Bestimmung künftig mit Next Generation Sequencing?
Methodischer Goldstandard bei der MRD-Bestimmung ist derzeit noch die Allel-spezifische quantitative Echtzeit-Polymerasekettenreaktion (RQ-PCR), mit der Gen-Rearrangements von klonalen Immunglobulinen (Ig) oder T-Zell-Rezeptoren (TCR) detektiert werden. Die Methode ist zeitaufwendig und kostspielig, weil man für jeden einzelnen Patienten einen spezifischen Assay entwickeln muss. Für das Next Generation Sequencing (NGS) gibt es inzwischen Hochdurchsatz-Methoden, und mit dem Verfahren ließen sich vielleicht einige Schwächen der PCR-Methode umgehen.
Beim Next Generating Sequencing von Ig/TCR-Rearrangements wird zunächst eine Multiplex-PCR mit Primern für V-, D- und J-Abschnitte durchgeführt, um alle potenziellen Rearrangements in einer Probe zu amplifizieren und zu sequenzieren. Dadurch vermeidet man die aufwendige Entwicklung von Patienten-spezifischen Assays, so Monika Brüggemann, Kiel. Weil man anschließend auch noch tiefer sequenzieren kann, ist das Ergebnis außerdem spezifischer und sensitiver als mit einer RQ-PCR.
In einer Vergleichsstudie, so Frau Brüggemann, zeigten sich bei einer Reihe von Krankheitsentitäten vergleichbare Ergebnisse zwischen PCR- und NGS-Ansatz und eine mindestens gleich hohe Sensitivität des NGS ohne die Notwendigkeit, hier patientenspezifische Reagenzien einzusetzen [16]. In einer anderen Untersuchung mit 76 pädiatrischen ALL-Patienten fanden sich zwar Diskordanzen im Ergebnis bei 15% der Proben, aber die mittels NGS gemessenen MRD-Level an Tag 33 der Therapie boten eine bessere Vorhersage des rezidivfreien Überlebens [17]. Zwei weitere Studien mit erwachsenen bzw. pädiatrischen Patienten konzentrierten sich besonders auf diejenigen mit in der PCR niedrigen MRD-Werten; sie konnten zeigen, dass NGS die Spezifität der molekularen MRD-Quantifizierung erhöhen kann.
Möglicherweise ist auch die Rekonstitution des polyklonalen B-Zell-Pools im Verlauf der frühen Therapie von Interesse [18]. Sie lässt sich mithilfe des NGS-Ansatzes ebenfalls darstellen, und man findet dabei beispielsweise, dass Patienten mit einem geringer diversifizierten IGH-Repertoire an Tag 33 und 78 ein höheres Rezidivrisiko aufweisen [17].
Standardisierung, Validierung und Qualitätskontrolle des Ansatzes werden derzeit auf europäischer Ebene im EuroClonality NGS Network vorangetrieben mit den Schwerpunkten Feststellung der Klonalität, Detektion der minimalen Resterkrankung und Analyse von Immunglobulin- und T-Zell-Rezeptor-Repertoires [19]. Eine solche Standardisierung ist Voraussetzung für die Ausschöpfung des großen Potenzials der NGS-Analyse in der Leukämie-Diagnostik zum Nutzen der Patienten.
Josef Gulden
Literatur
1. Van Dongen JJM et al. Blood 2015; 125: 3996-4009.
2. Brüggemann M et al. Blood 2012; 120: 4470-81.
3. Döhner H et al. Blood 2017; 129: 424-47.
4. Ivey A et al. N Engl J Med 2016; 374: 422-33.
5. Giebel S et al. ASH 2016, Abstract #512.
6. Ravandi F et al. Blood 2013; 122: 1214-21.
7. Bassan R et al. Curr Hematol Malig Rep 2015; 10: 86-95.
8. Athale UH et al. Pediatr Blood Cancer 2016; 63: 973-82.
9. Rubnitz JE et al. Lancet Oncol 2010; 11: 543-52.
10. Cornelissen JJ et al. Blood 2016; 127: 62-70.
11. Kayser S et al. Blood 2015; 125: 2331-5.
12. Zhu HH et al. Blood 2013; 121: 4056-62.
13. Buccisano F, Walter RB. Curr Opin Hemtaol 2017; 24: 132-8.
14. Zheng C et al. Leuk Lymphoma 2016; 57: 1398-405.
15. Milano F et al. N Engl J Med 2016: 375: 944-53.
16. Ladetto M et al. Leukemia 2014; 28: 1299-307.
17. Kotrova M et al. Blood 2015; 126: 1045-7.
18. Sellner L et al. BMT 2017 [in press].
19. Langerak AW et al. J Immunol 2016 [in press].
International Symposium „Acute Leukemias XVI – Biology and Treatment Strategies“ vom
19.–22.2.2017 in München.

