Das hormonsensitive metastasierte Prostatakarzinom – Hormonchemotherapie bei allen Betroffenen?
Androgendeprivation als bisheriger Therapiestandard
Zur Effektivität der Androgendeprivation (ADT) bei Patienten mit einem metastasierten, hormon-naiven Prostatakarzinom gibt es Daten aus verschiedenen Studien [3]. Eine der letzten großen Phase-III-Studien zur ADT war die Studie von Hussain et al. [4], in der die kontinuierliche mit einer intermittierenden ADT verglichen wurde. Das mediane Überleben dieser Patienten lag bei 5,8 Jahren für die kontinuierliche Therapie. Dabei ist jedoch zu beachten, dass nur die Patienten randomisiert wurden, die nach der siebenmonatigen Induktionsphase der ADT einen PSA-Wert ≤ 4 ng/ml aufgewiesen hatten. Darüber hinaus wurde die Studie vornehmlich in einer Zeit durchgeführt, in der das Überleben verlängernde Folgetherapien wie die mit Docetaxel noch nicht zur Verfügung standen.
Die Prognose von Patienten in Zeiten lebensverlängernder Folgetherapie-Optionen wie z. B. Docetaxel lässt sich gut anhand des Überlebens im Kontrollarm der STAMPEDE-Studie abschätzen [5]. Die STAMPEDE-Studie ist eine mehrarmige Studie, in der verschiedene Therapieregimes mit der ADT als Standardtherapie verglichen werden. Die Therapie in diesem Kontrollarm bestand aus einer LHRH-Therapie/Orchiektomie mit oder ohne Zugabe eines Antiandrogens. Das mediane Überleben dieser Patienten nach einem medianen Follow-up von 20 Monaten lag bei 42,1 Monaten.
ADT plus nicht Taxan-basierte Chemotherapie beim Hormon-naiven Prostatakarzinom
Das Konzept der Kombination einer ADT mit einer zytotoxischen Chemotherapie wurde bereits in verschiedenen klinischen Studien prospektiv untersucht. Eine der ersten Studien zur kombinierten Hormonchemotherapie beim HNPC war eine am M. D. Anderson Cancer Center (MDACC) durchgeführte Studie, die keinen statistisch signifikanten Überlebensvorteil gegenüber der alleinigen ADT zeigen konnte, obwohl der Unterschied beim medianen Überleben neun Monate betrug (74 vs. 65 Monate, p = 0,41; [6]). Dabei wurde für die Chemotherapie die Kombination aus Ketoconazol, Doxorubicin, Vinblastin und Estramustin eingesetzt. Auch zwei weitere Studien, in denen die ADT mit Estramustin als Chemotherapeutikum kombiniert wurde, konnten keinen statistisch signifikanten Vorteil der Kombinationstherapie zeigen [7, 8].
ADT plus Taxan-basierte Chemotherapie beim Hormon-naiven Prostatakarzinom
Die erste Studie zur Kombination von ADT plus Docetaxel war die prospektiv randomisierte GETUG-AFU-15-Studie. Hierbei zeigte sich in einer ersten Auswertung lediglich ein Vorteil beim progressionsfreien Überleben, jedoch nicht beim Gesamtüberleben (58,9 vs. 54,2 Monate; HR 1,01; 95%-Konfidenzintervall 0,75–1,36; [9]). Auch in den Folgeauswertungen mit längerem Follow-up findet sich zwar eine numerische Verlängerung des Gesamtüberlebens zugunsten der Hormonchemotherapie, die aber weiterhin statistisch nicht signifikant ist (s. Tab. 1; [10]).
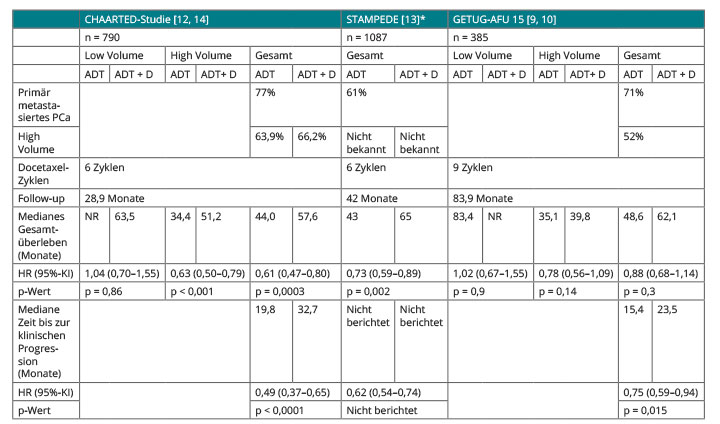
Auf dem Kongress der American Society of Clinical Oncology (ASCO) 2014 wurden erstmals die Ergebnisse der ECOG-Studie E3805 CHAARTED
(ChemoHormonal Therapy versus Androgen Ablation Randomized Trial for Extensive Disease in Prostate Cancer; NCT00309985) vorgestellt, die auch als Vollpublikation im New England Journal of Medicine erschienen ist [11, 12]. In der CHAARTED-Studie wurde die ADT randomisiert gegenüber einer Kombination aus ADT plus maximal sechs Zyklen Chemotherapie mit Docetaxel (75mg/m2 alle drei Wochen) verglichen. Die Ergebnisse der Studie zeigen einen statistisch signifikanten Vorteil zugunsten der kombinierten Hormonchemotherapie im Hinblick auf das progressionsfreie Überleben und das Gesamtüberleben (s. Tab. 1).
Neben der CHAARTED-Studie wurden beim ASCO-Kongress 2015 die ersten Überlebensdaten der STAMPEDE-Studie (Systemic Therapy in Advancing or Metastatic Prostate cancer: Evaluation of Drug Efficacy) zum Vergleich von ADT und ADT plus Docetaxel vorgestellt [13]. In die Studie wurden sowohl Patienten mit einem lokal fortgeschrittenen Prostatakarzinom (cT3/4, PSA ≥ 40 ng/ml oder Gleason-Score 8–10) und Patienten im Progress nach primärer Lokaltherapie (PSA ≥ 4 ng/ml + PSADT < 6 Monate, PSA ≥ 20 ng/ml, N+, M+) als auch Patienten mit primär metastasiertem Prostatakarzinom (cTx, N+/M+) eingeschlossen.
Das Ergebnis dieser Studie zeigt ebenfalls einen Vorteil beim Gesamtüberleben zugunsten der Hormonchemotherapie im Vergleich zur alleinigen ADT von median zehn Monaten (77 vs. 67 Monate; HR 0,76; 95%-KI 0,63–0,91; p = 0,003). In der Subgruppenanalyse zeigt sich dabei, dass Patienten ohne Fernmetastasen (M0) scheinbar nicht von der Hormonchemotherapie profitieren. Allerdings ist in dieser Subgruppe (39% aller Patienten) der Medianwert der Überlebenszeit noch nicht erreicht. In der Subgruppe der Patienten mit metastasierten Tumoren (61%) liegt der Überlebensvorteil bei 22 Monaten (median 65 vs. 43 Monate; HR 0,73; 95%-KI 0,59–0,89; p = 0,002).
Metastasen-Last als Prognosefaktor
Bereits in früheren Studien zur alleinigen Hormontherapie konnte die Metastasen-Last als Prognosefaktor identifiziert werden, wobei die Definition der High- und Low-Volume-Disease in den einzelnen Studien unterschiedlich ist. In der MDACC-Studie als einer der ersten Studien zur Hormonchemotherapie zeigte sich ebenfalls ein Unterschied im Überleben der Patienten in Abhängigkeit von der Metastasen-Last mit 7,8 vs. 3,1 Jahren (Low- vs. High-Volume) für Patienten mit alleiniger ADT [6]. Im Vergleich dazu fand sich zumindest in der Gruppe der Patienten mit High-Volume-Disease ein Unterschied im Überleben zugunsten der Hormonchemotherapie, der allerdings statistisch nicht signifikant war (4,4 vs. 3,1 Jahre; p = 0,29). In dieser Studie war die High-Volume-Disease durch das Vorhandensein von mindestens drei ossären Metastasen und/oder viszeralen Metastasen definiert.
In der CHAARTED-Studie wurde ebenfalls hinsichtlich der Metastasen-Last unterschieden, wobei hier die High-Volume-Disease durch ≥ 4 ossäre Metastasen (mindestens eine Metastase außerhalb der Wirbelsäule/knöcherne Becken) und/oder viszerale Metastasen definiert war [12]. Dabei wurden zunächst nur Patienten mit einer hohen Tumorlast (s. Tab. 1) eingeschlossen – nach einem Amendment konnten später auch Patienten mit niedriger Tumorlast in die Studie aufgenommen werden. Hierbei findet sich ein Überlebensvorteil von 17 Monaten für Patienten mit einer hohen Tumorlast, die außer einer viszeralen Metastasierung auch durch das Vorhandensein von ≥ 4 ossären Metastasen inklusive einer Metastase außerhalb des knöchernen Beckens/der Wirbelsäule definiert sein konnte.
In einem Update der Ergebnisse zeigt sich dieser Überlebensvorteil für die Patienten mit High-Volume-Disease weiterhin, während Patienten mit Low-Volume-Disease möglicherweise nicht von der Therapie profitieren (s. Tab. 1; [14]). Darüber hinaus zeigt sich, dass Patienten mit vorhergehender Lokaltherapie des Primärtumors (radikale Prostatektomie, Strahlentherapie) nicht von der Hormonchemotherapie profitieren. Der Überlebensvorteil zeigt sich ausschließlich bei Patienten mit einem neu diagnostizierten, primär metastasierten Prostatakarzinom [14].
Die GETUG-AFU-15-Studie wurde erst nach der initialen Auswertung nachträglich auch im Hinblick auf die Metastasen-Last ausgewertet, wobei die Definition identisch zu der bei der CHAARTED-Studie gewählt wurde [10]. Hierbei findet sich eine relative Reduktion des Mortalitätsrisikos um 22% zugunsten der Hormonchemotherapie, der jedoch statistisch nicht signifikant ist.
In der STAMPEDE-Studie ist eine Unterscheidung zwischen Patienten mit niedriger bzw. hoher Metastasen-Last nicht erfolgt, sodass hier keine Aussage zur Abhängigkeit der Effektivität von der Metastasen-Last möglich ist [5].
Metaanalysen zur Hormonchemotherapie
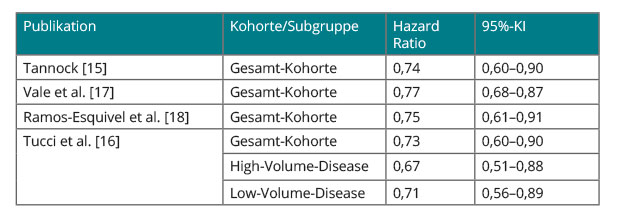
Aufgrund von Unterschieden im Patientenkollektiv (Anzahl eingeschlossener Patienten, medianer PSA-Wert zu Beginn, Tumorlast der eingeschlossenen Patienten, Anteil entdifferenzierter Tumoren, Länge des Follow-ups) lassen sich die Ergebnisse der CHAARTED-Studie, der STAMPEDE-Studie und der GETUG-AFU-15-Studie nicht direkt miteinander vergleichen. Inzwischen wurden mehrere Metaanalysen der Studien durchgeführt, um eine zusammenfassende Bewertung zur Effektivität der Hormonchemotherapie geben zu können.
Eine erste beim ASCO-Kongress 2015 vorgestellte Metaanalyse der Studien erfolgte durch Ian Tannock, der als Diskutant der STAMPEDE-Studie eine Metaanalyse der drei Docetaxel-basierten Studien (CHAARTED, GETUG-AFU 15 und STAMPEDE) anhand der publizierten Hazard Ratios präsentierte [15]. Hierbei zeigt sich eine relative Risikoreduktion beim Gesamtüberleben um 26% bei einer Hazard Ratio von 0,74 (95%-KI 0,60–0,90).
In weiteren Metaanalysen wurde dieser Vorteil zugunsten der Hormonchemotherapie bestätigt (s. Tab. 2). Dabei wurde in einer Metaanalyse auch der Einfluss der Metastasen-Last in der CHAARTED- und der GETUG-AFU-15-Studie ausgewertet. Dabei konnte nicht gezeigt werden, dass die Effektivität der Hormonchemotherapie von der Metastasen-Last abhängig ist [16]. Somit kann anhand dieser Metaanalyse nicht die Schlussfolgerung gezogen werden, dass bei Low-Volume-Disease die Zugabe von Docetaxel zur ADT nicht zu einem Überlebensvorteil führt.
Empfehlung für den klinischen Alltag
Die vorliegenden Ergebnisse belegen für die kombinierte Hormonchemotherapie mit Docetaxel bei Patienten mit einem neu diagnostizierten, Hormon-naiven, metastasierten Prostatakarzinom einen statistisch signifikanten und klinisch relevanten Überlebensvorteil. Es besteht daher eine ausreichende Evidenz, eine Empfehlung zugunsten der Hormonchemotherapie auszusprechen [2]. Dabei profitieren vor allem Patienten mit einer High-Volume-Disease von der Therapie im Sinne einer Überlebensverlängerung. Ein Überlebensvorteil kann bei Patienten mit Low-Volume-Disease jedoch nicht ausgeschlossen werden, sodass sich die Empfehlung auf alle Patienten unabhängig von der Metastasen-Last bezieht. Gemäß den Patientencharakteristika der CHAARTED- und der STAMPEDE-Studie sollten nur Patienten in einem guten Allgemeinzustand (ECOG 0/1) die Therapie erhalten. Weitere Empfehlungen zur Frage, welche Patienten von der Therapie am ehesten profitieren, sind aufgrund der Datenlage bislang noch nicht möglich.
Die Docetaxel-basierte Chemotherapie sollte innerhalb von maximal 120 Tagen nach Beginn der ADT eingeleitet werden. Hierzu sollte das 3-wöchentliche Therapieschema mit 75 mg/m2 zum Einsatz kommen, da in dieser Indikation keine Evidenz zur Verwendung des wöchentlichen oder 2-wöchentlichen Schemas besteht.
Literatur
1. Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms. [http://leitlinienprogramm-onkologie.de/uploads/tx_sbdownloader/LL_Prostata_Langversion_3.1.pdf].
2. Cornford P et al. EAU-ESTRO-SIOG guidelines on prostate cancer. Part II: Treatment of relapsing, metastatic, and castration-resistant prostate cancer. Eur Urol 2016 [prepub ahead of print, DOI 10.1016/j.eururo.2016.08.002].
3. Pagliarulo V et al. Contemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012; 61: 11-25.
4. Hussain M et al. Intermittent versus continuous androgen deprivation in prostate cancer. N Engl J Med 2013; 368: 1314-25.
5. James ND et al. Survival with newly diagnosed metastatic prostate cancer in the "docetaxel era": Data from 917 patients in the control arm of the STAMPEDE trial (MRC PR08, CRUK/06/019). Eur Urol 2015; 67: 1028-38.
6. Millikan RE et al. Phase III trial of androgen ablation with or without three cycles of systemic chemotherapy for advanced prostate cancer. J Clin Oncol 2008; 26: 5936-42.
7. Noguchi M et al. Chemohormonal therapy as primary treatment for metastatic prostate cancer: A randomized study of estramustine phosphate plus luteinizing hormone-releasing hormone agonist versus flutamide plus luteinizing hormone-releasing hormone agonist. Int J Urol 2004; 11: 103-9.
8. Hoshi S et al. A randomized comparative study of endocrine monotherapy and a combination of estramustine phosphate with the endocrine therapy in patients with untreated stage D prostate cancer. Int J Clin Oncol 2006; 11: 303-8.
9. Gravis G et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): A randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14: 149-58.
10. Gravis G et al. Androgen deprivation therapy (ADT) plus docetaxel versus ADT alone in metastatic non castrate prostate cancer: Impact of metastatic burden and long-term survival analysis of the randomized phase 3 GETUG-AFU15 trial. Eur Urol 2016; 70: 256-62.
11. Sweeney C et al. Impact on overall survival (OS) with chemohormonal therapy versus hormonal therapy for hormone-sensitive newly metastatic prostate cancer (mPrCa): An ECOG-led phase III randomized trial. J Clin Oncol 2014; 32(5s): ASCO 2014, Abstract #LBA2.
12. Sweeney CJ et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373: 737-46.
13. James ND et al. Docetaxel and/or zoledronic acid for hormone-naïve prostate cancer: First overall survival results from STAMPEDE (NCT00268476). J Clin Oncol 2015; 33 (5s): 269s (ASCO 2015, Abstract #5001).
14. Sweeney C et al. Long term efficacy and QOL data of chemohormonal therapy (C-HT) in low and high volume hormone naïve metastatic prostate cancer (PrCa): E3805 CHAARTED trial. Ann Oncol 2016; 27 (Suppl 6): vi244 (ESMO 2016, Abstract #PD720).
15. Tannock IF, Amir E. Clinical trial design and chemotherapy use in prostate cancer: Correcting old mistakes, making new ones. Discussant Abstract #5001, ASCO 2015.
16. Tucci M et al. Addition of docetaxel to androgen deprivation therapy for patients with hormone-sensitive metastatic prostate cancer: A systematic review and meta-analysis. Eur Urol 2016; 69: 563-73.
17. Vale CL et al. Addition of docetaxel or bisphosphonates to standard of care in men with localised or metastatic, hormone-sensitive prostate cancer: A systematic review and meta-analyses of aggregate data. Lancet Oncol 2016; 17: 243-56.
18. Ramos-Esquivel A et al. Androgen-deprivation therapy plus chemotherapy in metastatic hormone-sensitive prostate cancer. A systematic review and meta-analysis of randomized clinical trials. Urol Oncol 2016; 34: 335.e9.

Prof. Dr. med. Carsten-H. Ohlmann
Klinik für Urologie und Kinderurologie
Universität des Saarlandes
Kirrberger Straße, 66421 Homburg/Saar
+49 6841 16 24777
+49 6841 16 1724777
carsten.ohlmann[at]uks[dot]eu


