Die Society for Melanoma Research (SMR) wurde gegründet, um die Kommunikation unter den Melanom-Forschern zu fördern und Brücken zwischen Grundlagen- und translationaler Forschung sowie den klinischen Wissenschaftlern zu schlagen. Dieses Anliegen spiegelt sich in dem jährlichen Kongress der SMR wider: An vier Tagen diskutieren Forscher detailliert über ihre Arbeiten zur Biologie der Melanom-Erkrankung, Subgruppenanalysen und richtungsweisende Untersuchungen aus der Klinik.
Einfluss erhöhter LDH-Spiegel auf die Anti-PD1-Therapie und
Kombinationstherapien
Erhöhte Serum-Spiegel der Laktatdehydrogenase (LDH) zu Therapiebeginn sind ein bekannter negativer prognostischer Marker. Für Patienten mit fortgeschrittenem Melanom wurde unter Ipilimumab ein medianes Gesamtüberleben (OS) von 14,7 Monaten beobachtet, wenn der LDH-Wert die obere Grenze des Normbereichs (ULN) nicht überschritten hatte; das mediane OS lag aber nur bei 3,7 Monaten bei einem LDH-Wert oberhalb des ULN [1]. In der CheckMate-067-Studie wurde ein Therapievorteil für Nivolumab sowie für die Kombination aus Nivolumab und Ipilimumab gegenüber der Ipilimumab-Monotherapie gezeigt [2]. Um eine statistisch relevante Aussage zum Zusammenhang zwischen Therapieerfolg der Kombination und dem LDH-Spiegel machen zu können, wurden die Daten der Studien CheckMate-066, -067 und -069 in einer gepoolten Analyse untersucht [3]. Insgesamt gingen in die Analyse 1.270 therapienaive Patienten mit fortgeschrittenem Melanom ein, von denen 407 mit der Kombination, 507 mit alleinigem Nivolumab und 356 mit alleinigem Ipilimumab behandelt wurden, so James Larkin, London.
815 Patienten hatten normale LDH-Spiegel, 455 Patienten eine erhöhte LDH (> ULN) und bei 132 Patienten war die LDH mehr als verdoppelt (> 2 x ULN). Mit höheren LDH-Spiegeln verschlechterte sich der Allgemeinzustand der Patienten und es wurde weniger häufig eine PD-L1-Expression ≥ 5% festgestellt. Die Ansprechrate war erwartungsgemäß unter allen drei Therapieregimes am höchsten bei normalen LDH-Spiegeln mit 65%, 51% und 23% unter Nivolumab plus Ipilimumab, Nivolumab bzw. Ipilimumab. War die LDH erhöht, so sprachen 45%, 31% bzw. 10% der Patienten auf die Regimes an. Bei mehr als verdoppeltem LDH waren es 33%, 17% bzw. 0% der Patienten, allerdings handelte es sich hier um ein sehr kleines Patientenkollektiv, warnte Larkin.
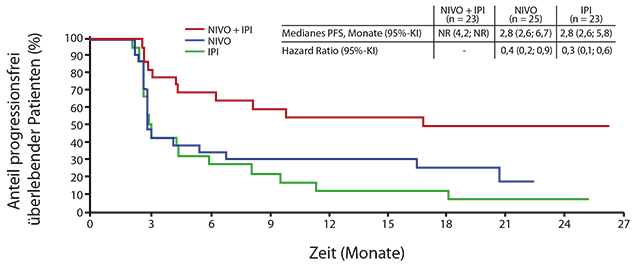
Ein Vorteil für die Kombinationstherapie beim progressionsfreien Überleben (PFS) wurde sowohl bei normaler als auch bei erhöhter LDH gegenüber Ipilimumab (HR 0,4 bzw. 0,5) und schwächer gegenüber alleiniger Nivolumab-Therapie gesehen (HR 0,7 bzw. 0,8). Während Patienten mit einer LDH > 2 x ULN anscheinend nicht von Ipilimumab profitieren, waren immerhin noch 20% der Patienten im Kombinationsarm und 10% derer unter Nivolumab nach zwölf Monaten progressionsfrei, nach 18 Monaten waren es 17% bzw. 10%. Patienten mit BRAF-Mutation und erhöhten LDH-Spiegeln profitierten deutlich stärker von der Kombinationstherapie als von den Monotherapien mit Nivolumab oder Ipilimumab (HR 0,3 bzw. 0,4; Abb. 1). Nebenwirkungen traten bei Patienten mit erhöhter LDH nicht häufiger als bei normaler LDH auf.
Larkins Schlussfolgerung aus den Ergebnissen war, dass in den Nivolumab-haltigen Armen – unabhängig vom LDH-Spiegel – dauerhafte Remissionen erreicht werden. Die Kombination von Nivolumab plus Ipilimumab war auch bei Patienten mit erhöhten LDH-Spiegeln wirksamer als die Monotherapien. Dennoch bleiben Patienten mit erhöhter LDH eine Gruppe mit hohem medizinischem Bedarf.