Die wissenschaftliche Aktivität beim Multiplen Myelom ist ungebrochen, was sich zum Beispiel darin äußert, dass bei kaum einer onkologischen Indikation in den letzten Jahren so viele Medikamente neu zugelassen wurden. Auch beim ASH-Kongress in San Diego im Dezember 2016 war das Myelom stark vertreten: Wir können hier nur eine Auswahlinteressanter Beiträge bringen.
Keine Intensivierung nach Transplantation
Patienten mit neu diagnostiziertem Multiplem Myelom werden bis zu einem Alter von 65 oder bei ausreichender körperlicher Fitness bis zu 70/75 Jahren nach der Induktionstherapie mit einer Hochdosis-Chemotherapie und nachfolgender autologer Blutstammzelltransplantation behandelt. Michele Cavo, Bologna, stellte auf dem ASH-Kongress eine europäische Studie vor, in der eine Therapie mit Bortezomib, Melphalan und Prednison (VMP) mit der autologen Stammzelltransplantation verglichen wurde. Die autologe Blutstammzelltransplantation war bezüglich Ansprechen und progressionsfreiem Überleben der VMP-Therapie überlegen [4].
Nach Transplantation kann mit einer Erhaltungstherapie mit Lenalidomid behandelt werden. Die Vorteile sind durch mehrere große Studien belegt – in San Diego wurden diese durch die Ergebnisse der britischen Phase-III-Studie Myeloma XI [5], in der Lenalidomid das Risiko für Progression oder Tod sowohl bei transplantierten als auch bei nicht transplantierten Patienten um mehr als die Hälfte reduzieren konnte, bestätigt.
Den Nutzen einer Konsolidierung vor Erhaltungstherapie prüfte eine US-amerikanische Studiengruppe in der STaMINA-Studie (Stem Cell Transplantation for Multiple Myeloma Incorporating Novel Agents) [6], in der 750 Patienten mit neu diagnostiziertem Myelom in drei Studienarme randomisiert wurden: Die Patienten durften maximal 70 Jahre alt sein und vor höchstens zwölf Monaten mit der Therapie begonnen haben. Die Randomisierung erfolgte vor einer Hochdosistherapie mit 200 mg/m2 Melphalan und nachfolgender autologer Blutstammzelltransplantation. Im Anschluss an die Blutstammzelltransplantation wurde entweder mit einer Lenalidomid-Erhaltungstherapie oder vorher entweder mit einer zweiten autologen Stammzelltransplantation oder vier Zyklen einer Kombination aus Bortezomib, Lenalidomid und Dexamethason (RVD) behandelt. Die Lenalidomid-Erhaltung erfolgte über minimal drei Jahre oder bis zum Eintritt einer Krankheitsprogression.
Primärer Endpunkt war das progressionsfreie Überleben 38 Monate nach Randomisierung. Hier ergab sich kein signifikanter Unterschied zwischen den drei Armen, wie Edward Stadtmauer, Philadelphia, in der Late-Breaking Abstracts-Sitzung in San Diego berichtete: 52,2% nach alleiniger Erhaltungstherapie, 56,5% nach zweiter Transplantation und 56,7% nach Konsolidierung mit RVD. Ähnlich verhielt es sich beim Gesamtüberleben mit Raten von 83,4%, 82% und 85,7% für die drei Arme. Patienten mit Hochrisiko-Myelom zeigten insgesamt schlechtere Ergebnisse als solche mit Standardrisiko, aber auch hier war kein Unterschied zwischen den Behandlungsarmen erkennbar.
In der Ära der Immunmodulatoren und Proteasominhibitoren – in der Initialtherapie dieser Patienten wurden zu mehr als 90% mindestens eine dieser Substanzklassen, zu mehr als 50% beide gegeben – und der verlängerten Erhaltungstherapie mit Lenalidomid (deren Nutzen durch randomisierte Studien gesichert ist) bringt eine Konsolidierung post transplantationem entweder mit einer zweiten Transplantation oder mit einer Kombination der wirksamsten Medikamente also keinen Zusatznutzen, so Stadtmauers Fazit. Er empfiehlt zukünftig einen Vergleich der neuen Substanzen mit autologer Blutstammzelltransplantation und nachfolgender Lenalidomid-Erhaltungstherapie.
Primärtherapie ohne Transplantation
Rd kontinuierlich punktet weiter
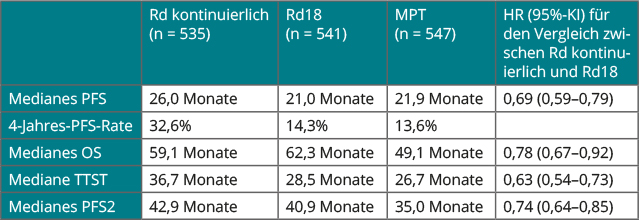
Bei nicht transplantierbaren Patienten mit neu diagnostiziertem Multiplem Myelom ist die kontinuierliche Therapie mit Lenalidomid und niedrig dosiertem Dexamethason (Rd) der zeitlich auf 18 Monate begrenzten Rd-Behandlung ebenso wie dem älteren Regime aus Melphalan, Prednison und Thalidomid (MPT) überlegen. Dies zeigte eine der größten internationalen Myelom-Studien, die First-Studie mit insgesamt 1.623 Teilnehmern [7]. In San Diego präsentierte Thierry Facon, Lille, deren finale Ergebnisse ([8], Tab. 1):
Dabei konnte die kontinuierliche Rd-Gabe sowohl gegenüber MPT als auch gegenüber dem auf 18 Monate begrenzten Rd das Risiko für Progression oder Tod um rund 30% reduzieren (HR 0,69 bzw. 0,70). Bezüglich Gesamtüberleben war der Unterschied zwischen kontinuierlichem Rd und MPT signifikant (HR 0,78; p = 0,00234), gegenüber der begrenzten Rd-Therapie war kein Unterschied erkennbar. Grund dafür kann sein, dass die meisten Patienten nach einer Progression weitere Therapien erhielten, mehr als die Hälfte von ihnen auf der Basis von Bortezomib. Die kontinuierliche Gabe von Rd bleibt damit ein Therapiestandard bei nicht transplantationsfähigen Patienten mit neu diagnostiziertem Myelom, so Facon.