Auf die Vielzahl interessanter Neuigkeiten zu Lymphomen, die beim Kongress der American Society of Hematology (ASH) im Dezember 2016 vorgestellt wurden, können wir hier nur ein paar wenige Schlaglichter werfen, bei denen möglichst alle Lymphom-Subtypen berücksichtigt werden sollen. Neue Antikörper, Erhaltungstherapien und hocheffektive zelluläre Therapien sind nur einige der zukunftsweisenden Entwicklungen, mit denen wir künftig unsere Patienten hoffentlich noch wirksamer werden behandeln können.
Follikuläres Lymphom: Typ-II-CD20-Antikörper überlegen
Die Standard-Erstlinientherapie bei fortgeschrittenen, symptomatischen follikulären Lymphomen ist eine Immunchemotherapie mit dem CD20-Antikörper Rituximab (R-Chemo) und eine anschließende Rituximab-Erhaltungstherapie. Damit lassen sich progressionsfreie Überlebenszeiten von median sechs bis acht und Gesamtüberlebenszeiten von median 15–20 Jahren erzielen, aber heilbar ist die Erkrankung so in aller Regel nicht. Etwa jeder dritte Patient erleidet bereits in den ersten drei Jahren ein Rezidiv, das mit einer schlechten Prognose einhergeht. In dieser Rezidivsituation hat sich der Typ-II-CD20-Antikörper Obinutuzumab in Kombination mit einer Chemotherapie als wirksam und gut verträglich erwiesen. Deshalb wurde in der Phase-III-Studie GALLIUM, an der auch einige unserer deutschen Studiengruppen beteiligt waren, Obinutuzumab in Kombination mit Chemotherapie bei Patienten mit nicht vorbehandelten indolenten Non-Hodgkin-Lymphomen randomisiert gegen R-Chemo getestet; in beiden Regimes erhielten Patienten, bei denen die Induktionstherapie mindestens zu einer partiellen Remission führte, anschließend über zwei Jahre alle zwei Monate den jeweiligen Antikörper als Erhaltungstherapie.
Eingeschlossen wurden (neben 195 Patienten mit nicht chemotherapiertem Marginalzonen-Lymphom) 1.202 Patienten mit nicht vorbehandeltem follikulärem Lymphom. Als Chemotherapie konnten die behandelnden Ärzte entweder sechs Zyklen des CHOP-Regimes (Cyclophosphamid, Doxorubicin, Vincristin, Prednison) oder CVP (CHOP ohne das Anthrazyklin) in jeweils acht dreiwöchigen Zyklen oder Bendamustin (in sechs vierwöchigen Zyklen) wählen. Die Interimsanalyse, die Robert Marcus, London, in der Plenarsitzung des ASH-Kongresses in San Diego vorstellen konnte [1], umfasste nur die Patienten mit follikulärem Lymphom, die zu 57% Bendamustin, zu einem Drittel CHOP und zu etwa 10% CVP erhalten hatten.
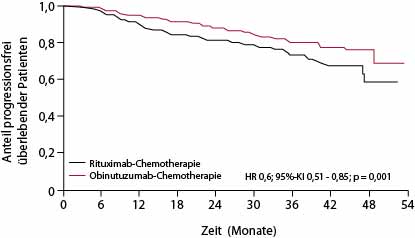
Nach median 34,5 Monaten Nachbeobachtung ergab sich beim progressionsfreien Überleben nach dem Urteil der Prüfärzte ein Vorteil für den Obinutuzumab- gegenüber dem Rituximab-Arm mit einer progressionsfreien 3-Jahres-Überlebensrate von 80% versus 73,3%; mit einer Hazard Ratio von 0,66 entspricht das einer Risikoreduktion für Progression oder Tod um etwa ein Drittel (p = 0,001). Bei zentraler Auswertung lag die Hazard Ratio bei 0,71 (p = 0,014). Der Medianwert ist noch in keinem der Arme erreicht (s. Abb. 1a), aber wenn man für den Rituximab-Arm von einem medianen progressionsfreien Überleben von sechs Jahren ausgeht, könnte man eine Verlängerung um ungefähr drei Jahre durch Obinutuzumab erwarten, so Marcus. Für alle untersuchten Subgruppen waren die Ergebnisse vergleichbar.
Zum Analyse-Zeitpunkt (Ende Januar 2016) waren im Rituximab-Arm 46 und im Obinutuzumab-Arm 35 Patienten verstorben. Das resultiert vorläufig in einer Hazard Ratio von 0,75 für das Gesamtüberleben, aber der Unterschied kann nach knapp drei Jahren beim follikulären Lymphom mit seiner geringen Progressionsgeschwindigkeit natürlich noch nicht signifikant sein (p = 0,210).
Die Häufigkeit von Toxizitäten der Grade 3–5, insbesondere Infusionsreaktionen, Zytopenien und Infektionen, war im Obinutuzumab-Arm mit 74,6% versus 67,8% etwas höher; insbesondere erscheinen rund 5% toxische Todesfälle in dem Stratum, das mit Bendamustin – unabhängig von der Art des Antikörpers – behandelt wurde, für eine so indolente Erkrankung inakzeptabel hoch. Erklären lässt sich diese hohe Letalität dadurch, dass viele der Zentren, die Bendamustin als Chemotherapie-Rückgrat wählten, mit dieser wirksamen, aber nicht ganz einfach anzuwendenden Substanz keine Erfahrung hatten. Insgesamt sprechen diese Daten sicherlich dafür, dass die Kombination aus Obinutuzumab und Chemotherapie sich in Zukunft zu einem neuen Therapiestandard beim neu diagnostizierten follikulären Lymphom entwickeln wird.
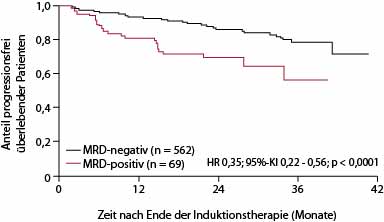
Von mehr als der Hälfte der Patienten konnte während und nach Ende der Induktionstherapie zentral im Labor der Universität Kiel die minimale Resterkrankung (MRD) bestimmt werden; eine exploratorische Analyse präsentierte Christiane Pott, Kiel, in San Diego [2]: Dabei erwies sich der MRD-Status nach Induktionsende als prognostisch für das progressionsfreie Überleben (Abb. 1b). Der Anteil der MRD-negativen Patienten war im Obinutuzumab-Arm signifikant höher als im Rituximab-Arm, und zwar sowohl während der Induktionsbehandlung im peripheren Blut (94,3% vs. 88,9%; p = 0,013) als auch am Ende der Induktion in peripherem Blut und/oder Knochenmark (92% vs. 84,9%; p = 0,0041). Offenbar, so Frau Pott, führt der Typ-II-Antikörper zu einer effektiveren und schnelleren Zerstörung der Tumorzellen als Rituximab.