Bei der Therapie der akuten lymphatischen Leukämie (ALL) des Erwachsenen tun wir uns noch immer schwerer als die pädiatrischen Kollegen. Nach und nach zeigt sich, dass die aggressiveren pädiatrischen Therapieprotokolle sich auch hier mit größerem Erfolg einsetzen lassen als unsere bisherigen Regimes. Bei der Jahrestagung der American Society of Hematology (ASH) in San Diego im Dezember 2016 wurden dazu einige wichtige Auswertungen präsentiert. Bei der kindlichen ALL gab es unter anderem eine Vielzahl von neuen Ergebnissen zur Salvagetherapie mit T-Zellen, die chimäre Antigenrezeptoren tragen.
Pädiatrische Protokolle: Bis 55 erfolgreich …
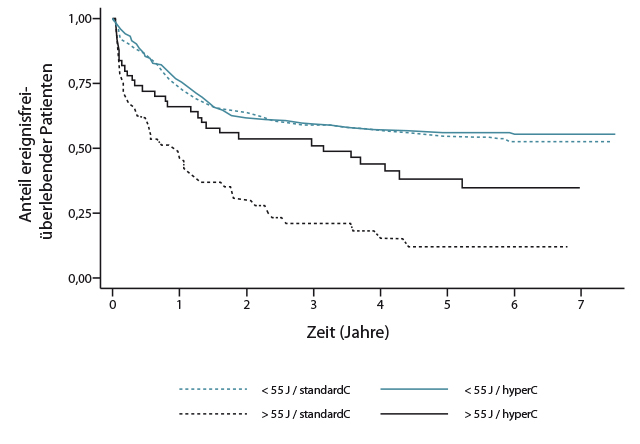
Die Anwendung pädiatrischer ALL-Protokolle wurde aufgrund ihrer großen Erfolge bei Kindern immer mehr auf höhere Altersgruppen ausgeweitet und hat sich zumindest bei jungen Erwachsenen ebenso bewährt. Unklar war bislang, wie hoch man im Alter mit diesen doch sehr aggressiven Regimes gehen kann. Die französisch-schweizerische GRAALL-Studiengruppe hat das in ihrer Studie 2005 ausgetestet, in der Patienten im Alter zwischen 18 und 59 Jahren eine pädiatrische Behandlung bekamen, wobei eine Randomisierung bezüglich der Cyclophosphamid-Gabe erfolgte: Jeweils die Hälfte der Patienten erhielt das Alkylans während Induktions- und Intensivierungstherapie in Standarddosierung (750 mg/m2 an den Tagen 1 und 15) oder in einem hyperfraktionierten Regime (750 mg/m2 an Tag 1 und 300 mg/m2 alle zwölf Stunden an den Tagen 15–17).
Beim primären Endpunkt ereignisfreies Überleben, so Françoise Huguet, Toulouse [1], schnitten die 35–54-Jährigen mit 6-Jahres-Raten von rund 50% nahezu genauso gut ab wie die jüngeren Patienten, während die älteren Patienten dagegen deutlich abfielen – überwiegend wegen stärkerer Toxizität und dadurch verschlechterter Compliance. Das hyperfraktionierte Cyclophosphamid brachte diesen Patienten allerdings – im Gegensatz zu den jüngeren – einen deutlichen Gewinn beim ereignisfreien Überleben (Abb. 1). Eine weitere Alternative für die über 55-Jährigen, so Huguet, könnte die Verwendung neuer Substanzen wie Inotuzumab Ozogamicin sein.