Artikel als PDF downloaden.
Multiples Myelom
ASH 2015
Die Therapie des multiplen Myeloms, die erst vor etwa zehn bis fünfzehn Jahren mit der Einführung der ersten zielgerichteten Substanzen (Proteasominhibitoren und Immunmodulatoren) einen Entwicklungsschub erfahren hatte, befindet sich derzeit wieder in einem grundlegenden Umbruch: Neue Proteasominhibitoren, Histondeacetylaseinhibitoren, Immunmodulatoren und monoklonale Antikörper wurden jüngst zugelassen oder stehen kurz vor der Zulassung. Die Aufbruchsstimmung auf diesem Gebiet wird auch dadurch illustriert, dass bei der Jahrestagung der American Society of Hematology (ASH) in Orlando im Dezember 2015 nahezu ein Zehntel aller Abstracts in der Abteilung Myelom zu finden war.
Proteasominhibitoren und Immunmodulatoren der ersten Generation, d. h. Bortezomib, Thalidomid und Lenalidomid, sind mittlerweile beide Standards in der Erstlinientherapie des Myeloms bei Patienten, die nicht für eine autologe Stammzelltransplantation (ASCT) infrage kommen: Bortezomib zusammen mit Melphalan und Prednison (VMP) oder mit Thalidomid und Dexamethason (VTD), Lenalidomid zusammen mit niedrig dosiertem Dexamethason (Rd). In einer Phase-III-Studie der South-West Oncology Group (SWOG) wurde Bortezomib zum Rd-Regime gegeben (VRd) und randomisiert mit Rd alleine verglichen [1]; als Erhaltungstherapie bekamen die Patienten Rd bis zur Progression oder bis zum Auftreten nicht mehr tolerierbarer Nebenwirkungen. Primärer Endpunkt war das progressionsfreie Überleben; hier schnitt das VRd-Protokoll mit median 43 Monaten deutlich und signifikant besser ab als Rd mit 30 Monaten (Hazard Ratio 0,712; p = 0,0018). Ebenfalls signifikant überlegen war das Dreierregime beim Gesamtüberleben mit median 75 versus 64 Monaten (HR 0,709; p = 0,025). Dieses Ergebnis war statistisch unabhängig vom Alter der Patienten. Deutlich schlechter schnitt VRd allerdings bei den Nebenwirkungen ab; insbesondere neurologische Toxizitäten vom Grad 3 oder höher waren hier etwa dreimal häufiger, ebenso gastrointestinale Nebenwirkungen. Allerdings war Bortezomib in dieser Studie in der intravenösen Galenik verabreicht worden – bei Anwendung der mittlerweile verfügbaren subkutanen Form kann man davon ausgehen, dass zumindest die neurologischen Nebenwirkungen deutlich abnehmen würden. Brian Durie, Los Angeles, der die Daten vorstellte, hält die Dreierkombination, gefolgt von der Rd-Erhaltung, für einen potenziellen neuen Therapiestandard.
Bortezomib vor Transplantation
In unserer deutsch-holländischen Phase-III-Studie HOVON-65/GMMG HD4 hatten wir bereits früher gezeigt, dass bei transplantationsfähigen Patienten der Ersatz von Vincristin im VAD-Protokoll (Vincristin, Doxorubicin, Dexamethason) durch Bortezomib (PAD) und die Gabe von Bortezomib anstelle von Thalidomid als Erhaltungstherapie nach der Transplantation progressionsfreies und Gesamtüberleben signifikant verbesserte [2]. Pieter Sonneveld, Rotterdam, präsentierte in Orlando die Langzeitergebnisse dieser Studie [3], denen zufolge nach acht Jahren das progressionsfreie Überleben mit 17% nach PAD vs. 10% nach VAD signifikant besser blieb (HR 0,77; p = 0,001), während beim Gesamtüberleben kein Unterschied mehr zu erkennen war (48% vs. 45%; HR 0,87;
p = 0,22). Günstig wirkte sich – was auch schon in der ersten Analyse erkennbar war – eine Tandem-Transplantation aus, die gegenüber einer nur einmaligen Hochdosistherapie das 8-Jahres-Überleben signifikant von 42% auf 55% steigern konnte (HR 0,71; p = 0,018). Einigen Subgruppen brachte die Bortezomib-Therapie erhebliche Vorteile beim Überleben: Patienten mit eingeschränkter Nierenfunktion schnitten unter der VAD/Thalidomid-Behandlung deutlich schlechter ab (8-Jahres-Überlebensrate 12% vs. 42% ohne Nierenkrankheit; p < 0,001), während unter der PAD/Bortezomib-Therapie hier kein Unterschied festzustellen war (47% mit vs. 48% ohne Niereninsuffizienz). Außerdem konnte Bortezomib offenbar die negativen Auswirkungen einer 17p-Deletion kompensieren (8-Jahres-Überleben 18% unter VAD/Thalidomid gegenüber 65% unter PAD/Bortezomib). Patienten mit einer Translokation t(4;14) und einer Amplifikation (1q) hingegen scheinen geringer von dem neueren Regime zu profitieren.
Die Transplantation bleibt noch unverzichtbar
Die Wirksamkeit der modernen Kombinationsprotokolle ließ in der Vergangenheit immer wieder die Hoffnung aufkommen, dass man damit eventuell auf die Hochdosistherapie mit nachfolgender Stammzelltransplantation verzichten könnte. So untersuchte die französische Myelom-Studiengruppe diese Fragestellung in ihrer Phase-III-Studie IFM 2009, in der 700 Patienten im Alter von bis zu 65 Jahren entweder acht Zyklen RVD (Lenalidomid, Bortezomib, Dexamethason) oder fünf Zyklen und nach dem dritten Zyklus eine Hochdosistherapie erhielten und alle anschließend einer einjährigen Erhaltungstherapie mit Lenalidomid unterzogen wurden [4]. Primärer Endpunkt war das progressionsfreie Überleben; hier zeigte sich nach vier Jahren, dass man auf die Transplantation doch noch nicht verzichten sollte:
In dieser Gruppe überlebten die Patienten median 43 Monate lang progressionsfrei, in der Kontrollgruppe nur 34 Monate; nach vier Jahren betrugen die Raten 47% vs. 35% (HR 0,69; p < 0,001). Die Überlebensraten hingegen waren mit 81% vs. 82% nach vier Jahren noch nicht unterschiedlich. Der Vorteil für die Transplantationsstrategie hatte sich schon bei den Ansprechraten abgezeichnet, die beim Myelom stark prädiktiv für das langfristige Ergebnis sind: 59% vs. 49% Komplettremissionen (p = 0,02) und bei diesen Patienten 88% vs. 65% MRD-Negativität (gemessen mittels Durchflusszytometrie) markierten die Überlegenheit der klassischen Hochdosistherapie, die damit, so Michel Attal, Toulouse, bis auf Weiteres Therapiestandard bei transplantablen Myelom-Patienten bleibt.
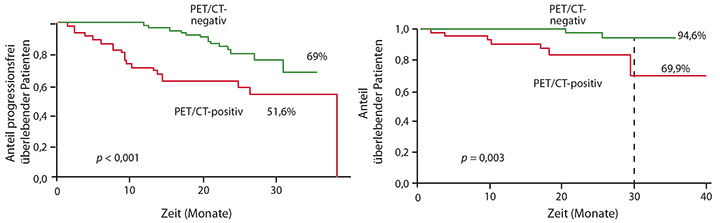
In einer Substudie der IFM 2009-Studie wurde ein Teil der Patienten zu Beginn, nach drei Zyklen RVD und vor Beginn der Erhaltungstherapie mittels Kernspin- (MRT) und Positronenemissionstomografie in Kombination mit Computertomografie (PET-CT) untersucht [5]. Es zeigte sich, so Philippe Moreau, Nantes, dass Knochenläsionen vor Beginn der Therapie mit beiden Methoden gut detektierbar sind, dass jedoch nicht das MRT, wohl aber das PET-CT nach drei Zyklen und insbesondere vor der Erhaltung sowohl progressionsfreies (Abb. 1, links) als auch Gesamtüberleben (Abb. 1, rechts) vorhersagen konnte. Die französischen Kollegen empfehlen daher, bei jungen Patienten, die Protokolle mit den neuen Medikamenten erhalten, PET-CT in die Betreuung miteinzubeziehen, um eine zuverlässigere Vorhersage des langfristigen Ergebnisses machen zu können.
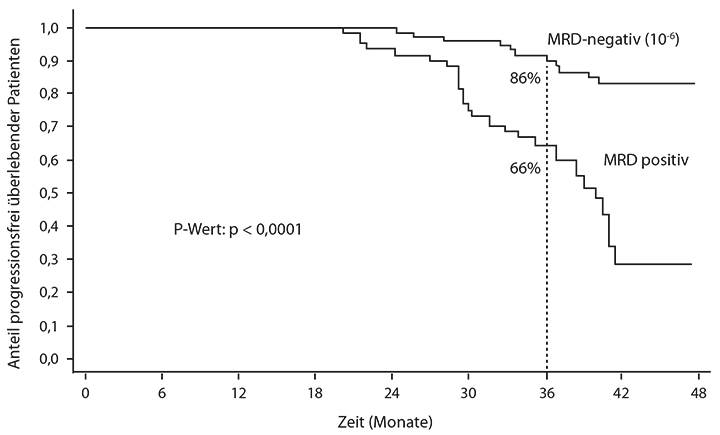
Eine weitere Subgruppenanalyse der gleichen Studie [6] zeigt, dass auch die MRD-Bestimmung ein sehr wirkungsvoller prognostischer Parameter ist, so Hervé Avet-Loiseau, Toulouse. Wie in Abb. 2 zu erkennen ist, kann eine MRD-Negativität nach dem Ende der Erhaltungstherapie auf einem Sensitivitätsniveau von 10-6 mit hoher Trennschärfe das progressionsfreie Überleben von Patienten vorhersagen: Patienten, die einen negativen MRD-Status erreichten, waren nach drei Jahren noch zu 86% progressionsfrei am Leben, diejenigen mit verbliebener minimaler Resterkrankung zu 66%.
Vor Transplantation eher VTD als VCD?
Keinen unbestrittenen Standard gibt es bisher für die Induktionsbehandlung vor Hochdosistherapie. Die ebenfalls französische IFM 2013-04-Studie verglich hier randomisiert vier Zyklen einer VCD-Therapie (Bortezomib, Cyclophosphamid, Dexamethason) mit einem VTD-Regime, bei dem das Cyclophosphamid durch Thalidomid ersetzt ist [7]. Primärer Endpunkt war die Rate an sehr guten partiellen Remissionen (VGPR) nach diesen vier Zyklen, dabei war die Überlegenheit des VTD-Protokolls mit 66,3% gegenüber 56,2% statistisch grenzwertig signifikant (p = 0,05). Ebenfalls grenzwertig signifikant war ein Trend zu höheren Zahlen an CD34-positiven Stammzellen, die nach der VTD-Behandlung für die Transplantation gesammelt werden konnten. Im Cyclophosphamid-Arm wurde mehr Hämatotoxizität beobachtet, während unter VTD mehr periphere Neuropathien registriert wurden. Da Bortezomib in dieser Studie subkutan gegeben worden war, wurden sie wohl überwiegend durch Thalidomid verursacht. Dennoch war das Resümee von Philippe Moreau, dass VTD als Induktions-Regime vor der Hochdosistherapie vorzuziehen sei.
Neue Proteasominhibitoren
Erster oraler Proteasominhibitor
Als neuer Proteasominhibitor, der im Gegensatz zu den bisher zugelassenen Substanzen oral verfügbar ist, wurde Ixazomib vor Kurzem in den USA zugelassen; die Zulassung in Europa wird in Kürze erwartet. Sie beruht auf der Phase-III-Studie Tourmaline-MM1, die Teil eines größeren Entwicklungsprogramms ist und in der 722 Patienten mit vorbehandeltem multiplem Myelom (bis zu drei Vortherapien), die nicht refraktär gegenüber Lenalidomid oder einer Proteasominhibitor-basierten Therapie waren, Lenalidomid und Dexamethason (Rd) und dazu randomisiert entweder Ixazomib (4 mg an den Tagen 1, 8 und 15 eines vierwöchigen Zyklus) oder Placebo erhielten [8].
Primärer Endpunkt war das progressionsfreie Überleben; hier erwies sich Ixazomib mit median 20,6 vs. 14,7 Monaten dem Placebo als überlegen (HR 0,742; p = 0,012). Ähnliches galt auch für die Gesamtansprechrate (78,3% vs. 71,5%; Odds Ratio 1,44; p = 0,035), die Rate an Komplettremissionen (OR 1,87; p = 0,019) und an mindestens sehr guten partiellen Remissionen (≥ VGPR: 48,1% vs. 39,0%; OR 1,45; p = 0,014). Der Nutzen der Dreierkombination zeigte sich auch bei Patienten mit Deletion 17p. Die Toxizität war im Ixazomib-Arm geringfügig erhöht (Grad 3 oder höher vor allem Thrombozytopenien 13% vs. 5%). Periphere Neuropathien höherer Schwergrade waren in beiden Armen mit 2% gleich häufig. Im Falle einer Zulassung, so Philippe Moreau, könnte sich diese Kombination auch in Europa als ein neuer Standard in dieser Indikation (Patienten mit bis zu drei Vortherapien, nicht refraktär gegen IMiDs und Proteasominhibitoren) etablieren.
Auch bei Patienten mit neu diagnostiziertem Myelom, die nicht für eine Transplantation geeignet sind, wird Ixazomib getestet: In der Tourmaline-MM2-Studie erhalten sie die gleiche Kombination, in einer Phase-II-Studie, die Meletios Dimpopoulos, Athen, in Orlando vorstellte, eine ebenfalls komplett orale Kombination aus Ixazomib, Cyclophosphamid und niedrig dosiertem Dexamethason (ICd) [9], gefolgt von einer Erhaltungstherapie mit Ixazomib; Cyclophosphamid wurde dabei in zwei verschiedenen Dosierungen in Höhe von 300 bzw. 400 mg/m2 an den Tagen 1, 8 und 15 eines jeden der bis zu 13 vierwöchigen Zyklen gegeben.
Als primärer Endpunkt fungierte hier die Rate an kompletten und sehr guten partiellen Remissionen, die während dieser Induktionstherapie beobachtet wurden. Sie lag bei 26% bei einer Gesamtansprechrate von 71% und einer Komplettremissionsrate von 9%. Die Remissionen wurden nach median 1,3 Zyklen registriert. Die progressionsfreie 1-Jahres-Rate lag bei insgesamt 80% mit einem kleinen Vorteil zugunsten des Arms mit 400 mg/m2 Cyclophosphamid (91% vs. 68%). Das Toxizitätsprofil bewegte sich im Rahmen dessen, was aus früheren Studien mit Ixazomib bekannt ist; die höhere Cyclophosphamid-Dosis war mit mehr Toxizität assoziiert. Zusätzliche und tiefere Remissionen in einem späteren Stadium der Induktion lassen vermuten, so Dimopoulos, dass die Ansprechraten sich mit längerer Zeitdauer noch verbessern werden.
Carfilzomib auch in Subgruppen wirksam
Ein weiterer Proteasominhibitor der zweiten Generation, der parenteral zu applizieren ist und vor Kurzem zugelassen wurde, ist Carfilzomib. In der Phase-III-Studie ENDEAVOR fand ein randomisierter Vergleich von Carfilzomib in Kombination mit Dexamethason versus Bortezomib-Dexamethason bei Patienten mit rezidiviertem Myelom (bis zu drei Vortherapien) statt. Die Daten zur progressionsfreien Überlebenszeit, die durch Carfilzomib verdoppelt werden konnte (median 18,7 versus 9,4 Monate; HR 0,53; p < 0,0001), wurden bereits beim ASCO-Kongress im Sommer 2015 vorgestellt [10]. In Orlando konnte Dimopoulos Analysen präsentieren, die sich mit zytogenetischen Risikogruppen beschäftigten [11]. Zytogenetisches Hochrisiko war definiert als das Vorliegen der Translokationen t(4;14) oder t(14;16) in mindestens 10% oder einer Deletion 17p in mindestens 20% der mittels Fluoreszenz-in-situ-Hybridisierung (FISH) untersuchten Plasmazellen aus dem Knochenmark; Patienten ohne diese Hochrisiko-Merkmale konstituierten die Standardrisiko-Gruppe.
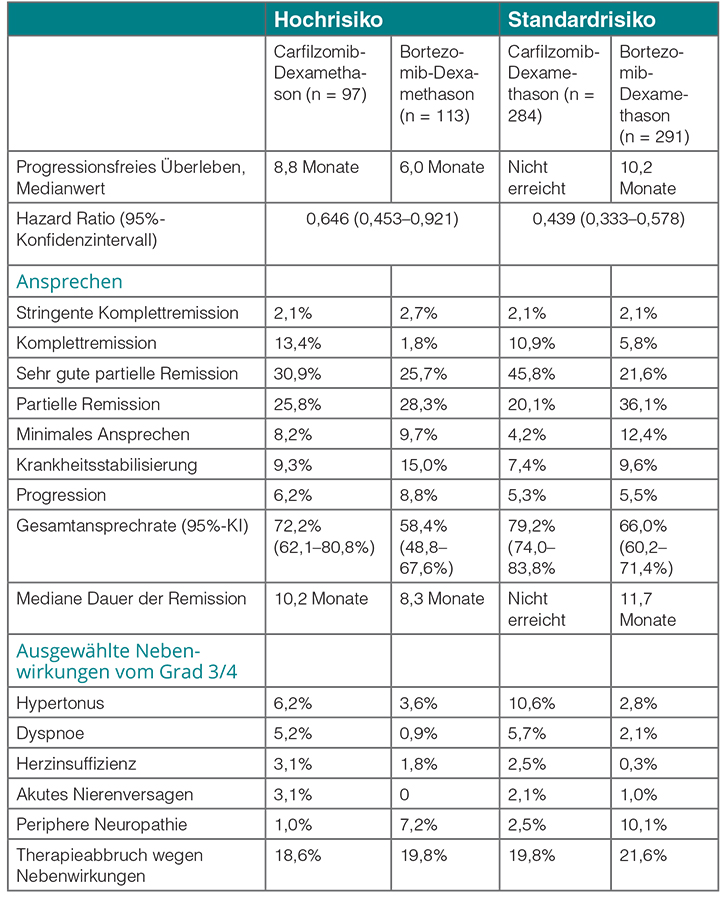
Tabelle 1 zeigt, dass Carfilzomib in beiden Gruppen einen Vorteil beim progressionsfreien Überleben gegenüber Bortezomib bringt, wenngleich die Hochrisiko-Gruppe erwartungsgemäß schlechter abschneidet. Ähnliches trifft auf die Ansprechraten und auf die Tiefe des Ansprechens zu (Tab. 1). Bezüglich der Häufigkeit von Grad-3/4-Toxizitäten unterscheiden sich beide Regimes nicht nennenswert (Tab. 1). Carfilzomib-Dexamethason, so Dimopoulos, hat also insbesondere bei Patienten mit rezidiviertem zytogenetischem Hochrisiko-Myelom ein vorteilhaftes Nutzen-Risiko-Profil; wirksamer als Bortezomib-Dexamethason ist es unabhängig vom zytogenetischen Risiko.
In einer weiteren Subgruppenanalyse konnte Philippe Moreau zeigen, dass der Nutzen von Carfilzomib gegenüber Bortezomib in der ENDEAVOR-Studie unabhängig von der Zahl der Vortherapien war [12] – auch wenn Patienten, die diese Therapie in der Zweitlinie erhalten hatten, am meisten profitierten: Bei ihnen verlängert Carfilzomib das mediane progressionsfreie Überleben um ein ganzes Jahr von 10,1 auf 22,2 Monate (HR 0,447), während es bei Patienten mit zwei oder mehr vorhergehenden Therapielinien nur 14,9 versus 8,4 Monate waren (HR 0,604).
Auch KRd mit breiter Wirksamkeit
Die Zulassung von Carfilzomib basiert auf der Phase-III-Studie ASPIRE, in der es als Verstärkung des Rd-Regimes in der rezidivierten Situation getestet wurde. Wie die initiale Auswertung zeigte, war das Triplet (KRd) der Zweierkombination aus Lenalidomid und niedrig dosiertem Dexamethason hinsichtlich des PFS überlegen [13]. In Orlando zeigte Hervé Avet-Loiseau, Toulouse, die Ergebnisse einer Analyse, die sich speziell mit den durch zytogenetische Anomalien definierten Subgruppen befasste [14]: Auch hier war zu erkennen, dass die Triple-Therapie sowohl bei Hoch- als auch bei Standardrisiko-Patienten progressionsfreies Überleben und Ansprechen sowie die Tiefe der Remissionen gegenüber Rd verbesserte; das progressionsfreie Überleben wurde bei Standardrisiko von median 19,5 auf 29,6 (HR 0,639) und bei Hochrisiko-Konstellation von 13,9 auf 23,1 Monate (HR 0,657) verlängert. Das Verträglichkeitsprofil war sehr gut mit Raten an Nebenwirkungen vom Grad 3 oder höher, die sich durchweg im niedrigen einstelligen Prozentbereich bewegten.
Zugelassen ist Carfilzomib demnach bisher zusammen mit Lenalidomid und Dexamethason beim rezidivierten Myelom für die Gabe in vierwöchigen Zyklen jeweils an den beiden ersten Tagen einer Woche, wobei in der vierten Woche pausiert wird. Bei den ersten beiden Gaben wird es mit 20 mg/m2 (maximal 44 mg), anschließende mit 27 mg/m2 (maximal 60 mg) dosiert; die Applikation erfolgt in einer zehnminütigen Infusion. Ob sich die Gabe vereinfachen lässt, wurde in der US-amerikanischen Phase-I/II-Studie CHAMPION-1 geprüft, in der Patienten mit rezidiviertem oder refraktärem multiplem Myelom erstmals eine einmal wöchentliche Dosierung mit 70 mg/m2 an den Tagen 1, 8 und 15 jedes Zyklus
(20 mg/m2 bei der ersten Gabe, jeweils in Kombination mit Dexamethason) erhielten [15]. Verträglichkeit und Wirksamkeit waren bei insgesamt 104 Patienten so zufriedenstellend, dass dieses Protokoll nun in der auf Überlegenheit angelegten Phase-III-Studie ARROW mit dem herkömmlichen Regime verglichen werden soll [16].
Immunmodulatorische Substanzen (IMiDs)
Der Immunmodulator Pomalidomid hatte in den zwei zulassungsrelevanten Phase-III-Studie MM-002 und MM-003 in Kombination mit niedrig dosiertem Dexamethason Wirksamkeit und gute Verträglichkeit auch bei Patienten mit leichter Nierenfunktionsstörung gezeigt. Patienten mit schwerer Niereninsuffizienz waren in dieser Studie ausgeschlossen gewesen; da diese Komplikationen bei Myelom-Patienten sehr häufig sind und die Prognose negativ beeinflussen, wurden in einer europaweiten Phase-II-Studie speziell Patienten mit mäßiger Störung (n = 80), mit schwerer Insuffizienz ohne Dialysepflichtigkeit (n = 33) sowie dialyseabhängige Patienten (n = 14) eingeschlossen [17]. Die Patienten mussten mindestens eine vorhergehende Therapie (einschließlich Lenalidomid) erhalten haben und wurden mit Pomalidomid
(4 mg/d für drei von vier Wochen eines Zyklus) und Dexamethason (40 mg wöchentlich) behandelt.
Die Studie rekrutiert noch, aber schon die ersten Ergebnisse zeigen laut Karthik Ramasamy, Oxford, dass man die Kombination unabhängig vom Ausmaß der Nierenschädigung dosisadaptiert verabreichen kann. Die Nebenwirkungen unterscheiden sich nicht von den bislang für Pomalidomid beobachteten: Im Vordergrund stehen Myelosuppression und Infektionen, aber die Häufigkeit von Neutropenien und Thrombozytopenien war ähnlich wie bei nierengesunden Patienten. Beim Auftreten von peripheren Zytopenien kann eine Dosismodifikation erwogen werden, bei Infektionszeichen kann eine Unterbrechung der Therapie angezeigt sein.
Rd kontinuierlich: Zytogenetik spielt eventuell eine Rolle
In der zulassungsrelevanten FIRST-Studie (MM-020) erhielten nicht für eine Transplantation geeignete Patienten mit neu diagnostiziertem Myelom eine von drei verschiedenen Therapien: Lenalidomid mit niedrig dosiertem Dexamethason entweder kontinuierlich bis zum Progress oder für 18 Zyklen (72 Wochen) oder aber die Dreierkombination aus Melphalan, Prednison und Thalidomid (MPT). In der Primäranalyse der Studie [18] zeigte sich das kontinuierlich gegebene Rd-Regime dem MPT überlegen, sowohl bezüglich progressionsfreiem als auch Gesamtüberleben. Für 762 der insgesamt 1.623 Patienten lagen validierte zytogenetische Untersuchungen vor; 142 Patienten hatten demzufolge ein Hoch- und 620 ein Standardrisiko, und die entsprechende Subgruppenanalyse präsentierte in Orlando Hervé Avet-Loiseau, Toulouse [19].
Die Ansprechraten waren auch hier mit kontinuierlichem Rd höher und die Remissionen im Mittel tiefer, unabhängig vom zytogenetischen Risikostatus. Progressionsfreies und Gesamtüberleben fielen insgesamt auch für kontinuierliches Rd besser aus als für MPT – das galt aber nur für die Patienten ohne Hochrisiko-Zytogenetik. In der Hochrisiko-Kohorte war das Gesamtüberleben für alle Regimes vergleichbar, beim progressionsfreien Überleben schnitt die auf 18 Zyklen limitierte Rd-Behandlung am besten ab. Das kann laut Avet-Loiseau dadurch bedingt sein, dass die Hochrisiko-Patienten im kontinuierlichen Rd-Arm kürzer behandelt wurden als im MPT-Arm. Die Ergebnisse seien auf jeden Fall eine Empfehlung, kontinuierliches Rd bei Patienten ohne Hochrisiko-Zytogenetik zu geben. Für Hochrisiko-Patienten ließen sich vermutlich bessere Überlebensresultate erzielen, wenn Rd als „Backbone“ für Triplet-Kombinationen mit einer der neueren Substanzen benutzt wird: In mindestens zwei Phase-III-Studien ist durch die Zugabe von Carfilzomib [13] bzw. des SLAMF7-Antikörpers Elotuzumab [20] eine solche Verbesserung auch für Patienten mit zytogenetischen Hochrisiko-Anomalien wahrscheinlich.
Histondeacetylase-Inhibitoren
Der Histondeacetylase-Inhibitor Panobinostat ist seit Kurzem als erste Substanz dieser Klasse in Kombination mit Bortezomib und Dexamethason zur Therapie von Myelom-Patienten zugelassen, die mindestens zwei vorausgegangene Therapien, darunter Bortezomib und einen Immunmodulator, erhalten haben. In der Zulassungsstudie PANORAMA-1 [21] hatte die Kombination gegenüber Bortezomib-Dexamethason alleine die Komplettremissionsrate von 15% auf 27% beinahe verdoppelt. Weil bei transplantationsfähigen Patienten mit neu diagnostiziertem Myelom die Tiefe der durch die Induktionstherapie verursachten Remission für die Prognose ausschlaggebend ist, versucht man, für diese Therapie möglichst effektive Protokolle zu entwickeln. In der initialen Phase einer Phase-I/II-Studie mit solchen Patienten hatte sich die Zugabe von Panobinostat zur Dreierkombination aus Lenalidomid, Bortezomib und Dexamethason (RVD) als sicher applizierbar erwiesen. In Orlando berichtete Jatin Shah, Houston, über den Phase-II-Teil der Studie [22]:
Die Ergebnisse von bisher 42 Patienten bestätigen, dass man 10 mg/d Panobinostat in dieser Viererkombination sicher geben kann mit minimaler gastrointestinaler Toxizität, v. a. Durchfällen, und nur zwei Fällen einer Grad-3/4-Neuropathie; Bortezomib war in diesem Protokoll subkutan gegeben worden. Von 39 auswertbaren Patienten, die vier Zyklen der Behandlung erhalten konnten, erreichten 36 (93%) ein Ansprechen, darunter 44% komplette, 26% sehr gute partielle und 23% partielle Remissionen. Bei den zwölf auswertbaren Patienten mit Hochrisiko-Erkrankung lag die Gesamtansprechrate bei 100% mit sechs kompletten Remissionen. Die Autoren sind der Meinung, dass diese Ergebnisse eine randomisierte Studie zum definitiven Test der Wirksamkeit von Panobinostat als Ergänzung des RVD-Regimes in der Induktionstherapie bei transplantablen Patienten mit neu diagnostiziertem multiplem Myelom rechtfertigen.
Monoklonale Antikörper …
… gegen das CD38-Antigen und …
Auch beim multiplen Myelom beginnt nun die Ära der Therapie mit monoklonalen Antikörpern, die bei Lymphomen bereits vor 20 Jahren eingeführt wurden. Eines der am stärksten exprimierten Antigene auf den Plasmazellen ist CD38, gegen das sich mehrere Antikörper in der klinischen Prüfung befinden. Am weitesten fortgeschritten ist Daratumumab, ein voll humaner IgG1κ-Antikörper gegen CD38, der in zwei Phase-II-Studien (GEN501 und SIRIUS) in Monotherapie bei stark vorbehandelten Patienten, die im Grunde keine anderen Therapieoptionen mehr hatten (ein Großteil von ihnen war gegen die letzte Therapie refraktär gewesen), sich als bemerkenswert aktiv und gut verträglich erwiesen hatte [23, 24]. Saad Usmani, Charlotte, stellte in Orlando eine kombinierte Analyse der Ergebnisse von insgesamt 148 Patienten aus diesen beiden Studien vor, die mit der 16 mg/kg-Dosierung von Daratumumab behandelt worden waren [25]:
Nach median 14,8 Monaten Follow-up war eine Ansprechrate von 31% zu sehen, und 83% der Patienten erzielten mindestens eine Krankheitsstabilisie-rung – für eine Kohorte mit so stark fortgeschrittener und vortherapierter Erkrankung ein bemerkenswertes Ergebnis. Nach einem Jahr waren noch 69% der Patienten am Leben, die mediane Überlebenszeit derer, die angesprochen hatten, lag bei 19,9 Monaten. Das Ansprechen war unabhängig von Alter, ISS-Stadium, Zahl der vorangegangenen Therapien und der Tatsache, ob die Patienten refraktär gewesen waren oder nicht.
Auch in Kombination mit Lenalidomid und Dexamethason hat Daratumumab vielversprechende Aktivität gezeigt, wie bereits beim letzten ASH-Kongress berichtet wurde [26]. Torben Plesner, Vejle, Dänemark, präsentierte in Orlando ein Update der Phase-II-Daten zum 12-Monats-Zeitpunkt: Von den 32 vorbehandelten Patienten mit median zwei Vortherapien erzielten acht (25%) eine stringente Komplettremission, drei weitere (9%) eine normale Komplett- und neun (28%) eine sehr gute partielle Remission. Die mediane Dauer des Ansprechens ist noch nicht erreicht, so Plesner. An Nebenwirkungen sind vor allem die bei einer Antikörper-Therapie zu erwartenden Infusionsreaktionen erwähnenswert, die bei etwas mehr als der Hälfte der Patienten auftraten, im Allgemeinen leicht waren, lediglich bei der ersten Infusion beobachtet wurden und mittels Prämedikation oder Verlangsamung der Infusionsgeschwindigkeit gut kontrolliert werden konnten.
Noch stärker vorbehandelt waren die Patienten in einer Phase-Ib-Studie (median 3,5 Vortherapien, darunter mindestens zwei Zyklen mit Lenalidomid und Bortezomib, refraktär gegen die letzte Therapielinie), in der Daratumumab mit Pomalidomid und Dexamethason kombiniert wurde [27]. Bei geringer zusätzlicher Toxizität (abgesehen von Infusionsreaktionen) lag die Gesamtansprechrate der 77 Patienten bei 58,5% (drei stringente, eine normale Komplettremission, zwölf sehr gute partielle und 15 partielle Remissionen sowie zwei minimale Remissionen und 18 Krankheitsstabilisierungen). Die Remissionen traten unter der Therapie sehr schnell auf, und viele verstärkten sich im Lauf der Zeit. Die doppelt refraktären Patienten (gegen Lenalidomid und Bortezomib) sprachen mit 57,5% genauso gut an wie die Gesamtpopulation.
… gegen SLAMF7 mit dualem Wirkmechanismus
Der zweite monoklonale Antikörper, der sich in einem weit fortgeschrittenen Entwicklungsstadium beim multiplen Myelom befindet, ist Elotuzumab. Er richtet sich gegen das „Signaling Lymphocytic Activation Molecule F7“ (SLAMF7) und hat einen dualen Wirkmechanismus: SLAMF7 findet sich sowohl auf Myelomzellen, die der Antikörper deshalb für das Immunsystem markiert, als auch auf natürlichen Killerzellen, die durch die Bindung des Immunglobulins aktiviert werden und eine Antikörper-abhängige Zell-vermittelte Zytotoxizität entwickeln. In der zulassungsrelevanten Phase-III-Studie ELOQUENT-2 war Elotuzumab mit Lenalidomid und Dexamethason kombiniert und bei Patienten mit rezidiviertem oder refraktärem Myelom randomisiert mit der Zweierkombination Rd verglichen worden. In der 2-Jahres-Auswertung hatte Elotuzumab das Ansprechen und das progressionsfreie Überleben signifikant verbessert [20], In Orlando konnte Meletios Dimopoulos, Athen, die 3-Jahres-Daten vorstellen [28]:
Von den insgesamt 646 Patienten wiesen 32% eine Deletion 17p und weitere 10% eine Translokation t(4;14) auf. Sie hatten im Median zwei Vortherapien erhalten, und 35% von ihnen waren gegen die letzte Behandlung refraktär gewesen. Die Auswertung zeigte, dass der Vorteil beim progressionsfreien Überleben, der sich bei der ersten Analyse in einer Hazard Ratio von 0,70 (p = 0,0004) geäußert hatte, im Wesentlichen noch nach drei Jahren bestand (HR 0,73; p = 0,0014). Beim Gesamtüberleben zeigte sich ein deutlicher Trend zu einer Verbesserung durch Elotuzumab (HR 0,77), der p-Wert hatte aber mit 0,0257 die vorbestimmte Signifikanzschwelle noch nicht überschritten, so Dimopoulos.
Nebenwirkungen vom Grad 3 oder höher, die bei mehr als 15% der Patienten auftraten, waren Lymphopenie (78% im Elotuzumab-, 49% im Kontrollarm), Neutropenie (35% vs. 44%), Anämie (20% vs. 21%) und Thrombozytopenie (21% vs. 20%). Infusionsreaktionen auf den Antikörper waren mit 11% (meist Grad 1–2) selten. Eine lange anhaltende Wirksamkeit bei überwiegend hämatologischen Toxizitäten resultiert für diesen Antikörper also in einem ausgezeichneten Nutzen-Risiko-Profil.
In einer internationalen randomisierten Phase-II-Studie wurde Elotuzumab außerdem mit Bortezomib und Dexamethason kombiniert (EBd) und mit der alleinigen Bortezomib-Dexamethason-Kombination verglichen – ebenfalls bei Patienten mit rezidiviertem oder refraktärem Myelom [29]. Auch hier resultierte die Zugabe des Antikörpers in einer Verlängerung des progressionsfreien Überlebens bei ausgesprochen milder, überwiegend hämatologischer Toxizität.
Literatur
1. Durie B et al. ASH 2015, Abstract #25.
2. Sonneveld P et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma: results of the randomized phase III HOVON-65/ GMMG-HD4 trial. J Clin Oncol 2012; 30: 2946-55.
3. Sonneveld P et al. ASH 2015, Abstract #27.
4. Attal M et al. ASH 2015, Abstract #391.
5. Moreau P et al. ASH 2015, Abstract #395.
6. Avet-Loiseau H et al. ASH 2015, Abstract #191.
7. Moreau P et al. ASH 2015, Abstract #393.
8. Moreau P et al. ASH 2015, Abstract #727.
9. Dimopoulos MA et al. ASH 2015, Abstract #26.
10. Dimopoulos MA et al. J Clin Oncol 2015; 33 (15S): 452s (ASCO 2015, Abstract #8509).
11. Chng WJ et al. ASH 2015, Abstract #30.
12. Moreau P et al. ASH 2015, Abstract #729.
13. Stewart et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372: 142-52.
14. Avet-Loiseau H et al. ASH 2015, Abstract #731.
15. Berenson J et al. ASH 2015, Abstract #373.
16. ClinicalTrials.gov NCT02412878.
17. Ramasamy K et al. ASH 2015, Abstract #374.
18. Benboubker L et al. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med 2014; 371: 906-17.
19. Avet-Loiseau H et al. ASH 2015, Abstract #730.
20. Lonial S et al. Elotuzumab Therapy for Relapsed or Refractory Multiple Myeloma. N Engl J Med 2015.
21. San Miguel JF et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: A multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014; 15: 1195-206.
22. Shah JJ et al. ASH 2015, Abstract #187.
23. Lokhorst HM et al. J Clin Oncol 2014; 32 (15S): (ASCO 2014, Abstract #8513).
24. Lonial S et al. J Clin Oncol 2015; 33 (15S): (ASCO 2014, Abstract #LBA8512).
25. Usmani S et al. ASH 2015, Abstract #29.
26. Plesner T et al. ASH 2014; Abstract #84.
27. Chari A et al. ASH 2015, Abstract #508.
28. Dimopoulos MA et al. ASH 2015, Abstract #28.
29. Palumbo A et al. ASH 2015, Abstract #510.

Prof. Dr. med. Hartmut Goldschmidt
Sektion Multiples Myelom der Medizinischen Klinik V, Universitätsklinikum Heidelberg, und des Nationalen Centrums für Tumorerkrankungen (NCT) Heidelberg,
Im Neuenheimer Feld 410
69120 Heidelberg
+49 6221 56 8003
E-Mail schreiben