Artikel als PDF downloaden.
Chronische lymphatische Leukämie – neue Kombinationen und neue Substanzen
ASH 2015
Die Chronische lymphatische Leukämie (CLL) war 2015 ein Schwerpunkt der Jahrestagung der American Society of Hematology (ASH) in Orlando, Florida, mit einer Reihe von Präsentationen, die geeignet sind, in der nächsten Zeit die Therapiestandards bei dieser Erkrankung zu verändern. Die Deutsche CLL-Studiengruppe (GCLLSG) war im Programm mit zahlreichen Beiträgen wieder prominent vertreten.
In der Behandlung der CLL hat sich schon in den vergangenen Jahren eine Menge geändert, nicht zuletzt durch die Aktivitäten der GCLLSG. So wurde vor etwa zwei Jahren aufgrund der Ergebnisse unserer CLL11-Studie der neue CD20-Antikörper Obinutuzumab in Kombination mit Chlorambucil zur Therapie der weniger fitten CLL-Patienten mit neu diagnostizierter Erkrankung und Komorbiditäten zugelassen [1, 2]. In Orlando konnte Valentin Goede, Köln, das neueste Update dazu präsentieren [3], in dem sich zeigte, dass der signifikante Vorteil beim progressionsfreien Überleben, der Zeit bis zur nächsten Therapie und beim Gesamtüberleben für den Vergleich von Obinutuzumab-Chlorambucil gegenüber der Chlorambucil-Monotherapie nach median dreieinhalb Jahren weiter bestehen bleibt. Beim Vergleich mit Rituximab-Chlorambucil war Obinutuzumab-Chlorambucil weiterhin bezüglich progressionsfreiem Überleben und Zeit bis zur nächsten anti-leukämischen Therapie signifikant überlegen – beim letzteren Parameter zeigt der neue Antikörper eine bemerkenswerte Wirksamkeit mit einer medianen Dauer von 51,1 Monaten gegenüber nur 38,2 Monaten unter Rituximab. Beim Gesamtüberleben bestätigt sich der schon in den früheren Analysen erkennbare Trend zugunsten von Obinutuzumab, der aber – bei einer so indolenten Erkrankung nicht verwunderlich – zu diesem Zeitpunkt noch nicht signifikant ausfiel. In beiden Antikörper-Armen war die mediane Dauer noch bei Weitem nicht erreicht: Lediglich 22% der Patienten im Obinutuzumab- versus 28% derer im Rituximab-Arm waren mittlerweile verstorben.
Bendamustin-Obinutuzumab – mögliche Option in der Erstlinie
In der laufenden, nicht randomisierten europäischen Phase-IIIb-Studie GREEN wird bei mehreren Kohorten von insgesamt etwa 950 Patienten mit unbehandelter oder rezidivierter/refraktärer CLL vor allem die Sicherheit, aber auch die Wirksamkeit einer Behandlung mit Obinutuzumab alleine oder in Kombination mit einer Chemotherapie untersucht. In der Erstlinientherapie der CLL ist der deutschen Leitlinie zufolge [4] die Kombination aus Bendamustin und Rituximab eine Option bei fitten ebenso wie bei weniger fitten Patienten. In einer der Kohorten der GREEN-Studie, die 158 zuvor unbehandelte Patienten umfasst, wurde daher Bendamustin mit Obinutuzumab kombiniert. Gut die Hälfte der Patienten war nicht fit (d. h. sie wiesen einen CIRS-Score von > 6 oder eine Kreatinin-Clearance von < 70 ml/min auf), das mediane Alter lag bei 69 Jahren, so Stephan Stilgenbauer, Ulm, der die Daten in Orlando vorstellte.
Das Sicherheitsprofil entsprach den Erfahrungen aus früheren Studien: An Nebenwirkungen vom Grad 3 oder höher wurden vor allem Neutropenien (50%), Infusionsreaktionen (15,2%), Infektionen (12,7%), Thrombozytopenien (12,7%) und Tumorlyse-Syndrome (10,1%) registriert. Acht von neun Todesfällen wurden mit Nebenwirkungen in Verbindung gebracht, 26 Patienten (16,5%) brachen die Therapie wegen Toxizitäten ab.
Die Wirksamkeit war mit einer Gesamtansprechrate von 78,5% und 32,3% Komplettremissionen – vergleichbar bei fitten und nicht-fitten Patienten – ausgezeichnet. Blutproben von 102 Patienten waren auswertbar für minimale Resterkrankung: Von ihnen waren 93 (91,2%) MRD-negativ; von 64 auswertbaren Knochenmarksbiopsien waren es 45 (70,3%).
Diese Ergebnisse – bei akzeptabler Toxizität – sind vielversprechend, so Stilgenbauer, und lassen Bendamustin und Obinutuzumab als neue mögliche therapeutische Option für fitte und nicht-fitte Patienten mit neu diagnostizierter CLL erscheinen.
Ibrutinib in der Erstlinie – ein neuer Standard?
Das Problem, gut verträgliche neue Therapien für die meist älteren und häufig komorbiden Patienten mit CLL zu finden, wird derzeit in vielfacher Weise angegangen. Ibrutinib, der erste, oral verfügbare Inhibitor der Bruton-Tyrosinkinase (Btk), hemmt eine zentrale Schaltstelle im Signalweg des B-Zell-Rezeptors. Es ist bislang für Patienten mit vorbehandelter CLL oder bei neu diagnostizierter Erkrankung mit einer 17p-Deletion und/oder TP53-Mutation zugelassen – aufgrund der Daten der RESONATE-Studie, in der eine Reduktion des Risikos für Progression oder Tod um 78% und der Mortalität um 57% gefunden worden war [5]. In einer vorangegangenen Phase-Ib/II-Studie wurden auch für Patienten mit neu diagnostizierter CLL vielversprechende Remissionsraten von 84% und eine Überlebensrate von fast 100% nach 30 Monaten gefunden [6]. Deshalb hat man die Substanz anschließend für diese Indikation ebenfalls in einer großen, global durchgeführten Phase-III-Studie, der RESONATE-2-Studie, bei 269 Therapie-naiven Patienten im Alter von über 65 Jahren, die nicht für eine Fludarabin-haltige Therapie geeignet waren, in Monotherapie gegen Chlorambucil getestet. Die Patienten erhielten randomisiert entweder bis zu zwölf vierwöchige Zyklen Chlorambucil (0,5 mg/kg an den Tagen 1 und 15) oder 420 mg/d Ibrutinib bis zur Progression oder bis zum Auftreten von inakzeptabler Toxizität. Die ersten Ergebnisse stellte Alessandra Tedeschi, Mailand, beim Kongress in Orlando vor [7]:
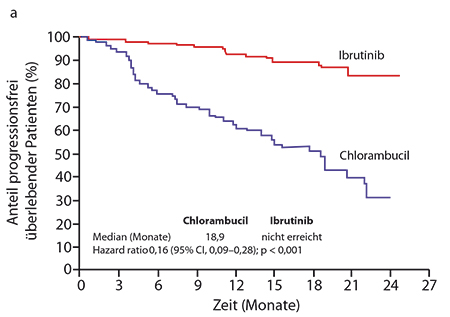
Primärer Endpunkt war das progressionsfreie Überleben, und hier war der Medianwert im Ibrutinib-Arm noch nicht erreicht, im Chlorambucil-Arm lag er bei 18,9 Monaten; zum 18-Monats-Zeitpunkt waren 90% versus 52% der Patienten progressionsfrei am Leben (Hazard Ratio 0,16; p < 0,0001; Abb. 1a). Auch Hochrisiko-Patienten profitierten von der Ibrutinib-Therapie: Für Patienten mit Deletion 11q und für solche mit unmutiertem IGHV-Status lag die mediane progressionsfreie Überlebenszeit unter Chlorambucil jeweils bei nur neun Monaten, unter dem Btk-Inhibitor war sie noch nicht erreicht; die Hazard Ratios waren mit 0,02 (del(11q); p < 0,0001) bzw. 0,06 (IGHV unmutiert; p < 0,0001) außerordentlich; das Risiko war damit in beiden Fällen um mehr als 90% reduziert worden. Im Ibrutinib-Arm lag die progressionsfreie Überlebensrate nach 18 Monaten bei den Patienten mit unmutiertem IGHV-Status mit 95% ebenso hoch wie bei denen mit mutierten Ig-Genen, d. h. der Mutationsstatus scheint hier keine negative prognostische Bedeutung mehr zu haben.
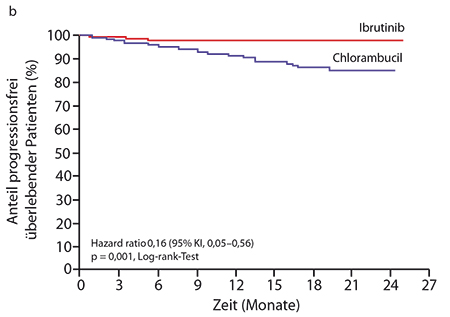
Trotz des relativ indolenten Charakters der CLL war Ibrutinib auch beim Gesamtüberleben bereits hochsignifikant überlegen: Die Medianwerte der Überlebenszeit waren in beiden Gruppen noch nicht erreicht, aber nach zwei Jahren unterschieden sie sich mit 98% (Ibrutinib) versus 84% (Chlorambucil) bereits beträchtlich (HR 0,16; p = 0,001; Abb. 1b). 86% der Patienten sprachen auf Ibrutinib an (4% mit einer Komplettremission), auf Chlorambucil nur 35% (2% komplett). Auch hämatologisch zeigte sich mit dem Btk-Inhibitor häufiger eine anhaltende Verbesserung sowohl des Hb-Wertes bei den Patienten mit einer Anämie (84% vs. 45%; p < 0,0001) als auch der Thrombozytenzahlen bei denen mit Thrombozytopenie ab (77% vs. 43%; p = 0,0054). Nur 40% der Patienten im Kontrollarm beendeten die vorgesehene Maximalzahl von zwölf Zyklen, während 87% derer im Ibrutinib-Arm die Behandlung auch nach Studienende noch fortsetzten.
Die Verträglichkeit von Ibrutinib war gut, die häufigsten Nebenwirkungen, die bei mehr als 20% der Patienten beobachtet wurden, waren Diarrhö, Fatigue, Husten und Nausea. Innerhalb von etwa eineinhalb Jahren traten unter Ibrutinib bei sechs Patienten Blutungen auf (einmal Grad 2, viermal Grad 3 und einmal Grad 4); drei dieser sechs Patienten waren mit niedermolekularem Heparin, Azetylsalizylsäure oder Vitamin E behandelt worden, und bei dreien führten die Blutungskomplikationen zu einem Therapieabbruch. 87% der Patienten nahmen den Btk-Inhibitor noch am Ende des Studienzeitraums ein.
Fazit aus dieser Meilenstein-Studie, die zeitgleich zum Kongress auch publiziert wurde [8]: In dieser Population älterer, therapienaiver Patienten mit CLL, die vielfach an Komorbiditäten litten, war die Verträglichkeit von Ibrutinib so gut, dass die überwiegende Mehrzahl von ihnen das Medikament über das Studienende hinaus einnehmen konnte. Neben höheren Ansprechraten konnte der Btk-Inhibitor im Vergleich zur konventionellen Chemotherapie mit Chlorambucil progressionsfreies und Gesamtüberleben hochsignifikant verlängern, sodass damit – eine entsprechende Zulassungserweiterung vorausgesetzt – ein neuer Standard für diese Indikation existieren dürfte.
Blutungen treten bei bis zur Hälfte der Patienten unter der Therapie mit Ibrutinib auf. Sie sind in aller Regel nicht dramatisch, aber in einzelnen Fällen können auch Ereignisse vom Grad 3 oder höher vorkommen. Der Grund dafür: Bruton-Tyrosinkinase, die durch Ibrutinib gehemmt wird, findet sich auch in Thrombozyten, und deren Funktion wird durch den Btk-Inhibitor beeinträchtigt. Die Wiener Arbeitsgruppe um Ulrich Jäger fand in einer kleinen Studie an 24 Patienten, die über siebeneinhalb Monate mit Ibrutinib behandelt wurden, eine Korrelation mit der Ibrutinib-Dosis ebenso wie mit der von Willebrand-Faktor- und der Kollagen-abhängigen Thrombozyten-Funktion [9]. Die Funktion war bei Patienten, die höhergradige Blutungen erlitten, stärker gehemmt. Diese Befunde suggerieren, dass ein Monitoring der Plättchenfunktion unter der Therapie sinnvoll sein könnte, insbesondere bei Patienten, die von Haus aus eine erhöhte Blutungsneigung aufweisen, unter einer Antikoagulationstherapie stehen oder bei denen ein invasiver Eingriff geplant ist.
Idelalisib plus BR in der Rezidiv-Situation
Eine weitere moderne Therapieoption, die in den B-Zell-Rezeptor-Signalweg eingreift und bisher in Kombination mit Rituximab zur Behandlung der rezidivierten oder refraktären CLL bzw. von therapienaiven Patienten mit Deletion 17p oder TP53-Mutation zugelassen ist, ist Idelalisib, ein Inhibitor des δ-Subtyps der Phosphoinositol-3-Kinase. Eine etablierte Chemoimmuntherapie in dieser Indikation ist auch die Kombination aus Bendamustin und Rituximab (BR), und deshalb wurde in einer doppelblinden Phase-III-Studie die Zugabe von Idelalisib zu diesem Standard bei 416 Patienten mit rezidivierter oder refraktärer CLL getestet [10].
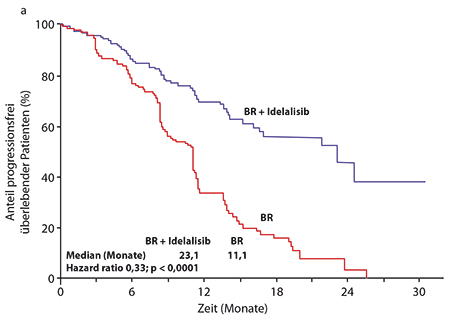
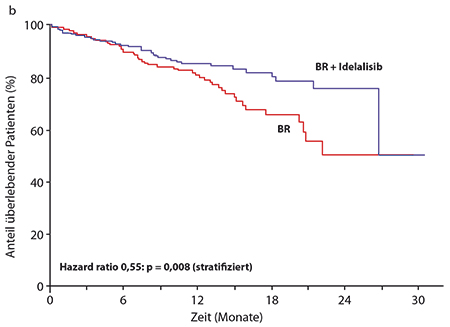
Primärer Endpunkt war auch hier das progressionsfreie Überleben, und die Kombination aus BR und Idelalisib konnte dieses von median 11,1 auf 23,1 Monate mehr als verdoppeln, so Andrew Zelenetz, New York (HR 0,33; p < 0,0001 Abb. 2a). Obwohl die mediane Nachbeobachtungszeit erst bei zwölf Monaten liegt, wurde auch beim Gesamtüberleben – wo die medianen Zeiten in beiden Armen noch nicht erreicht sind – beinahe eine Halbierung des Mortalitätsrisikos erzielt (HR 0,55; p = 0,008 stratifiziert nach 17p-Deletion und/oder TP53-Mutation, IGHV-Mutationsstatus, rezidiviert versus refraktär; Abb. 2b). Die Verbesserungen bei progressionsfreiem und Gesamtüberleben wurden in allen untersuchten Subgruppen gesehen, unabhängig beispielsweise von Hochrisikofaktoren wie bestimmten zytogenetischen Aberrationen. Auch bei der Gesamtansprechrate war Idelalisib mit 68% versus 45% deutlich überlegen; 96% der Patienten im Idelalisib-Arm zeigten außerdem eine mindestens 50%ige Reduktion der Lymphknoten-Durchmesser, im BR-Arm waren es lediglich 61%. Auch die Vergrößerung von Milz und Leber sprach auf den PI3Kδ-Inhibitor häufiger an als auf die alleinige Immunchemotherapie.
Es wurden keine bislang unbekannten Toxizitäten bemerkt. Beachten muss man bei der Therapie mit Idelalisib immer autoimmun-vermittelte Störungen, v. a. Diarrhöen, Pneumonien und Leberschäden. Während Zelenetz die Kombination aus BR und Idelalisib bereits als neue Therapieoption für Patienten mit rezidivierter oder refraktärer CLL sieht, zeigten sich in einer Phase-II-Studie, in der Patienten mit neu diagnostizierter CLL Idelalisib zusammen mit dem CD20-Antikörper Ofatumumab erhielten, bei 16 von 21 Patienten (76%) Toxizitäten vom Grad 3 oder höher, am häufigsten Erhöhungen von Leberenzymen, Enterokolitiden und Pneumonitiden [11]. Das verzögerte Auftreten der Störungen, das Vorliegen von Immunzell-Infiltraten in betroffenen Geweben und das Ansprechen auf Immunsuppressiva sprechen stark für eine immunologisch vermittelte Genese, so Benjamin Lampson, Boston. Offenbar liegt eine Störung regulatorischer T-Lymphozyten vor, die möglicherweise durch die PI3Kδ-Blockade gehemmt werden. Warum diese Komplikationen in der Erstlinie so viel häufiger auftreten als in fortgeschritteneren Situationen, ist bislang unklar. Man kann aber spekulieren, dass paradoxerweise die noch gute T-Zell-Immunität, einschließlich der regulatorischen T-Zellen, den Erstlinien-Patienten gewissermaßen zum Verhängnis wird, da sie eine autoimmune Reaktion unter Idelalisib offensichtlich stark begünstigt.
Bcl-2-Inhibition bei Höchstrisiko-Patienten hochwirksam
Ein weiterer sehr neuer Therapieansatz, der momentan überwiegend bei hämatologischen Erkrankungen erprobt wird, auch wenn er für die gesamte Onkologie sehr vielversprechend sein dürfte, ist die Blockade anti-apoptotischer Mechanismen. Im Fokus steht dabei das Protein Bcl-2, das in der Mitochondrien-Membran lokalisiert ist, dort für die Stabilisierung des Membranpotenzials sorgt und dadurch den intrinsischen Mechanismus der Apoptose-Einleitung blockiert. Die Hemmung von Bcl-2 durch orale Inhibitoren wie Venetoclax (ABT199) setzt diese Blockade außer Kraft und führt so zum Tod von Tumorzellen. Venetoclax hatte in einer Phase-I-Studie bei Patienten mit rezidivierter oder refraktärer CLL – die meisten davon mit klinischen oder genetischen Hochrisikofaktoren – zu hohen Ansprechraten geführt und war nach Einführung eines Dosiseskalations-Regimes auch recht gut verträglich gewesen [12].
Weil dieser Mechanismus der Apoptose-Einleitung unabhängig vom p53-Mutationsstatus funktioniert, hatte eine internationale einarmige Phase-II-Studie, die unter Beteiligung von fünf deutschen Zentren sehr schnell rekrutierte, ausschließlich Höchstrisiko-Patienten mit rezidivierter oder refraktärer Erkrankung und einer 17p-Deletion eingeschlossen [13]. Die Mutation war mittels FISH-Untersuchung bestätigt worden, und die Patienten erhielten einmal täglich Venetoclax, das über fünf Wochen von anfänglich 20 mg/d über 50, 100 und 200 auf 400 mg/d aufdosiert wurde, um das Risiko eines Tumorlyse-Syndroms zu minimieren. Diese Dosierung wurde dann bis zum Eintreten einer Progression oder von intolerabler Toxizität beibehalten.
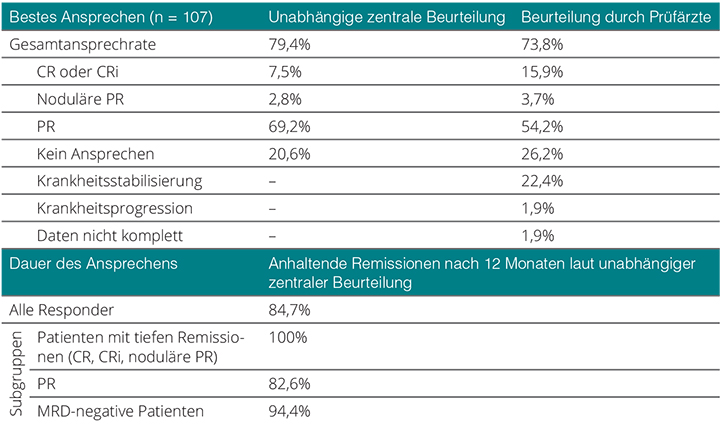
Primärer Endpunkt war die Gesamtansprechrate, und sie lag in der zentralen Auswertung nach median einem Jahr Nachbeobachtungszeit bei 79,4% mit 7,5% kompletten und 2,8% nodulären partiellen Remissionen (Tab. 1). Von den übrigen Patienten mit partieller oder keiner Remission waren immerhin bei 15,9% im Knochenmark keine morphologischen Hinweise auf eine residuelle CLL zu erkennen. Von 45 Patienten, die auf minimale Resterkrankung (MRD) getestet wurden (mittels Durchflusszytometrie mit einer Sensitivität von < 10–4), zeigten 18 (40%) keinen Hinweis auf eine MRD im peripheren Blut (das waren 17% der Gesamtkohorte und 21% der Responder). Knochenmark wurde lediglich bei zehn Patienten getestet, und hiervon waren sechs MRD-negativ.
Die Remissionen stellten sich außerordentlich rasch ein: Die mediane Zeit bis zu einem ersten Ansprechen lag bei nur 0,8 Monaten, eine Komplettremission wurde nach median 8,2 Monaten erreicht. Nach einem Jahr waren von sämtlichen Respondern noch 84,7% in Remission, Komplettremissionen wurden zu 100% gehalten und eine MRD-Negativität von 94,4% der Patienten (Tab. 1). Bei den Überlebensdaten sind die Medianwerte noch lange nicht erreicht; nach einem Jahr waren 72% der Patienten progressionsfrei und 86,7% insgesamt am Leben.
Die Verträglichkeit von Venetoclax war angesichts des Schweregrades der Erkrankung dieser Patienten gut: Schwere Nebenwirkungen traten bei 55% der Patienten auf (v. a. Fieber 7%, autoimmun-hämolytische Anämie 7%, Pneumonie 6%, febrile Neutropenie 6%) und waren durchweg gut behandelbar. Bei fünf Patienten wurden Laborzeichen für ein Tumorlyse-Syndrom beobachtet, was in zwei Fällen zu einer Unterbrechung der Behandlung für einen Tag, aber in keinem Fall zu einer klinischen Manifestation führte.
Für diese Ultra-Hochrisiko-Gruppe von CLL-Patienten sind die Ergebnisse dieser Therapie herausragend: Hohe Remissionsraten mit vor allem auch sehr tiefen Remissionen (Komplettremissionen bei mehr als 10% und eine MRD-Negativität bei mehr als 20% der Responder) sind mehr als man bisher bei dieser Art von Patienten erreichen konnte – und alles bei einer insgesamt recht akzeptablen Toxizität. Die deutsche CLL-Leitlinie sieht für diese Patienten bisher Ibrutinib oder Idelalisib in Kombination mit Rituximab vor [4]; eine Zulassung vorausgesetzt, dürfte der Bcl-2-Inhibitor diese Liste in Kürze ergänzen.
Venetoclax mit Immunchemotherapie kombinieren?
In einer weiteren Phase-Ib-Studie testen wir derzeit die Kombination von Venetoclax mit der BR-Standardtherapie bei Patienten in allen Therapielinien [14]. Die Anwendung scheint sicher zu sein, wie Gilles Salles, Pierre-Benite, berichten konnte: Egal ob man die Behandlung mit BR oder mit Venetoclax (im beschriebenen Eskalations-Regime) beginnt, kommt es auch unter der Maximaldosis von 400 mg/d Venetoclax zu keinen dosislimitierenden Toxizitäten und auch zu keinen Tumorlyse-Syndromen, obwohl ein Großteil der Patienten ein mittleres oder hohes Risiko dafür aufgewiesen hatte. Die Wirksamkeitsdaten sind bei bislang nur 38 auswertbaren Patienten (25 rezidiviert/refraktär, 13 Erstlinie) vorläufig, wie Salles betonte, aber eine Gesamtansprechrate von 87% mit 18% Komplettremissionen und eine MRD-Negativität im peripheren Blut bei 55% der Responder lässt für dieses Regime einiges erhoffen. In einer weiteren Kohorte soll in der Immunchemotherapie-Komponente dieses Regimes statt Rituximab Obinutuzumab eingesetzt werden.
Kombinationen ohne Chemotherapie
Amerikanische Kollegen gehen einen etwas anderen Weg und ersetzten in einer Phase-Ib-Studie bei Patienten mit rezidivierter/refraktärer CLL in der BR-Immunchemotherapie das Bendamustin durch Venetoclax, während Rituximab zu Beginn der Therapie in sechs monatlichen Dosen (einmal 375 mg/m2, fünfmal 500 mg/m2) gegeben wurde [15]. Die Ansprechrate war mit 86% (davon 47% Komplettremissionen mit oder ohne vollständige Knochenmarkserholung) bemerkenswert, so Shuo Ma, Chicago. 55% der Responder waren im Knochenmark MRD-negativ und konnten diesen Status durchweg halten. Interessant sind die Daten von elf Patienten, die die Behandlung mit Venetoclax beendeten, nachdem sie eine Komplettremission oder MRD-Negativität erreicht hatten: Die beiden, die noch MRD-positiv getestet worden waren, wurden wieder progredient, und nur einer davon erreichte nach drei Monaten unter Venetoclax wieder eine partielle Remission. Von den übrigen Patienten, die MRD-negativ waren, zeigt bislang keiner nach Ende der Therapie einen Progress.
Die häufigste Nebenwirkung vom Grad 3 oder 4 war mit 53% eine Neutropenie. Die Kombination Venetoclax-Rituximab soll nun in einer Phase-III-Studie randomisiert mit dem Bendamustin-Rituximab-Protokoll verglichen werden. Ähnliche Ergebnisse präsentierten US-amerikanische Kollegen für eine Kombination aus Venetoclax und Obinutuzumab bei rezidivierten/refraktären ebenso wie therapienaiven Patienten mit CLL. Die Behandlung war (mit entsprechenden Vorsichtsmaßnahmen bei Patienten, die ein Risiko für ein Tumorlyse-Syndrom aufwiesen) sicher und wirksam und wird derzeit ebenfalls in einer Phase-III-Studie weiter untersucht [16].
CLL14: Vergleich Obinutuzumab-Venetoclax mit aktuellem Standard
Einen ähnlichen Weg gehen wir in der Deutschen CLL-Studiengruppe, auch wenn wir konzeptionell aus einer etwas anderen Richtung kommen: Wir wollen in der CLL14-Studie in Kooperation mit internationalen Kollegen einerseits auf den Ergebnissen unserer CLL11-Studie aufbauen, in der wir die Überlegenheit der Kombination Obinutuzumab-Chlorambucil über Rituximab-Chlorambucil ebenso wie über eine Chlorambucil-Monotherapie gezeigt haben. Andererseits nehmen wir die guten Ergebnisse aus Studien mit einer Venetoclax-Monotherapie zum Anlass, die Chemotherapie-Komponente durch den Bcl-2-Inhibitor zu ersetzen. In einer Sicherheits-Run-in-Phase zu dieser Studie haben wir bisher 13 Patienten mit zuvor unbehandelter CLL und Komorbiditäten (wie in der CLL11-Studie) mit dem neuen Regime behandelt [17]. Dabei erhielten sie zunächst einen Zyklus Obinutuzumab (zweimal im Abstand von zwei Wochen), und anschließend wurde mit der Aufdosierung von Venetoclax über sechs Wochen begonnen. Nach sechs Zyklen Obinutuzumab (mit Venetoclax in den letzten fünf Zyklen) bekamen die Patienten zusätzlich sechs vierwöchige Zyklen Venetoclax. Die Behandlung erschien gut verträglich, wie Kirsten Fischer, Köln, in Orlando berichtete, und deshalb wurde im August 2015 die randomisierte Phase dieser Studie eröffnet, in der gemäß der Philosophie unserer Studiengruppe Obinutuzumab-Venetoclax mit dem aktuellen Standard bei älteren, komorbiden Patienten mit neu diagnostizierter CLL, Obinutuzumab und Chlorambucil, verglichen wird [18].
Literatur
1. Goede V et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014.
2. Goede V et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study. Leukemia 2015; 29: 1602-4.
3. Goede V et al. ASH 2015, Abstract #1733.
4. Wendtner CM et al. Chronische Lymphatische Leukämie (CLL): www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@view/html/index.html.
5. Byrd JC et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371: 213-23.
6. Byrd JC et al. Three-year follow-up of treatment-na¨ıve and previously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood 2015; 125: 2497-506.
7. Tedeschi A et al. ASH 2015, Abstract #495.
8. Burger J et al. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015; 373: 2425-37.
9. Kazianka L et al. ASH 2015, Abstract #718.
10. Zelenetz AD et al. ASH 2015, Abstract #LBA-5.
11. Lampson BL et al. ASH 2015, Abstract #497.
12. Roberts AW et al. Targeting BCL2 with Venetoclax in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med 2015, Dec 6 [Epub ahead of print, DOI 10.1056/NEJMoa1513257].
13. Stilgenbauer S et al. ASH 2015, Abstract #LBA-6.
14. Salles G et al. ASH 2015, Abstract #829.
15. Ma S et al. ASH 2015, Abstract #830.
16. Flinn IW et al. ASH 2015, Abstract #494.
17. Fischer K et al. ASH 2015, Abstract #496.
18. clinicaltrials.gov/ct2/show/NCT02242942.

Prof. Dr. med. Clemens-Martin Wendtner
Wissenschaftlicher Sekretär der DCLLSG
Klinik für Hämatologie, Onkologie,
Immunologie, Palliativmedizin, Infektiologie und Tropenmedizin, Klinikum Schwabing Akad. Lehrkrankenhaus der Univ. München
Kölner Platz 1, 80804 München
+49 89 3068 2228
+49 89 3068 3912
E-Mail schreiben