Artikel als PDF downloaden.
Akute lymphatische und myeloische Leukämie
ASH 2015
Die akuten Leukämien zählen vor allem bei den erwachsenen Patienten nach wie vor zu den Gebieten der Hämatologie, in denen dringend nach wirksameren oder zum Teil auch nur besser verträglichen Therapien gesucht wird. Beim ASH-Kongress in Orlando wurde dazu eine Reihe interessanter Ergebnisse präsentiert; insbesondere scheint die molekulare Forschung an pathogenetischen Mechanismen auch hier langsam Früchte zu tragen in Form von niedermolekularen Medikamenten ebenso wie Antikörpern, die sich gegen bestimmte Schwachstellen in der Zellbiologie der Leukämiezellen richten.
Akute lymphatische Leukämie
Rituximab: auch bei der ALL ein Gewinn
Eine feste Größe in der Lymphomtherapie sind seit Langem CD20-Antikörper wie Rituximab, und auch ein Teil der Patienten mit akuten lymphatischen Leukämien (ALL) vom reifen B-Zell-Typ werden künftig davon profitieren: Weil das CD20-Antigen bei bis zur Hälfte der B-Precursor-ALL-Erkrankungen von Erwachsenen exprimiert wird, wurde Rituximab in einigen kleineren, einarmigen Studien bei solchen Patienten mit einigem Erfolg eingesetzt. Eine Gruppe von französischen und Schweizer Kollegen hat dieses Konzept nun in der großen randomisierten GRAALL-R 2005-Studie mit 220 adulten Patienten mit B-Precursor-ALL überprüft, bei denen mindestens 20% der Blasten CD20 exprimierten, die aber Philadelphia-Chromosom-negativ waren und noch keine Transplantation erhalten hatten. Sie erhielten eine Standard-Chemotherapie und die Hälfte von ihnen randomisiert zusätzlich 16 bis 18 intravenöse Infusionen mit Rituximab in der auch bei Lymphomen gebräuchlichen Dosierung von 375 mg/m2. Patienten mit wenigstens einem Hochrisiko-Kriterium wurde eine allogene Stammzelltransplantation in der ersten kompletten Remission angeboten. Primärer Endpunkt der Studie war das ereignisfreie Überleben.
In der modifizierten Intention-to-treat-Analyse, die Sébastien Maury, Créteil, bei der Plenarsitzung des ASH-Kongresses vorstellen konnte [1], waren 209 Patienten auswertbar, deren medianes Alter bei 40 Jahren lag und von denen 87% einen ECOG-Performancestatus von 0 oder 1 aufgewiesen hatten. Zwei Drittel hatten Hochrisiko-Kriterien, und der Anteil an CD20-positiven Blasten lag bei median 66%.
Nach der ersten Induktion waren im Rituximab-Arm 91%, im Kontrollarm 88% der Patienten in einer kompletten Remission, ein zweiter Induktionszyklus erhöhte die Anteile geringfügig auf 92% vs. 90%. Bezüglich einer minimalen Resterkrankung (MRD) negativ waren nach der Induktion 65% der Patienten im Rituximab- und 61% im Kontrollarm, nach drei Blöcken einer Konsolidierungstherapie waren es 91% vs. 82%. Signifikant höher war in der Rituximab-Gruppe der Anteil der Patienten, die eine allogene Transplantation in der ersten Komplettremission erhalten konnten (34% vs. 20%; p = 0,029), und umgekehrt war bei ihnen nach median 30 Monaten Follow-up die kumulative Rezidivrate nach zwei Jahren signifikant niedriger mit 18% vs. 30,5%
(p = 0,02); bezüglich der nicht rezidivbedingten Mortalität unterschieden sich die Arme hingegen nicht (beide 12% nach zwei Jahren).
Der Unterschied bei der Rezidivrate resultierte schließlich in einem signifikant längeren ereignisfreien Überleben: nach zwei Jahren im Rituximab-Arm 65%, im Kontrollarm nur 52%; die Hazard Ratio betrug hierfür 0,66, d. h. das Risiko war durch den Antikörper um 34% reduziert worden (p = 0,038; Abb. 1); beim Gesamtüberleben war der Unterschied mit 71% vs. 64% nicht signifikant (HR 0,70; p = 0,095). Bei statistischer Berücksichtigung der allogenen Transplantation als zeitabhängiger Kovariablen und Zensorierung der transplantierten Patienten zum Zeitpunkt der Transplantation besserte sich das Ergebnis für das ereignisfreie Überleben etwas (66% vs. 53% nach zwei Jahren; HR 0,59; p = 0,021), für das Gesamtüberleben wurde der Unterschied signifikant (74% versus 63%; HR 0,55; p = 0,018).
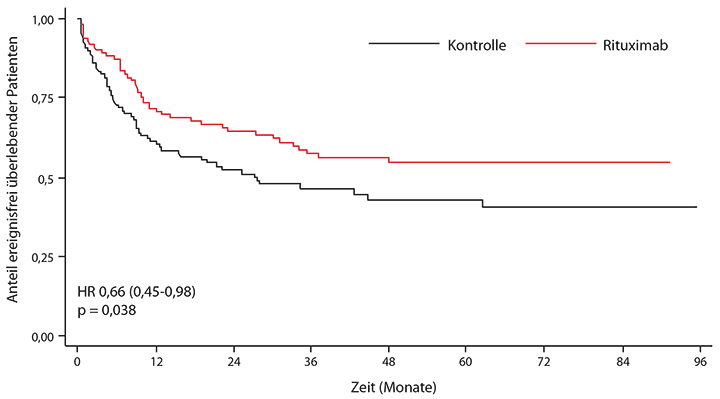
Die Verträglichkeit von Rituximab war gut: Eine Differenz von 71 infektionsbedingten schweren Nebenwirkungen gegenüber 55 im Kontrollarm fiel nicht signifikant aus.
Der CD20-Antikörper kann also bei Patienten mit CD20-positiver, Ph-negativer B-Precursor-ALL das Rezidivrisiko und bei den Patienten, die in der ersten Komplettremission nicht allogen transplantiert werden können, auch das Gesamtüberleben signifikant verlängern – und das bei guter Verträglichkeit. Die Zugabe von Rituximab in dieser Situation sollte Maury zufolge daher künftig die Standard-Chemotherapie ergänzen; allerdings seien weitere Untersuchungen nötig, um Gewissheit über die optimale Dosierung des Antikörpers zu erlangen.
Immuntoxin bei älteren Patienten vielversprechend
Ältere Patienten mit ALL schneiden bei der Therapie generell schlechter ab als jüngere, in erster Linie weil sie die intensiven Therapieregimes nicht so gut vertragen. Ein Ausweg könnte die Anwendung weniger intensiver Chemotherapien sein, die dann durch zielgerichtete, nicht myelosuppressive Behandlungsansätze ergänzt werden. Eine mögliche Option sind hier Antikörper wie Inotuzumab, der mit extrem hoher Affinität an das auf den Blasten fast aller ALL-Patienten exprimierte CD22-Antigen bindet und in Verbindung mit dem hochaktiven Zytostatikum Calicheamicin als Immuntoxin unter der Bezeichnung Inotuzumab Ozogamicin eingesetzt wird. Nach Bindung des Antikörpers an das Antigen wird der Komplex in die leukämische Zelle aufgenommen und das Toxin abgespalten, das dann die Apoptose auslöst.
Inotuzumab Ozogamicin als Monosubstanz hat zum Beispiel in einer Phase-III-Studie, an der auch deutsche Zentren beteiligt waren, bei Patienten mit rezidivierter oder refraktärer ALL als Salvagetherapie zu einer Ansprechrate von 81% (gegenüber 33% unter Standardtherapie) geführt [2] – Grund genug für die Kollegen vom M. D. Anderson Cancer Center in Houston, es bei älteren Patienten
(≥ 60 Jahre) in ein Erstlinientherapie-Konzept mit einer Chemotherapie reduzierter Intensität einzubauen [3]:
Die 38 Patienten erhielten das Immuntoxin in Kombination mit einem Mini-Hyper-CVD-Regime, beim dem gegenüber dem Hyper-CVAD-Protokoll Cyclophosphamid und Dexamethason um 50%, Methotrexat um 75% reduziert und das Anthrazyklin komplett weggelassen worden war. Cytarabin wurde in vier Dosen à 0,5 g/m2 gegeben. Während der ersten vier Zyklen erhielten die Patienten außerdem Rituximab (bei CD20-Positivität), eine intrathekale Chemotherapie und je eine Dosis Inotuzumab Ozogamicin. Dieses wurde bei den ersten sechs Patienten im ersten Zyklus mit 1,3 mg/m2 und in den folgenden drei Zyklen mit 0,8 mg/m2 verabreicht, bei den restlichen Patienten wurden die Dosen auf 1,8 bzw. 1,3 mg/m2 erhöht.
Die Gesamtansprechrate der 35 auswertbaren Patienten, so Elias Jabbour, Houston, betrug 97%, davon 80% komplette Remissionen und 17% Komplettremissionen ohne Erholung der Thrombozyten. Kein Patient war innerhalb von vier Wochen nach Therapie verstorben, alle 19 Patienten mit abnormem Karyotyp erzielten eine komplette zytogenetische Remission; von den auswertbaren Patienten wurden innerhalb von drei Wochen 75%, im weiteren Verlauf alle MRD-negativ. Die mediane Gesamtüberlebenszeit betrug 35 Monate, nach zwei Jahren waren noch 64% der Patienten am Leben – ein sehr vielversprechendes Ergebnis, so Jabbour, wenn man es mit dem einer historischen Kontrollkohorte von 46 Patienten vergleicht, die Hyper-CVAD mit oder ohne Rituximab erhalten hatten (median 16 Monate, 2-Jahres-Überlebensrate 38%; [4].
Die Kombination aus der reduzierten Chemotherapie und dem Immuntoxin scheint also bei diesen schwierig zu behandelnden Patienten ausgesprochen wirksam zu sein und zeigt überdies gute Verträglichkeit, so Jabbour: Vier Patienten erlitten ein sinusoidales Obstruktionssyndrom, das bei geringer Intensität reversibel, bei zwei Patienten jedoch vom Grad 5 war und zum Absetzen des Inotuzumab Ozogamicin zwang. Das Immuntoxin sollte auf jeden Fall bei älteren ALL-Patienten weiter untersucht werden.
Bispezifischer Antikörper: hohe molekulare Remissionsraten
Die minimale Resterkrankung erweist sich auch bei der ALL zunehmend als wichtiger Prognosefaktor: Patienten, bei denen nach einer Induktionstherapie in der Erstlinie noch oder wieder leukämische Zellen nachweisbar sind, haben ein erhöhtes Rezidivrisiko im Vergleich zu denjenigen mit komplettem MRD-Ansprechen (d. h. mit weniger als einem leukämischen pro 10.000 normalen Leukozyten). Verbessern ließ sich ihre Prognose in der Vergangenheit in erster Linie mittels einer allogenen Stammzelltransplantation, aber mittlerweile steht mit dem bispezifischen Antikörper Blinatumomab eine neue, hocheffektive Option zur Verfügung: Er bindet sowohl an das CD19-Antigen auf B-Lymphozyten als auch an das CD3-Antigen auf zytotoxischen T-Lymphozyten und bringt beide in engen Kontakt miteinander, sodass die T-Zelle die leukämische Zelle lysieren kann. In Orlando wurden zwei wichtige Studien dazu vorgestellt:
In einer europäischen Phase-II-Studie unter Führung der Deutschen Multizentrischen ALL-Studiengruppe (GMALL) war Blinatumomab bei 116 erwachsenen Patienten eingesetzt worden, die nach einer Induktionstherapie noch eine minimale Resterkrankung aufgewiesen hatten. Darunter waren Patienten in der Zweitlinientherapie, solche mit sehr hoher MRD-Last und ältere Patienten gewesen. Bereits im ersten Zyklus (15 µg/m2 und Tag in einer kontinuierlichen vierwöchigen Infusion) hatte die Behandlung bei 78% der Patienten zur MRD-Negativität geführt [5], und Nicola Gökbuget, Frankfurt, konnte in Orlando die 18-Monats-Daten präsentieren [6]:
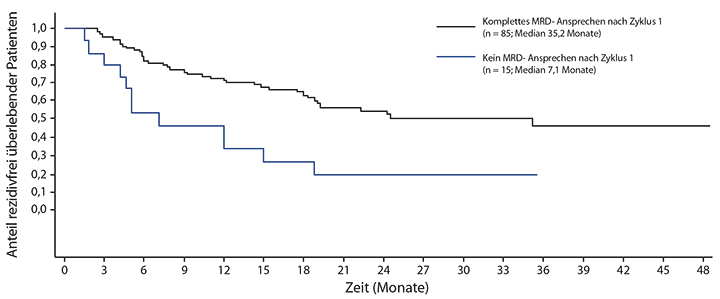
Patienten, die im ersten Zyklus MRD-negativ geworden waren, erhielten drei weitere Zyklen oder eine allogene Stammzelltransplantation; letzteres war bei 78% der Patienten der Fall. Nach einem medianen Follow-up von 29,5 Monaten war die mediane Überlebensdauer bei den 88 Patienten, die in Zyklus 1 MRD-negativ geworden waren, mit 40,4 Monaten hochsignifikant länger als bei den 24 Patienten, die nicht angesprochen hatten (12,0 Monate; p = 0,001). Ähnlich stark war der Unterschied bezüglich des rezidivfreien Überlebens mit median 35,2 vs. 7,1 Monaten (p = 0,002; Abb. 2). Eine allogene Transplantation beeinflusste weder Gesamt- noch rezidivfreies Überleben signifikant, wohl aber die Dauer der Remission (HR 0,36; p = 0,008).
Die am meisten klinisch relevanten Nebenwirkungen waren neurologischer Natur (insgesamt 47%, davon 30% Tremor, 13% Aphasie, 8% Schwindel, je 6% Ataxie und Parästhesien, 5% Enzephalopathie); die Häufigkeit nahm aber mit jedem folgenden Zyklus Blinatumomab ab. Lediglich zwölf Patienten (10%) mussten die Behandlung wegen neurologischer Toxizitäten vom Grad 3 oder höher unterbrechen; fünf konnten sie anschließend ohne Unterbrechung weiterführen, zwei mussten wieder aufgrund ähnlicher Nebenwirkungen abbrechen. Alle vier Patienten, die an Toxizitäten starben, hatten anschließend an die Blinatumomab-Behandlung eine allogene Transplantation erhalten.
Die Ergebnisse dieser ersten großen prospektiven Studie mit einem neuen Therapeutikum bei Patienten mit MRD-positiver ALL zeigt, dass die Strategie der Therapiesteuerung durch die MRD-Ergebnisse vielversprechend ist: Bei MRD-positiven Patienten, die unter Blinatumomab negativ werden, verlängern sich dadurch Gesamt- und rezidivfreies Überleben ebenso wie die Dauer der Remission gegenüber denen, die keine MRD-Negativität erreichen.
Blinatumomab auch bei Ph-positiver ALL wirksam
Die häufigste zytogenetische Anomalie bei der ALL ist das Auftreten eines Philadelphia-Chromosoms, d. h. das Vorliegen einer BCR-ABL-Translokation. Gegen BCR-ABL gerichtete Tyrosinkinaseinhibitoren, die Patienten mit chronischer myeloischer Leukämie heute praktisch eine normale Lebenserwartung verschaffen können, zeigen bei der Ph-positiven ALL zwar eine gewisse Wirksamkeit, haben dort aber nicht vermocht, die ungünstige Prognose wesentlich zu verbessern. In der europäischen Studie ALCANTARA, die Giovanni Martinelli, Bologna, präsentierte [7], wurde Blinatumomab bei 45 Patienten mit Ph-positiver ALL getestet, die gegen Tyrosinkinaseinhibitoren refraktär waren oder sie nicht vertrugen. 44 der 45 Patienten waren resistent auch gegen Inhibitoren der zweiten oder höherer Generationen. So hatte die Hälfte von ihnen bereits Ponatinib erhalten, obwohl nur 22% eine T315I-Mutation im BCR-ABL-Gen aufwiesen.
Primärer Endpunkt der Phase-II-Studie war eine Komplettremission (CR) oder eine Komplettremission mit partieller hämatologischer Erholung (CRh) während der ersten beiden Zyklen, in denen Blinatumomab hier wiederum über vier Wochen mit 9 µg/d im ersten und mit 28 µg/d in bis zu vier weiteren Zyklen gegeben wurde. Unter den sekundären Endpunkten war insbesondere ein MRD-Ansprechen interessant, wobei die Resterkrankung mittels RT-PCR des BCR-ABL-Gens mit einer maximalen Sensitivität von 10-5 bestimmt wurde.
14 der 45 Patienten (36%) erreichten eine CR (zwölf von ihnen im ersten Zyklus), zwei weitere eine CRh. Bei zwölf der 14 Patienten mit CR und bei den beiden mit CRh konnte auch eine komplette molekulare Remission festgestellt werden. Von den zehn Patienten mit T315I-Mutation gingen vier in eine CR oder CRh, und alle vier wurden auch komplett MRD-negativ. Die Hälfte der 16 Responder rezidivierten, drei von ihnen noch während der Therapie; die mediane rezidivfreie Überlebenszeit lag bei 6,7, die mediane Gesamtüberlebenszeit bei 7,1 Monaten.
Grad-3/4-Nebenwirkungen traten bei 82% der Patienten auf, nur drei Patienten beendeten die Behandlung deswegen, aber fünf starben an unerwünschten Ereignissen, von denen eines (ein septischer Schock) als mit der Therapie zusammenhängend eingeschätzt wurde. Drei Patienten erlitten ein Zytokin-Release-Syndrom (Grad 1 oder 2), 21 (47%) neurologische Nebenwirkungen.
Die hier behandelten Patienten, so Martinelli, stellten eine Negativ-Auslese mit extrem schlechter Prognose dar. Dennoch zeigte Blinatumomab als Monosubstanz bei ihnen Wirkung, sodass die weitere Überprüfung bei der Ph-positiven ALL sicherlich sinnvoll ist.
T-Zellen mit chimärem Antigenrezeptor: eine neue Waffe bei ALL
Eine andere sehr vielversprechende neue Option zur Therapie CD19-positiver B-Zell-Neoplasien sind T-Lymphozyten mit chimärem Antigenrezeptor (CAR-T-Zellen). Dabei werden Patienten-eigene T-Zellen mittels eines gentechnischen Konstrukts mit einem Oberflächenrezeptor versehen, der ein Antigen auf den Tumorzellen (in diesem Fall das CD19-Antigen) erkennt und gleichzeitig über spezifische intrazelluläre Signalsequenzen die T-Zelle stimuliert, zu proliferieren und diese malignen Zellen zu vernichten. Die Arbeitsgruppe von Carl June an der University of Pennsylvania war eine der ersten, die dieses Prinzip verwirklichte; eine der ersten Indikationen, bei denen ihre CTL019-Zellen getestet wurden, waren weit fortgeschrittene rezidivierte oder refraktäre ALL-Erkrankungen bei Kindern. In den ersten Studien zeigte sich ein erstaunliches Proliferationspotenzial der Zellen um das bis zu 100.000-Fache und eine lange Verweildauer im Organismus, die zu anhaltenden Komplettremissionen bei stark vorbehandelten erwachsenen und pädiatrischen Patienten führten [8, 9]. In Orlando präsentierte Stephan Grupp, Philadelphia, die Langzeitergebnisse der ersten 59 pädiatrischen Patienten mit rezidivierter bzw. refraktärer ALL, die mit diesen Zellen behandelt worden waren [10].
Es wurden zwischen 1,0 und 17,4 x 106 CTL019-Zellen über ein bis zwei Tage infundiert. Damit erzielten 55 der Patienten (93%) binnen eines Monats eine Komplettremission, darunter auch ein Patient mit CD19-positiver T-ALL, lediglich vier sprachen nicht an. Das Ansprechen war unabhängig von der vorher bestehenden Tumorlast. Sechs der Patienten erhielten anschließend eine allogene Stammzelltransplantation, einer eine Infusion von Donor-Lymphozyten. Der Großteil der Patienten mit klinischer Komplettremission war auch auf Anhieb MRD-negativ (bestimmt mittels Durchflusszytometrie), bei einem Teil der übrigen stellte sich dieser Status innerhalb von drei Monaten ohne jede weitere Therapie ein.
Bei 20 der Patienten mit kompletter Remission nach einem Monat stellte sich später ein Rezidiv ein; die rezidivfreie Überlebensrate lag nach sechs Monaten bei 76%, nach einem Jahr bei 55%, danach sind bisher keine Rezidive aufgetreten. 79% der Patienten sind nach einem Jahr noch am Leben, 18 (33%) befinden sich bisher über ein Jahr lang in Remission, 13 von ihnen (24%) ohne jede weitere Therapie. Bei allen Patienten, die vorher bereits eine allogene Transplantation erhalten hatten, waren 100% der veränderten und infundierten Zellen vom Donor-Typ, ohne dass darunter eine Graft-versus-Host-Reaktion aufgetreten wäre. Zwei Drittel der 20 Rezidive bestanden aus CD19-negativen Blasten, ein Phänomen, dem ein Antigen-Escape-Mechanismus zugrunde liegt. Die übrigen Patienten, die mit CD19-positiven Blasten rezidivierten, hatten innerhalb der ersten drei Monate der Therapie eine rasche Abnahme der CTL019-Zellen gezeigt.
Die Toxizität der Therapie ist nicht vernachlässig-, aber beherrschbar: 88% der Patienten entwickelten zum Zeitpunkt der maximalen Expansion der CAR-T-Zellen ein Zytokin-Release-Syndrom, das in etwa einem Viertel der Fälle schwer war, d. h. es ging hier mit hämodynamischer oder respiratorischer Instabilität und insbesondere mit starker Erhöhung der Ferritin- und Interleukin-6-Titer einher, sprach aber in allen Fällen gut auf die Gabe des IL-6-Antagonisten Tocilizumab an. Die persistierende Anwesenheit von CTL019-Zellen äußert sich in allen Fällen in einer B-Zell-Aplasie, weil auch normale B-Lymphozyten das CD19-Antigen exprimieren; diese Nebenwirkung lässt sich aber durch die intravenöse Gabe von Immunglobulinen behandeln, ohne dass es darunter zu nennenswerten infektiösen Komplikationen kommt.
CAR-T-Zellen wirken auch bei Erwachsenen
Auch Kollegen am Memorial Sloan Kettering Cancer Center entwickelten gegen CD19 gerichtete CAR-T-Zellen; sie arbeiten mit einem etwas anderen gentechnischen Verfahren. Diese Zellen waren ebenfalls in einer Phase-I-Studie bei erwachsenen Patienten mit rezidivierter oder refraktärer ALL hocheffektiv [11], und auch hierzu konnte Jae Park, New York, Langzeit-Ergebnisse vorstellen [12]: Alle 45 auswertbaren Patienten (14 davon Ph-positiv) hatten vor der Infusion der CAR-T-Zellen eine Chemotherapie mit Cyclophosphamid mit oder ohne Fludarabin, 18 (39%) hatten vorher eine allogene Stammzelltransplantation und 26 (57%) mindestens drei Therapielinien erhalten. Nach Infusion der Zellen erreichten 37 Patienten (82%) eine komplette Remission, bei 30 von 36 daraufhin untersuchten Patienten war diese MRD-negativ.
Die mediane Nachbeobachtungszeit liegt in dieser Studie erst bei sechs Monaten, bei 16 Patienten ist sie länger als ein halbes Jahr. Das mediane Gesamtüberleben beträgt insgesamt 9,0, bei den nach Therapie MRD-negativen Patienten 10,6 Monate. Das Erreichen dieses Status war hochgradig prädiktiv für das Überleben: Von diesen Patienten waren nach einem halben Jahr noch 76%, von denjenigen mit positivem MRD-Status lediglich 14% am Leben. Eine allogene Transplantation, egal ob sie vor oder nach Infusion der Zellen durchgeführt worden war, wirkte sich hingegen nicht auf das Überleben aus.
Ein schweres Zytokin-Release-Syndrom trat in diesem Kollektiv bei einem Viertel der Patienten auf, eine Neurotoxizität vom Grad 3 oder 4 bei 28%; Grad-5-Toxizitäten wurden bei drei Patienten beobachtet, in zwei Fällen eine Sepsis mit Multi-Organ-Versagen, in einem Fall epileptische Anfälle. Die Rekrutierung von Patienten geht weiter, so Park, die Studie wird zu einer Phase-II-Studie ausgeweitet.
Die ALL des Kindes und des Erwachsenen unterscheiden sich erheblich, vor allem hinsichtlich der Prognose. An der Studie aus Philadelphia nahmen allerdings Kinder mit stark vorbehandelter Erkrankung teil, deren Prognose mit den herkömmlichen Therapieoptionen wahrscheinlich ähnlich schlecht gewesen wäre wie die der erwachsenen Patienten in der New Yorker Studie. Die bisher vorgestellten Ergebnisse mit den gegen CD19 gerichteten CAR-T-Zellen sind sehr ermutigend; dieser Ansatz könnte in dieser Situation eine echte Alternative zu einer zweiten allogenen Stammzelltransplantation werden, deren Erfolgsaussichten doch sehr begrenzt sind.
Akute myeloische Leukämie
Erstmals mit zielgerichtetem Medikament Überlebensverlängerung
Bei der akuten myeloischen Leukämie (AML) war eines der Highlights von Orlando – das demzufolge auch in der Plenarsitzung vorgestellt wurde – die erste Phase-III-Studie, in der eine neue, zielgerichtete Substanz die Überlebenschancen von Patienten aus einer AML-Subgruppe verbessern konnte.
Aktivierende Mutationen in der juxtamembranösen Region (Interne Tandemduplikation, FLT3-ITD) und der Tyrosinkinase-Domäne (FLT3-TKD) des Oberflächenrezeptors FLT3 auf den leukämischen Blasten stellen mit 30–40% die häufigsten genetischen Alterationen bei der AML dar und sind (insbesondere FLT3-ITD) mit einem hohen Rezidivrisiko und einer schlechten Prognose assoziiert. Midostaurin ist ein niedermolekularer Inhibitor, der neben einer Reihe anderer Proteine auch FLT3 hemmt, in AML-Zelllinien wirksam ist und in einer klinischen Phase-Ib-Studie in Kombination mit einer Chemotherapie günstig bezüglich des Ansprechens und des Überlebens zu wirken schien [13].
In eine globale Phase-III-Studie unter Beteiligung von drei deutschen Studiengruppen wurden deshalb in 225 Zentren in 17 Ländern 717 Patienten im Alter zwischen 18 und 60 Jahren mit neu diagnostizierter AML mit FLT3-Mutationen, aber keiner akuten Promyelozyten-Leukämie (APL) eingeschlossen [14]. Sie konnten bis zum Vorliegen des Testergebnisses Hydroxyharnstoff erhalten, bekamen dann eine Standard-Chemotherapie mit ein bis zwei Induktionszyklen (Daunorubicin, Cytarabin) und bis zu vier Konsolidierungszyklen (hochdosiertes Cytarabin) und wurden randomisiert, doppelblind zusätzlich entweder Placebo oder Midostaurin einzunehmen (letzteres zweimal täglich 50 mg oral an den Tagen 8–21 jedes Induktions- und Konsolidierungszyklus und anschließend für ein Jahr täglich als Erhaltungstherapie). Primärer Endpunkt war das Gesamtüberleben ohne Berücksichtigung einer eventuell durchgeführten Stammzelltransplantation, sekundärer Endpunkt das ereignisfreie Überleben, wobei als Ereignisse Tod, Rezidiv oder keine Komplettremission innerhalb von 61 Tagen nach Beginn der Induktionstherapie galten.
Zum Zeitpunkt der Analyse, die Richard Stone, Boston, präsentierte, erhielt kein Patient mehr aktive Therapie, die Nachbeobachtungszeit der überlebenden Patienten lag bei median 57 Monaten. Es gab keine Unterschiede zwischen beiden Armen bezüglich Toxizitäten und Komplettremissionsraten (59% unter Midostaurin, 53% unter Placebo), wohl aber eine signifikante Überlegenheit des FLT3-Inhibitors bezüglich des Gesamtüberlebens: Die mediane Überlebenszeit lag unter Midostaurin bei 74,7, unter Placebo bei 26,0 Monaten (p log-rank = 0,007), nach fünf Jahren waren noch 50,8% versus 43,1% der Patienten am Leben
(HR 0,77; Abb. 3).
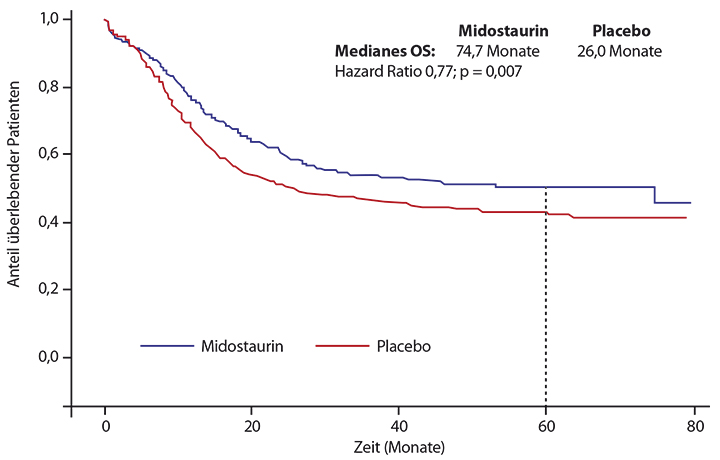
57% der Patienten erhielten eine allogene Stammzelltransplantation (25% in der ersten Komplettremission), und auch wenn das berücksichtigt wurde, war Midostaurin signifikant überlegen (mediane Überlebenszeit in beiden Armen nicht erreicht, 5-Jahres-Raten 62,6% vs. 54,9%; plog-rank = 0,047; HR 0,77). Auch beim ereignisfreien Überleben schnitt die Midostaurin-Gruppe mit einer Hazard Ratio von 0,80 besser ab (p = 0,0044). Der Vorteil durch den FLT3-Inhibitor war unabhängig von der Art der FLT3-Mutation.
Nach vielen Jahren der Stagnation ist es damit erstmals gelungen, mit einem zielgerichteten Medikament die Prognose einer bedeutsamen Subgruppe von jüngeren Erwachsenen mit AML klinisch relevant zu verbessern. Die Zulassung für die Substanz soll in diesem Jahr weltweit beantragt werden.
CLARA: Bei nicht transplantierten Patienten mit deutlichem Nutzen
Eine französische Phase-III-Studie konnte nachweisen, dass eine Verfeinerung der Konsolidierungstherapie mit dem Purin-Analogon Clofarabin das krankheitsfreie Überleben von jüngeren AML-Patienten, die keine allogene Stammzelltransplantation erhalten können, verlängert: Nachdem Clofarabin in zwei randomisierten Studien trotz höherer Ansprechraten das Überleben im Vergleich zu Cytarabin nicht hatte verbessern können – vermutlich aufgrund der erhöhten Toxizität [15, 16], – gingen die französischen Kollegen einen anderen Weg, indem sie Clofarabin in der Postremissions-Therapie mit dosisreduziertem Cytarabin kombinierten [17].
Im Rahmen der ALFA-0702/Clara-Studie wurden insgesamt 221 bis zu 60-jährige AML-Patienten mit intermediärem oder hohem Risiko, die nach einer klassischen Induktionstherapie mit Daunorubicin, Cytarabin und G-CSF einer weiteren Therapie bedurften, für die aber keine allogene Stammzelltransplantation geplant war, für eine Konsolidierungsbehandlung randomisiert, so Xavier Thomas, Lyon: Sie erhielten neben G-CSF entweder hochdosiertes AraC (3 g/m2 an den Tagen 1, 3 und 5) oder das sogenannte CLARA-Regime (Clofarabin 30 mg/m2 an den Tagen 2–6 und Cytarabin in der reduzierten Dosierung von 1 g/m2 an den Tagen 1–5).
Primärer Endpunkt war das krankheitsfreie Überleben, und hier schnitt CLARA nach zwei Jahren im Gesamtkollektiv mit 57,8% vs. 45,6% zwar numerisch, aber nicht signifikant besser ab (HR 1,34; p = 0,122). Wurden allerdings die Patienten, die anschließend an die Konsolidierung eine Transplantation erhalten haben, zensoriert, so war der Unterschied für die übrigen sehr wohl signifikant und auch klinisch relevant mit 52,1% vs. 30,5% nach zwei Jahren (HR 1,61; p = 0,042).
Entsprechend war hier auch das
Rezidivrisiko nach zwei Jahren mit 44,0% vs. 67,7% signifikant reduziert (p = 0,023), während der Unterschied beim Gesamtüberleben in diesem Subkollektiv mit 68,1% vs. 49,8% absolut zwar beinahe 20% betrug, aber nicht signifikant war (HR 1,47; p = 0,182). Die transplantierten Patienten schnitten beim krankheitsfreien Überleben zwar besser ab als die nicht transplantierten, aber die Zugabe von Clofarabin hatte hier keinen Effekt.
Hingegen war die Hämatotoxizität im CLARA-Arm deutlich höher, was sowohl Zytopenien insgesamt als auch Anämien, febrile Neutropenien, Infektionen, Aspergillosen und alle Grad-3/4-Toxizitäten anging, aber das ging nicht mit einem erhöhten Anteil an therapiebedingten Todesfällen einher.
Den französischen Kollegen zufolge könnte das CLARA-Protokoll ein neuer Standard für die Postremissions-Therapie von AML-Patienten mit intermediärem oder ungünstigem Risiko in der ersten Komplettremission werden, insbesondere für solche, die nicht vom Nutzen einer allogenen Stammzelltransplantation profitieren können. Zugelassen ist Clofarabin allerdings derzeit nur für pädiatrische Patienten mit refraktärer ALL.
Pädiatrische APL: Arsen erhöht auch hier die Wirksamkeit
Bei der akuten Promyelozyten-Leukämie (APL) werden bei erwachsenen Patienten zunehmend All-trans-Retinsäure (ATRA) und Arsentrioxid (ATO) eingesetzt, die in der italienisch-deutschen APL0406-Studie auch in der Erstlinie (für die ATO formal nicht zugelassen ist) bessere Ergebnisse erbracht haben als die Kombination aus ATRA und Chemotherapie [18]. Bei pädiatrischen Patienten, bei denen die APL mit Translokation t(15;17) und/oder dem PML/RARA-Fusionsgen etwa 5–10% aller AML-Fälle ausmacht, gibt es bisher nicht viele Daten zu dieser Kombination. In der bisher größten pädiatrischen Studie zu dieser Indikation, der italienischen AIDA0493-Studie, hatten die Patienten zur Induktion eine Kombination aus ATRA und Idarubicin (AIDA) und zur Konsolidierung drei Zyklen einer Polychemotherapie erhalten [19]. Die Ergebnisse (Gesamtüberleben 89%, ereignisfreies Überleben 76% nach über zehn Jahren) sollten als historische Kontrolldaten für die einarmige Phase-III-Studie AAML0631 der US-amerikanischen Children´s Oncology Group dienen, die Matthew Kutny, Birmingham, Alabama, in Orlando vorstellte [20]:
Insgesamt 108 Patienten, von denen 101 auswertbar waren, wurden im Verlauf von dreieinhalb Jahren eingeschlossen und erhielten nach einer AIDA-Induktionstherapie (dreimal 12 mg/m2 Idarubicin und ATRA an den Tagen 1–30) einen Konsolidierungszyklus mit ATRA und ATO. Bei Erreichen einer hämatologischen Komplettremission schlossen sich zwei weitere Konsolidierungszyklen – einmal mit Cytarabin, Mitoxantron,
ATRA und intrathekalem Cytarabin sowie mit Idarubicin, ATRA und i. t. Cytarabin – an. Bei hohem Risiko (≥ 10.000 Leukozyten/µl, 35 von 101 Patienten) oder Standardrisiko und MRD-Positivität wurde noch ein vierter Zyklus mit Cytarabin, Idarubicin und ATRA gegeben. Anschließend folgte eine Erhaltungstherapie mit neun Zyklen Mercaptopurin, Methotrexat und ATRA.
Eine hämatologische Komplettremission war nach Ende der Induktion bei 81% und nach Ende des ersten Konsolidierungszyklus bei allen 101 Patienten zu sehen. Nach Abschluss des Konsolidierungsregimes waren alle daraufhin untersuchten Patienten MRD-negativ (RQ-PCR). Die Gesamtüberlebensraten lagen nach drei Jahren für das gesamte Kollektiv bei 94%, für die Hochrisiko-Patienten bei 86% und für diejenigen mit Standardrisiko bei 98%. Die ereignisfreien Überlebensraten für die beiden letzteren Gruppen betrugen 83% und 95% gegenüber 71% und 93% in der italienischen Studie. Neben dieser Verbesserung der Prognose konnte durch die Hinzunahme von ATO in den ersten Konsolidierungszyklus die Anthrazyklin-Dosis bei den Standardrisiko-Patienten um 45% und bei denen mit hohem Risiko um 38% reduziert werden.
Diese Ergebnisse, so Kutny, stützen bereits sehr stark die Anwendung von ATO im pädiatrischen Setting; als nächsten Schritt wird die Children´s Oncology Group in ihrer kommenden Studie AAML1331 bei den jungen Patienten das ATRA/ATO-Regime für Erwachsene aus der APL0406-Studie [18] testen.
Arsentrioxid nur in der Konsolidierung geben?
Obwohl eine Primärtherapie mit
ATRA und ATO in der APL0406-Studie [18] bei Patienten mit Standardrisiko (< 10.000 Leukozyten/µl) und in einer britischen Phase-III-Studie [21] auch bei Patienten mit hohem Risiko mindestens so wirksam war wie ATRA mit Chemotherapie und dabei weniger Myelo- bzw. Lebertoxizität zeigte, ist ATO für die Erstlinientherapie nicht zugelassen und daher in vielen Ländern nur eingeschränkt verfügbar. Die französisch-belgisch-schweizerische APL-Studiengruppe untersuchte deshalb in einer dreiarmigen randomisierten Studie, ob die Hinzunahme von ATO nur in der Konsolidierung eine Reduktion der Anthrazyklin-Dosierung zulässt, ohne dabei Kompromisse bei der Wirksamkeit einzugehen [22].
353 Patienten mit APL und Standardrisiko konnten nach einer klassischen Induktion mit ATRA, Idarubicin und Cytarabin randomisiert werden, eine Konsolidierung zu erhalten, die in allen drei Armen im ersten Zyklus dreimal
12 mg/m2 und im zweiten 9 mg/m2 Idarubicin enthielt. Dazu erhielten die Patienten entweder Cytarabin oder ATO oder ATRA. Anschließend folgte bei allen eine Erhaltungstherapie mit intermittierendem ATRA und kontinuierlichem Methotrexat und 6-Mercaptopurin.
Primärer Endpunkt war das ereignisfreie Überleben, und hier unterschieden sich die drei Arme nach fünf Jahren mit 90,8% (Cytarabin), 92,5% (ATO) und 86,8% (ATRA) ebenso wenig wie beim Gesamtüberleben (93,6%, 92,8%, 91,9%), so Lionel Ades, Paris. Rezidive waren allerdings nach fünf Jahren im ATO-Arm überhaupt keine aufgetreten gegenüber 3,9% im Cytarabin- und 7,4% im ATRA-Arm.
Bezüglich der Toxizität war ATRA überlegen (gemessen etwa anhand der Tage mit stationärer Behandlung während der beiden Konsolidierungszyklen), aber das erhöhte Rezidivrisiko unter dem Retinoid lässt sich durch die Gabe von ATO in der Konsolidierung offenbar noch einmal reduzieren, so Ades.
Bcl-2-Inhibitor auch bei AML vielversprechend
Ein Alter von über 65 Jahren ist ein negativer Prognosefaktor für Patienten mit AML, vor allem weil hier keine aggressiven Chemotherapien mehr gegeben werden können. Neue, gut verträgliche therapeutische Optionen sind hier dringend erforderlich, und eine davon könnte Venetoclax sein, ein Inhibitor des anti-apoptotischen Proteins Bcl-2, der sich bei der chronischen lymphatischen Leukämie bereits in einem fortgeschrittenen Stadium der Entwicklung befindet [23]. In einer US-amerikanischen Phase-Ib-Studie wurde Venetoclax in zwei Dosierungen (400 und 800 mg/d) bei über 65-jährigen AML-Patienten mit intermediärem oder ungünstigem zytogenetischem Risiko in Kombination mit den hypomethylierenden Agenzien Decitabin oder Azazytidin getestet [24].
Bisher 34 behandelte Patienten, so Courtney DiNardo, Houston, konnten im Median 106 Tage lang therapiert werden. Von ihnen erzielten 24 eine Komplettremission, je zur Hälfte mit bzw. ohne komplette Erholung der Hämatopoese. Die Wirksamkeit schien dabei bei der niedrigeren Venetoclax-Dosis und in der Kombination mit Azacitidin höher zu sein, aber angesichts der geringen Patientenzahlen sind hier keine sicheren Aussagen möglich. Es wurden bisher keine dosislimitierenden Toxizitäten beobachtet, sodass die Studie mit einer weiteren Dosiseskalation fortgeführt wird, so DiNardo.
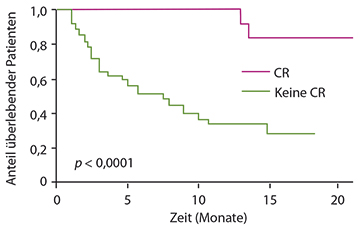
Auch in der ebenfalls amerikanischen Phase-II-Studie MEI-004 wurden ältere AML-Patienten behandelt, und zwar mit einer Kombination aus Azazitidin und dem oralen Histondeacetylase-Inhibitor Pracinostat, der in der Phase I sowohl bei AML als auch bei myelodysplastischen Syndromen in dieser Kombination hohe Komplettremissionsraten ergeben hatte. Bisher 50 Patienten haben in der Phase-II-Studie die Kombination (mit 60 mg/d Pracinostat) erhalten, so Guillermo Garcia-Manero, Houston [25]. Die Komplettremissionsrate liegt bei 42%, die 60-Tages-Mortalitätsrate bei 10%, die 1-Jahres-Überlebensrate bei 62% und die mediane Überlebensdauer beträgt über 14 Monate. Alle Werte sind damit deutlich besser als bei einem ähnlichen Patientenkollektiv in der AZA-001-Studie mit Azazitidin alleine. Patienten mit intermediärem Risiko hatten nicht-signifikant bessere Überlebenschancen als jene mit hohem Risiko, vor allem aber schnitten diejenigen, die eine Komplettremission erzielen konnten, erheblich besser ab als die mit weniger gutem Ansprechen (p < 0,0001; Abb. 4).
Literatur
1. Maury S et al. ASH 2015, Abstract #1.
2. DeAngelo DJ et al. EHA 2015, Abstract #LB2073.
3. Jabbour E et al. ASH 2015, Abstract #83.
4. O’Brien S et al. Cancer 2008; 113: 2097-106.
5. Gökbuget N et al. ASH 2014, Abstract #379.
6. Gökbuget N et al. ASH 2015, Abstract #680.
7. Martinelli G et al. ASH 2015, Abstract #679.
8. Grupp SA et al. N Engl J Med 2013, 368: 1509-18.
9. Maude S et al. N Engl J Med 2014; 371: 1507-17.
10. Grupp SA et al. ASH 2015, Abstract #681.
11. Park JH et al. ASH 2014, Abstract #382.
12. Park JH et al. ASH 2015, Abstract #682.
13. Stone RM et al. Leukemia 2012; 26: 2061-8.
14. Stone RM et al. ASH 2015, Abstract #6.
15. Burnett AK et al. Blood 2013; 122: 1384-94.
16. Faderl S et al. J Clin Oncol 2012; 30: 2492-9.
17. Thomas X et al. ASH 2015, Abstract #218.
18. Lo-Coco F et al. N Engl J Med 2013; 369: 111-21.
19. Testi AM et al. Blood 2005; 106: 447-53.
20. Kutny MA, ASH 2015, Abstract #219.
21. Burnett AK et al. Lancet Oncol 2015; 16: 1295-305.
22. Ades L et al. ASH 2015, Abstract #451.
23. Roberts AW et al. N Engl J Med 2015; Dec 6 [prepub ahead of print, DOI 10.1056/NEJMoa1513257].
24. DiNardo C et al. ASH 2015, Abstract #327.
25. Garcia-Manero G et al. ASH 2015, Abstract #453.

Prof. Dr. med. Karl-Anton Kreuzer
Klinik I für Innere Medizin
Universitätsklinikum Köln
Kerpener Straße 62
50937 Köln
+49 221 47897626
+49 221 47897627
karl-anton.kreuzer[at]uni-koeln[dot]de

