WCCS/EADO 2016: Umgang mit neuen Therapieoptionen bleibt eine Herausforderung
Patientenselektion zur Optimierung der Immuntherapie
Um die Therapieerfolge beim malignen Melanom weiter zu verbessern, müssen Patienten identifiziert werden, die von bestimmten Regimes profitieren, erklärte Christian Blank, Amsterdam. Die kombinierte Immuntherapie mit PD1- und CTLA4-Inhibition erreiche häufiger eine Remission als die Einzeltherapien, wie z. B. in der CheckMate-067-Studie gezeigt [1]; am Ende sei aber offenbar nicht von Bedeutung, durch welche Immuntherapie ein Ansprechen erreicht werde, sondern nur, dass tatsächlich eine Remission eintrete. Zeigten Patienten ein Ansprechen auf eine Immuntherapie, so war die Dauer der Remission, z. B. in der KEYNOTE-006-Studie, unter verschiedenen Substanzen in unterschiedlichen Dosierungen vergleichbar [2]. Somit sei die Reaktion des Immunsystems die eigentliche Therapie und nicht die Infusion als solche, erklärte Blank.
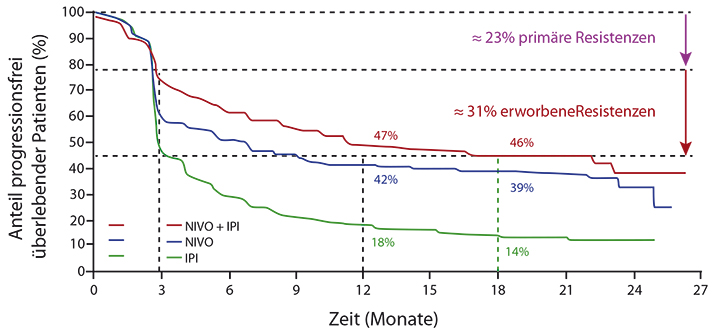
Primäre Resistenzen gegenüber Immuntherapien seien nicht sehr häufig, so Blank mit Verweis auf den kleinen Teil der Studienteilnehmer, die innerhalb der ersten drei Monate nach Therapiebeginn mit einer Immuntherapie versterben. Erworbene Resistenzen seien der wesentliche Grund für den Verlust des Ansprechens. Dies geschehe nach den Ergebnissen der CheckMate-067-Studie etwa zwischen drei Monaten und dem Beginn der Plateaubildung für das progressionsfreie Überleben (PFS) nach etwa zwei Jahren (Abb. 1; [3]). Ein Hinweis auf eine erworbene Resistenz könne vielleicht die Laktatdehydrogenase (LDH) sein, die als stärkster prognostischer Faktor bei Immuntherapien im Vordergrund stehe. Jedenfalls profitiert ein Teil der Patienten langfristig von einer Immuntherapie, sei es die CTLA4- oder die PD1-Hemmung oder eine Kombination der Antikörper. Liegen optimale Voraussetzungen vor, so sei eine Therapie mit Ipilimumab ausreichend, um eine langanhaltende Remission zu induzieren, konstatierte Blank. Sind LDH und die Inflammationsmarker ESR/CRP hingegen hoch, die absolute Lymphozytenzahl (ALC) und die Zahl der intratumoralen CD8-Zellen niedrig, so sei mit Ipilimumab kein Therapieerfolg zu erwarten. Die PD-L1-Expression sei ebenfalls ein aussagekräftiger Marker für das Ansprechen oder möglicherweise für eine primäre Resistenz gegenüber einer Anti-PD1-haltigen Therapie, sagte Blank.
Korrelation zwischen Metastasenlokalisation und Ansprechen auf PD-1-Hemmung
Mit einer in Wien präsentierten multizentrischen retrospektiven Untersuchung bestätigten Simone Goldinger, Zürich, und Kollegen die Vermutung, dass auch die Metastasenlokalisation ein Marker für den Therapieerfolg sein kann [4]. Sie werteten die Charakteristik und den Therapieerfolg bei Patienten mit metastasiertem Melanom, die an Zentren in Zürich und San Francisco mit einem
PD-1-Antikörper behandelt wurden, aus. Die Beurteilung des Ansprechens erfolgte nach RECIST v1.1. Die Wissenschaftler wendeten ein multivariates Regressionsmodell an, um Assoziationen zwischen demografischen und klinischen Variablen und dem Ansprechen zu identifizieren.
In die Analyse wurden 337 Patienten, die Pembrolizumab oder Nivolumab erhalten hatten, einbezogen, von denen 228 keine Lebermetastasierung und 109 Lebermetastasen aufwiesen. Dabei fällt auf, dass Patienten mit Lebermetastasierung häufiger ein erhöhtes LDH aufwiesen als diejenigen ohne Lebermetastasen. Patienten mit Lebermetastasierung hatten weniger häufig auch Hirn- oder Lungenmetastasen. In der multivariaten Analyse zeigten Patienten mit Lebermetastasen (p < 0,0001) und vorangegangener Ipilimumab-Therapie eine geringere Wahrscheinlichkeit, auf die Anti-PD-1-Therapie anzusprechen (p = 0,0002; Abb. 2). Patienten mit Lungenmetastasen sprachen hingegen häufiger auf die Therapie an (p = 0,06).
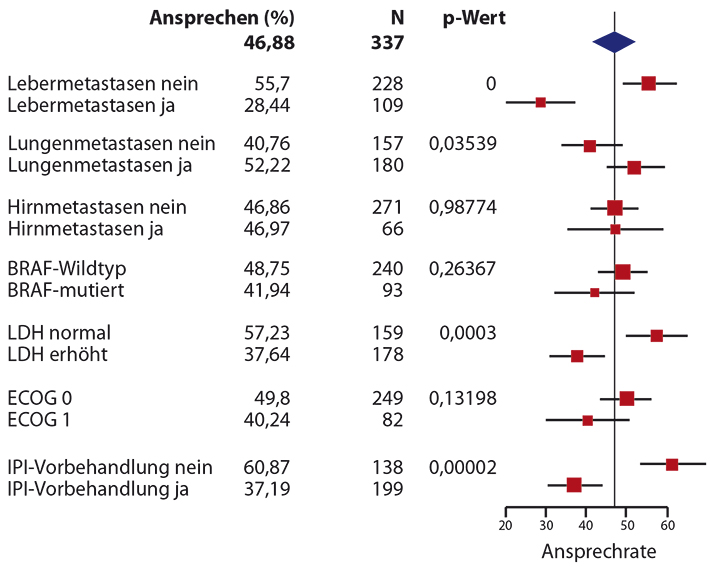
Die Autoren schlossen aus den Ergebnissen, dass eine signifikante Korrelation zwischen Lebermetastasierung sowie vorangegangener Ipilimumab-Applikation einerseits mit einem geringeren Ansprechen auf die Anti-PD1-Therapie andererseits besteht. Das Vorhandensein von Lungenmetastasen war mit einem verbesserten Ansprechen korreliert. Damit ist ein wichtiger Parameter gegeben, der in die Biomarker-Analyse hineinspielt. Des Weiteren sollten mehr klinische Faktoren und Biomarker mit Hinblick auf das Ansprechen untersucht werden, wie zum Beispiel die Mikroumgebung des Tumors, so die Autoren.
Frühe Therapie gegen Mikrometastasen im Hirn
Die Prävention von Hirnmetastasen sei möglicherweise die erfolgversprechende Strategie bei bestehender symptomatischer Metastasierung, sagte Anna Sophie Berghoff, Heidelberg/Wien. Sie beschäftigt sich mit der Identifizierung von Zielstrukturen bei der Entwicklung von Hirnmetastasen. Dazu entwickelte ihre Arbeitsgruppe ein Mausmodell, das es erlaubt, Tumorzellen und Blutgefäße in vivo zu beobachten. So wurde entdeckt, dass die Angiogenese essenziell für die Entwicklung von Hirnmetastasen des Lungenkarzinoms, nicht aber für die Entwicklung von Hirnmetastasen beim Melanom ist. Die Melanomzellen lagern sich laut ihren Beobachtungen peripher um die Blutgefäße an, induzierten aber nicht unbedingt eine Neubildung von Gefäßen.
Somit sei beim Bronchialkarzinom im Gegensatz zum Melanom die Angiogenese ein potenzielles Ziel. Beim Melanom zeigte die Arbeitsgruppe, dass die Permeabilität der Mikrogefäße der Hirnmetastasen unterschiedlich ist und in einem unterschiedlichen Wachstum der Metastasen, aber auch in verschieden starker Wirksamkeit systemischer Therapien resultiert [5]. Ist die Blut-Hirn-Schranke bei Metastasierung intakt, so wird ein Ansprechen nur mit systemischen Therapien erreicht, die die Blut-Hirn-Schranke überwinden können. Bezüglich des Wachstumsmusters zeigen Hirnmetastasen mit permeabler Blut-Hirn-Schranke ein schnelleres, rundliches Wachstumsmuster um Blutgefäße herum, während Hirnmetastasen mit nicht-permeabler Blut-Hirn-Schranke eher ein langsameres, diffuses Wachstum zeigen. Mit einem die Bluthirnschanke passierenden mTOR-Inhibitor wurde das Wachstum von Makrometastasen aus einer nicht-permeablen Hirnmetastase reduziert, Mikrometastasen entwickelten sich komplett zurück. Ein früher Einsatz von zielgerichteten Therapien könne somit zur kompletten Remission von Hirnmetastasen und schlafenden Melanomzellen führen, so Berghoff.
In-vivo-Untersuchungen zur Rolle der Mikroglia im Verlauf der Entstehung von Hirnmetastasen zeigten zwei verschiedene Muster der Interaktion mit Hirnmetastasen-Zellen: Kam es im Mausmodell zur dichten Akkumulation von Mikroglia um die Metastasenzellen, so wurde der Tumor reduziert und die Maus überlebte, während sich Tumoren ohne Kontakt mit der Mikroglia weiterentwickelten und die Tiere töteten. Möglicherweise könnten CSF1R- oder CCL5-Inhibitoren die Aktivität der Mikroglia positiv beeinflussen, spekulierte Berghoff. Die nächsten Ziele der Arbeitsgruppe seien klinische Studien, um die präventiven Strategien zu bestätigen.
Medikamentöse Behandlung von Hirnmetastasen
Matthias Preusser, Wien, ging auf die neuen zielgerichteten und Immuntherapien und ihren Einfluss auf die Hirnmetastasierung ein. Sowohl die zielgerichtete als auch die Immuntherapie zeigt Aktivität bei unbehandelten Hirnmetastasen. Mit dem BRAF-Inhibitor Dabrafenib wurde in einer Phase-I-Studie mit 156 Melanom-Patienten eine Reduktion der Läsionen bei neun von zehn Patienten mit unbehandelten Hirnmetastasen beobachtet [6]. Eine hohe PD-L1-Expression von Hirnmetastasen bei Melanom-Patienten und das Vorhandensein von Tumor-infiltrierenden Lymphozyten deutet auch auf den Nutzen von PD1-Checkpoint-Inhibitoren hin [7], was sich in einer Phase-II-Studie mit Pembrolizumab bestätigte [8]: 22% der 18 eingeschlossenen Melanom-Patienten zeigten ein partielles Ansprechen der unbehandelten Hirnmetastasen, welches bislang anhält. Eine optimale Kombination oder Sequenz der neuen und bestehender Therapien sei allerdings auch in Bezug auf die Hirnmetastasierung unklar, bemerkte Preusser. Um die Hirnmetastasierung frühzeitiger diagnostizieren und den Verlauf der Mutationen unter Therapie verfolgen zu können, sei die Untersuchung der zellfreien DNA in der zerebrospinalen Flüssigkeit auf genetische Alterationen möglicherweise hilfreich [9]. Sie gebe auch Hinweise für die personalisierte Medizin der Hirnmetastasen.
Früher und adjuvanter Therapieeinsatz in der Melanomtherapie
Für den langfristigen Therapieerfolg scheinen – zumindest teilweise – die gleichen Biomarker für zielgerichtete wie Immuntherapien Anwendung zu finden, bemerkte Blank. Ein früher Einsatz in der metastasierten Situation scheine den Erfolg beider Therapiestrategien zu verbessern und die Kombination verhindere möglicherweise die Entwicklung einiger langfristig erworbener Resistenzen. Mit Interferon-alpha (IFN-α) und Ipilimumab konnte auch in der adjuvanten Therapie von Hochrisiko-Patienten ein signifikanter und dauerhafter Therapieerfolg erzielt werden, so John Kirkwood, Pittsburgh. Allerdings beschränke sich der Erfolg auf etwa ein Drittel der Patienten, sodass mithilfe der Kombination mit Anti-PD1-Therapien oder zielgerichteten Therapien eine Optimierung der adjuvanten Therapie angestrebt werde.
Um zu prüfen, ob die Ergebnisse der adjuvanten Behandlung auch auf die neoadjuvante Situation übertragbar sind, wurden in einer Phase-II-Studie Melanom-Patienten mit entweder 3 mg/kg oder 10 mg/kg Ipilimumab, jeweils in Kombination mit Hochdosis-IFN-α2b behandelt [10]. Ein Ansprechen wurde bei 36% der Patienten gesehen. Mit der höheren Dosierung von Ipilimumab wurde häufiger ein präoperatives Ansprechen erreicht, allerdings traten auch Nebenwirkungen vom Grad 3/4 häufiger auf. Die nächste Aufgabe sei es, so Kirkwood zur (neo-)adjuvanten Therapie, Biomarker für die Patientenselektion zu identifizieren und biologisch sinnvolle Studien aufzulegen. Die PD1-Blockade sei beispielsweise am wirksamsten bei inflammatorischen Tumoren. Daher werde in diesem Setting eine neoadjuvante Studie mit Pembrolizumab plus Hochdosis-Interferon durchgeführt [11].
Prävention von Hautkrebs nicht vergessen
Etwa 90% der kutanen Melanome und des hellen Hautkrebses werden durch UV-Bestrahlung verursacht. Dabei ist das Sonnenbaden die gefährlichste Art der UV-Exposition. Sonnenbrände führen zu Mutationen. Schwer beschädigte Keratinozyten gehen in die Apoptose, geschädigte Melanozyten können überleben. Ein intensiver Sonnenschutz führte laut einer australischen Studie folgerichtig zu einer Reduzierung der Plattenepithelkarzinome der Haut [12]. Eine Studie mit 1.812 Kindergarten-Kindern zeigte allerdings auch eine vermehrte Entwicklung von melanozytären Nävi, wenn Kinder keinen Sonnenbrand hatten und nur einer moderaten UV-Strahlung ausgesetzt waren [13]. Als Risikofaktoren wurden die Tage der Sommerferien und Outdoor-Aktivitäten identifiziert. Vorangegangene Sonnenbrände und geringerer Sonnenschutzfaktor waren in dieser Untersuchung keine unabhängigen Risikofaktoren. Einen Schutz vor Hautkrebs bot vor allem eine angemessen lange Kleidung [14]. „Wir müssen eine klare Botschaft zur effektiven Prävention von Hautkrebs verbreiten“, betonte Garbe: „Sonnencreme hilft gegen Sonnenbrand, aber nicht gegen Hautkrebs! Die Bräunung der Haut ist ein Zeichen für Mutationen!“ Die Entwicklungen bezüglich der Operation und der medikamentösen Behandlung von Hautkrebs seien wichtig und bemerkenswert. Ein vorrangiger Fokus sollte in der Zukunft aber auf der Prävention von Hautkrebserkrankungen liegen.
Ine Schmale
Literatur
1. Larkin J et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373: 23-34.
2. Schachter J et al. Pembrolizumab versus ipilimumab for advanced melanoma: Final overall survival analysis of KEYNOTE-006. ASCO 2016, Abstract #9504.
3. Wolchok JD et al. Updated results from a phase III trial of nivolumab combined with ipilimumab in treatment-naive patients with advanced melanoma (Checkmate 067). ASCO 2016, Abstract #9505.
4. Goldinger SM et al. Correlation between metastatic site and response to PD-1 agents in melanoma. WCCS 2016, Abstract #P090.
5. Winkler F et al. Impact of blood-brain barrier integrity on tumor growth and therapy response in brain metastasis. Clin Cancer Res 2016, doi:10.1158/1078-0432.CCR-16-1327.
6. Falchook GS et al. Dabrafenib in patients with melanoma, untreated brain metastases, and other solid tumours: A phase 1 dose-escalation trial. Lancet 2012; 379: 1893-901.
7. Berghoff AS et al. Tumour-infiltration lymphocytes and expression of programmed death ligand 1 (PD-L1) in melanoma brain metastases. Histopathology 2015; 66: 289-99.
8. Goldberg SB et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases: Early analysis of a non-randomised, open-label, phase 2 trial. Lancet Oncol 2016; 17: 976-83.
9. Pentsova EI et al. Evaluating cancer of the central nervous system through next-generation sequencing of cerebrospinal fluid. J Clin Oncol 2016; 34: 2404-15.
10. Tarhini AA et al. Neoadjuvant combination immunotherapy with ipilimumab (3mg/kg or 10mg/kg) and high dose IFN-a2b in locally/regionally advanced melanoma. ASCO 2016, Abstract #9585.
11. Davar D et al. Phase IB study of pembrolizumab and pegylated interferon alfa-2b in advanced melanoma. ASCO 2016, Abstract #9539.
12. Green A et al. Daily sunscreen application and betacarotene supplementation in prevention of basal-cell and squamous-cell carcinomas of the skin: A randomised controlled trial. Lancet 1999; 354: 723-9.
13. Wiecker TS et al. Moderate sun exposure and nevus counts in parents are associated with development of melanocytic nevi in childhood. Cancer 2003; 97: 628-38.
14. Bauer J et al. Effect of sunscreen and clothing on the number of melanocytic nevi in 1,812 german children attending day care. Am J Epidemiol 2005; 161: 620-7.

